青土霉素废水出水对锦鲤肝脏抗氧化酶活性和丙二醛含量的影响
2013-11-05吴志刚沈洪艳高吉喜王勇军赵秀梅尚亚楼
吴志刚,沈洪艳* ,高吉喜 ,王勇军,赵秀梅,尚亚楼
(1.河北科技大学 环境科学与工程学院,河北 石家庄050080;2. 国家环保部 南京环境科学研究所,江苏 南京210042;3.华北制药股份有限公司环境保护研究所,河北 石家庄050015;4.华北制药华胜有限公司,河北 石家庄050021)
抗生素被广泛应用于人类医学及兽医和水产养殖中,它们的残留广泛存在于水环境中[1]。这些抗生素促使细菌种群中产生具有抗药性基因的新型污染物[2],并由生物体引起生态危害,最终对人类健康产生影响[3-4]。我国是世界上最大的抗生素生产国,青霉素和土霉素的产量居世界第一[5-6]。青霉素和土霉素均采用发酵法生产,生产过程中会排放大量废水。在我国,生产1 t 青霉素和1 t 土霉素的最高允许排水量分别为4.7 t 和1.3 t。按照我国环保规定,目前抗生素生产废水均需要在厂内进行处理,处理达标后出水排入城市污水处理厂。目前来看,污水处理厂对抗生素的去除仍不够彻底[7-9],使得抗生素类药物广泛存在于市政废水、医院废水、地表水和地下水中[10]。而污水处理厂是抗生素类药物进入环境的重要点源,因此水环境中抗生素的最主要来源是污水处理厂的处理废水。
当生物暴露于外源性污染物中时,污染物能够参与生物体内的氧化还原循环,并产生大量的活性氧,从而导致机体产生一系列氧化应激反应。超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是动物抵御活性氧伤害的2 种重要酶类,在清除超氧阴离子(O2-)和过氧化氢(H2O2),以及阻止或减少氧自由基方面起着十分重要的作用。正常情况下,机体自由基的产生和清除基本处于一个平衡状态[11]。当自由基含量增加,会引发机体脂质过氧化反应,形成醛基(MDA)等新的氧化自由基,对生物体造成损伤。近年来国内外在抗生素对生物的影响方面已开展了广泛研究,尤其是抗生素在水生生态系统方面的研究报道不断增多[12],但有关抗生素生产废水出水对水生生物鱼类影响的报道还不多。
本实验选取了具有代表性的含青霉素和土霉素2 种抗生素的混合废水在厂内污水处理厂处理后的二沉池出水,以锦鲤(Cyprinus carpio)为研究对象,探讨青霉素和土霉素混合废水出水对鱼体内抗氧化酶系中SOD、CAT 活性及脂质过氧化产物MDA 含量产生的影响,为进一步研究青霉素和土霉素在环境中的生态效应提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 水样 本实验水样取自某药厂污水处理厂青霉素和土霉素混合废水经处理后的二沉池出水。水样经分析测试中心检测,水样中含有土霉素(0.4 g/L)、青霉素(162 ug/L)、丁醇(1 ng/L)和乙酸丁酯(5 ng/L)。丁醇和乙酸丁酯是抗生素生产过程中的溶媒,2 种溶媒体没有毒性。
1.1.2 仪器和试剂 UV-2550 型紫外可见分光光度计;DK-S26 型恒温水浴锅;微量移液器若干;TG16-WS 台式高速离心机;SYZ-A 型石英亚沸高纯水蒸馏器;XK96-B 型快速混匀器;玻璃组织匀浆器若干;JPBJ—608 型便携式溶解氧测定仪;EL204 型电子分析天平;FE20 型pH 计;微型温度计和水硬度计(WAD-TH)等。SOD、CAT、MDA 和考马斯亮兰试剂盒均购自于南京建成生物工程研究所。
1.1.3 受试生物 选用锦鲤(Cyprinus carpio)为受试生物,由石家庄水产养殖基地提供,体长为(38.12±0.22)mm,体重为(1.72 ±0.28)g,鱼苗经质量分数5%食盐水消毒后进入实验室,用48 h 曝气的脱氯自来水在实验室驯养7 d 用于试验,试验水质符合渔业水质标准,驯养期间锦鲤死亡率<5%。
1.2 试验方法
根据青、土霉素混合废水出水对锦鲤急性毒性实验结果(96 h LC50=12.94%)即φ(96 h LC50)进行亚急性毒性浓度组设置,设置暴露浓度分别为1/4 φ(96 h LC50)、1/16 φ(96 h LC50)和1/256 φ(96 h LC50),暴露10 d。
将在实验室内驯养7 d 的试验鱼,随机放入暴露组和空白对照组,同时每一浓度组设置3 个平行,试验液用48 h 脱氯自来水进行稀释。在25 L 水族箱中分别加入20 L 试验溶液,每组投20 尾锦鲤,每2 d 测1 次MDA 含量和SOD、CAT 活性指标。
取样及样品前处理:每次从相应的浓度组中取3 条试验鱼,解剖,取其肝脏组织,在冰冷的生理盐水中漂洗,滤纸拭干,准确称取组织重量后,放入玻璃匀浆管中;用移液器按1∶9 重量体积比(W/V)量取预冷生理盐水,加入到匀浆管中进行匀浆,匀浆过程在冰水浴中进行,充分研磨约8 min,制得10%的组织匀浆;将制备好的匀浆液用普通离心机在3 000 r/min 下离心10 min,取其上清液保存于4 ℃冰箱中。
测定方法:SOD、CAT 活性和MDA 含量按试剂盒提供的方法进行测定。SOD 采用黄嘌呤氧化酶法测定,其活性单位定义为:在30 ℃条件下,每毫克组织蛋白在1 mL 反应液中SOD 抑制率达50%时所对应的SOD 量为一个SOD 活力单位(U)。CAT 采用可见光法测定,以每毫克组织蛋白每秒钟分解1 μmol 的H2O2量为一个酶活力单位(U)。MDA 测定采用硫代巴比妥酸反应(TBA)比色法,其单位为nmol/(mg·prot)。蛋白含量测定采用考马斯亮兰法。
实验条件:每次实验前到该药厂取水,以保证水的新鲜。试验用水pH 值为7 ~9;总硬度约为100 mg/L;试验温度为22 ~24 ℃;溶解氧不低于5 mg/L。暴露期间每日喂1 次鱼食,但为防止饵料的影响,测试指标的前1 天不喂食。试验期间用曝气装置连续曝气,每天更新1 次溶液,每天至少测定1次试验溶液的水温、硬度、pH 值、溶解氧含量。
1.3 数据处理
数据统计结果表示为平均值± 标准偏差(Mean±SD)。本实验的数据应用SPSS15.0 统计软件和ANOVA 法对组间数据进行差异性显著分析,0.01 <P <0.05,表示差异显著;P <0.01,表示差异极显著。
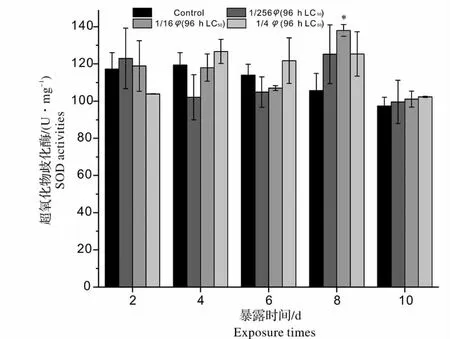
图1 青、土霉素混合废水出水对锦鲤肝脏SOD 活性的影响(与同一天对照组比较:* 0.01 <P <0.05,差异显著;**P <0.01,差异极显著)Fig.1 Effects of mixed wastewater effluent of penicillin and oxytetracycline on SOD activities in liver of Cyprinus carpio(compared with the control group in the same day * 0.01 <P <0.05 significantly different from control group;**P <0.01 more significantly different from control group)
2 结果与讨论
2.1 青、土霉素混合废水出水对锦鲤肝脏SOD 活性的影响
SOD 是最先与细胞中产生的活性氧自由基发生作用的酶[13],可将O2-歧化分解为H2O2和O2-,由此构成了机体防御活性氧自由基损伤的第一道防线[14]。从图1 可以看出,暴露初期(2 d),含外源污染物(青霉素、土霉素)的1/256、1/16 φ(96 h LC50)浓度组混合废水出水对锦鲤肝脏产生了轻微刺激,使SOD 活性有轻微的升高;而1/4 φ(96 h LC50)浓度组SOD 活性却出现了抑制的情况,这说明了在外源污染物的刺激下低浓度组鱼体内SOD 活性均表现出代谢性增强,以清除机体自由基,高浓度组机体中自由基已经对细胞造成损伤,而引起SOD 活性下降。随着时间的延长(2 ~6 d),各浓度组SOD 活性表现不同程度的诱导或抑制现象,且与对照组比较相差不大(P >0.05),此时鱼体内活性氧的产生和抗氧化系统的酶促反应和活性氧清除之间可能存在一个动态平衡的关系。实验进行到8 d 时,各浓度组SOD 活性均高于对照组,1/16 φ(96 h LC50)浓度组SOD 活性达到了整个实验的最大值[138 U/(mg·prot)],与对照组比较差异显著(0.01 <P <0.05)。这可能是实验后期进入鱼体内的抗生素浓度达到一定程度,使鱼体内活性氧累积超过正常水平,SOD 由于底物浓度升高而加速SOD 合成。实验末期(10 d)各浓度组SOD 活性均降低至对照组水平。整个实验过程中,青、土霉素混合废水出水对锦鲤肝脏SOD 活性变化影响不大。
2.2 青、土霉素混合废水出水对锦鲤肝脏CAT 活性的影响
CAT 是存在生物体内的非常重要的抗氧化防御性功能酶,可与谷胱甘肽过氧化物酶(GSH - Px)等一起,清除H2O2,减轻自由基对生物体的氧化损伤,因而其在生物体的抗氧化防御系统中占有非常重要地位[15]。在H2O2浓度低的情况下,组织中的过氧化物主要由GSH-Px 来催化,在H2O2浓度高的情况下,则由CAT 来催化。有研究表明淡水鱼类肝脏CAT 酶的变化对外源化合物很敏感[16]。图2 显示,青、土霉素混合废水出水对锦鲤肝脏CAT 活性影响较为显著,各浓度组CAT 活性均受到不同程度的影响。暴露初期(2 d),各浓度组CAT 活性开始激活,1/16、1/256 φ(96 h LC50)浓度组CAT 活性显著高于对照组(P <0.05),这可能是由于SOD的诱导使得H2O2在鱼体内不断积累,引起CAT 活性激活。4 d 时1/16、1/256 φ(96 h LC50)浓度组CAT 活性突然下降,且1/256 φ(96 h LC50)浓度组CAT 活性受到显著抑制(0.01 <P <0.05),这可能是因为低浓度组中鱼体内H2O2的浓度过低,组织中的过氧化物主要由GSH-Px 来催化,此时机体内GSH-Px 活性很高,CAT 活性很低;1/4 φ(96 h LC50)浓度组中鱼体内H2O2累积达到一定程度,而引起CAT活性受到大量诱导(P <0.01)。暴露中期(6 d),1/16、1/4 φ(96 h LC50)浓度组CAT 活性降至对照组水平,这很可能是高浓度组鱼体内的抗生素(土霉素)浓度达到一定程度而发生了作用。因为有研究发现,四环素类药物具有清除抗氧自由基的作用,可以使氧自由基减少[17],从而使机体抗氧化防御系统恢复平衡状态。8 d 时,1/4 φ(96 h LC50)浓度组CAT 活性突然激活,激活率达到了62.5%,此时鱼体肝脏细胞内H2O2累积量达到最大,但仍未对肝脏造成损伤。10 d 时,1/4 φ(96 h LC50)浓度组CAT 活性突然受到显著抑制(0.01 <P <0.05),这是由于实验后期CAT 代谢H2O2能力达到饱和,H2O2在鱼体细胞内的积累量已促使CAT 产生中毒反应,故CAT 活性大幅度降低,这也有可能是暴露后期鱼体内抗生素浓度过高,导致了抗氧化酶在内的细胞内酶受损,使得其清除活性氧的功能丧失。1/16 φ(96 h LC50)浓度组CAT 活性受到显著诱导(0.01 <P <0.05),鱼体内肝脏组织已受到明显的氧化损伤;1/256 φ(96 h LC50)浓度组上升至对照组水平,此时机体内活性氧的代谢已趋于平衡。整个暴露期间,1/4 φ(96 h LC50)浓度组CAT 活性表现出双峰型的变化趋势,峰值出现在4 d 和8 d。1/16、1/256 φ(96 h LC50)浓度组CAT 活性呈相似的“上升-下降-上升”的周期性波动规律,有研究表明机体抗氧化酶活性的变化(升高或降低)表示机体内活性氧的大量增加,并已扰乱机体抗氧化防御系统的正常功能[18],本实验中各浓度组CAT 酶活性的反复变化证实了暴露期间鱼肝细胞已经受到了氧化损伤。从实验结果显示,在青、土霉素混合废水出水暴露下,鱼体CAT 活性产生较大变化,说明青、土霉素混合废水出水暴露可引起鱼体产生较强的氧化压力。
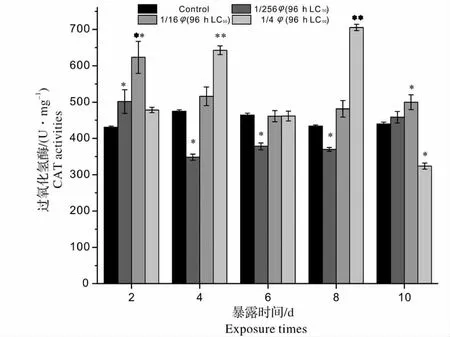
图2 青、土霉素混合废水出水对锦鲤肝脏CAT 活性的影响(与同一天对照组比较:* 0.01 <P <0.05,差异显著;**P <0.01,差异极显著)Fig.2 Effects of mixed wastewater effluent of penicillin and oxytetracycline on CAT activities in liver of Cyprinus carpio(compared with the control group in the same day * 0.01 <P <0.05 significantly different from control group;**P <0.01 more significantly different from control group)
2.3 青、土霉素混合废水出水对锦鲤肝脏MDA 含量的影响
MDA 作为氧化损伤最终形成的脂质过氧化产物,其含量可间接提示机体自由基水平,是毒性作用和保护作用的综合反映[19]。图3 显示,暴露初期,只有1/4 φ(96 h LC50)浓度组MDA 含量显著高于对照组(0.01 <P <0.05),由于此时机体抗氧化酶调节能力有限,鱼体在短期内积累了过量的氧自由基而引起膜的过氧化,使MDA 含量上升。4 d时,各浓度组MDA 含量均有所上升,1/4 φ(96 h LC50)浓度组与对照组相比差异极显著(P <0. 01),这是因为机体CAT 活性的大量诱导并不能完全清除体内过量的H2O2,也有可能是由于H2O2还存在其它来源(如从氨基酸或细胞色素P450 氧化酶激活产生[20]),从而导致H2O2的过量累积对机体产生明显损伤,使MDA 含量明显升高,这也说明了机体的氧化损伤仍在进一步加深;1/256 φ(96 h LC50)浓度组MDA 含量显著上升(0.01 <P <0.05),说明机体内的抗氧化酶系已经遭到破坏,机体开始受到活性氧的攻击。6 d 时,1/4、1/16 φ(96 h LC50)浓度组MDA 含量突然低于对照组水平(P >0.05),很可能是由于此时高浓度组中鱼内的土霉素发生了清除氧自由基作用,鱼体内活性氧的产生和清除处于平衡状态,MDA 含量趋于平缓;此时1/256 φ(96 h LC50)浓度组鱼体内的H2O2浓度较4 d 时已经大幅度升高,且已经达到一个阈值,造成机体严重的氧化损伤,MDA 含量达到了最大值(41.8 nmol/mgprot)。随着时间的延长,1/256 φ(96 h LC50)浓度组MDA 含量不断下降,10 d 时机体氧化损伤得到明显减轻,其原因可能是实验后期鱼体内的土霉素浓度不断升高,不断发生清除自由基作用。1/4 φ(96 h LC50)浓度组在10 d 时MDA 含量达到了整个实验的最高峰(P <0.01),1/16 φ(96 h LC50)浓度组MDA 含量也开始显著高于对照组(0.01 <P <0.05);这有可能是由于在实验后期进入鱼体内的抗生素浓度过高,已经超出了土霉素清除自由基的浓度范围,开始对鱼体细胞产生毒性作用,使得MDA 含量有所增加。也有研究表明,土霉素不同于其他持久性有机污染物,长期在高浓度暴露下最终会对各种抗氧化酶产生毒害,从而导致各种酶活性降低和氧化损伤出现[21]。由此可以推测,还可能是由于鱼体内高浓度的土霉素直接对机体的抗氧化酶产生毒害,导致氧化损伤再次出现。在整个实验过程中,1/256 φ(96 h LC50)浓度组MDA 含量呈现出单峰型变化趋势,峰值出现在6 d。1/16、1/4 φ(96 h LC50)浓度组MDA 含量随暴露时间的延长均呈现“上升-平缓-上升”的趋势,吴尔苗等[22]在研究菲和芘对蚯蚓MDA 含量的毒性实验中也发现了相似的规律。实验结果显示,青、土霉素混合废水出水对锦鲤肝脏MDA 影响显著,暴露初期(2 d)和暴露末期(10 d)各浓度组MDA 含量表现出一定的剂量效应关系,暴露浓度越大,机体受到的氧化损伤越明显。

图3 青、土霉素混合废水出水对锦鲤肝脏MDA 含量的影响(与同一天对照组比较:* 0.01 <P <0.05,差异显著;**P <0.01,差异极显著)Fig.3 Effects of mixed wastewater effluent of penicillin and oxytetracycline on MDA content in liver of Cyprinus carpio(compared with the control group in the same day * 0.01 <P <0.05 significantly different from control group;**P <0.01 more significantly different from control group)
3 结论
整个暴露期间,青、土霉素混合废水出水对锦鲤肝脏SOD 活性变化影响不大,对CAT 活性和MDA含量影响较为显著。1/16、1/256 φ(96 h LC50)浓度组CAT 活性呈相似的“上升-下降-上升”的周期性波动规律,1/4 φ(96 h LC50)浓度组CAT 活性表现出双峰型变化趋势,峰值出现在4 d 和8 d。1/256 φ(96 h LC50)浓度组MDA 含量呈现出单峰型变化趋势,峰值出现在6 d;1/16、1/4 φ(96 h LC50)浓度组MDA 含量随暴露时间的延长呈现“上升-平缓-上升”的趋势。
在青、土霉素混合废水出水暴露下,鱼体CAT 活性产生较大变化,引起了鱼体产生较强的氧化压力;SOD 活性只在个别浓度和个别时间段下才出现显著诱导。SOD、CAT 活性的变化也反映了青、土霉素混合废水出水对鱼类抗氧化酶活性的影响模式比较复杂,因此还需要进一步的深入研究。
暴露实验中,各浓度组鱼体肝脏组织均出现不同程度的氧化损伤,当鱼体内的抗生素浓度达到一定程度时,机体氧化损伤得到明显减轻,这很可能说明了混合废水出水中的抗生素(土霉素)在较高浓度条件下能够减缓机体脂质过氧化程度,而当机体土霉素浓度超出了其清除自由基的范围时,机体再次出现明显的氧化损伤。锦鲤肝脏中CAT 和MDA 对青、土霉素混合废水出水暴露都较为敏感,反映了废水中抗生素对鱼体肝细胞的损伤,较好的反映了环境中氧化胁迫的存在,因此可以考虑作为水环境中青、土霉素污染监测的水生生物指标。
[1]Klaus Kümmerer.Antibiotics in the aquatic environment-a review-part I[J].Chemosphere,2009,75(4):417 -434.
[2]Equchi K,Naqase H,Ozawa M,et al.Evaluation of antimicrobial agents for veterinary use in the ecotoxicity test using microalgae[J].Chemosphere,2004,57(11):1733 -1738.
[3]Kim S C,Carlaon K.Temporal and spatial trends in the occurrence of human and veterinary antibiotics in aqueous and river sediment matrices[J].Environ Sci Technol,2007,41(1):50 -57.
[4]Kostich M S,Lazorchak J M.Risks to aquatic organisms posed by human pharmaceutical use[J].Science of the Total Environment,2008,389(3):329 -339.
[5]封例忠.青霉素废水的生化处理研究[D].沈阳:东北大学,2009.
[6]林秀军.抗生素制药废水生物处理性研究[D].北京:中国矿业大学,1998.
[7]Bing Li,Tong Zhang.Mass flows and removal of antibiotics in two municipal wastewater treatment plants[J].Chemosphere,2011,83(9):1284 -1289.
[8]Golet E M,Alder A C,Giger W. Environmental exposure and risk assessment of fluoroquinolone antibacterial agents in wastewater and river water of the Glatt Valley watershed,Switzerland[J]. Environmental Science & Technology,2002,36(17):3645 -3651.
[9]Metcalfe C D,Miao X S,Hua W,et al.Pharmaceuticals in the Canadian environment[M].New York:Springer,2004:67-90.
[10]Leung H W,Minh T B,Murphy M B,et al.Distribution,fate and risk assessment of antibiotics in sewage treatment plants in Hong Kong,South China[J].Environment International,2012(42):1 -9.
[11]方允中,杨胜,伍国耀.自由基稳恒性动态[J].生理科学进展,2004,35(4):337 -343.
[12]Pomati F,Netting A G,Calamari D,et al.Effects of erythromycin,tetracycline and ibuprofen on the growth of Synechocystis sp and Lemna mino[J].Aquatic Toxicology,2004,67(4):387 -396.
[13]王燕.用多项生物标志物评价三丁基锡对大鼠的早期影响[D].杭州:浙江大学,2005.
[14]张全武,孙少华,杨迪.慢性甲醛吸入对小鼠肝脏的氧化性损伤[J].现代预防医学,2003,30(6):767 -768.
[15]何望,杨品红,曾艳君.亚硝酸盐对河蟹蚤状幼体及蟹苗毒性试验[J].内陆水产,1999(7):5 -6.
[16]üner N,özcan,Oruc E,et al.Effeets of cypermethrin on antioxidant enzyme activities an lipid peroxidation in liver an kidney of the freshwater fish,Oreochromis niloticus and Cyprinus carpio(L)[J].Bull Environ Contam Toxicol,2001,67(5):657-664.
[17]杨森,冯艺戎,张学军,等.四环素类药物抗氧自由基作用的研究[J].中国药理学通报,1999,15(5):472 -473.
[18]陈家长,孟顺龙,胡庚东,等.低浓度阿特拉津对鲫鱼过氧化氢酶活性的影响[J].农业环境科学学报,2008,27(3):1151 -1156.
[19]赖延和,何斌源,范航清,等.重金属Cd 胁迫对红数蚬的抗氧化酶、消化酶活性和MDA 含量的影响[J].生态学报,2011,31(11):3044 -3053.
[20]陈荣.石油烃污染对僧帽牡蛎的氧化胁迫[D].厦门:厦门大学环境科学中心,2001.
[21]孟文娜,刘舒婷,王晓蓉,等.土霉素对日本锦鲫肝脏抗氧化防御系统的影响[J].农业环境科学学报,2010,29(5):833 -838.
[22]吴尔苗,王军良,赵士良,等.菲和芘单一及复合污染对蚯蚓抗氧化酶活性和丙二醛含量的影响[J].环境科学学报,2011,31(5):1077 -1085.
