婴幼儿配方奶粉中牛乳β-乳球蛋白的荧光偏振免疫分析方法研究
2013-11-03龙再浩马中春
龙再浩 孙 运 马中春 李 冰
(宁波检验检疫科学技术研究院 浙江宁波 315012)
1 前言
目前我国6个月内婴幼儿纯母乳喂养率约为30%,单纯配方奶粉或混合喂养是我国婴幼儿主要喂养方式,因此婴幼儿配方奶粉的质量与婴幼儿的生长发育密切相关。牛乳是婴幼儿配方奶粉最主要的原材料,但牛乳中蛋白成分会导致婴幼儿出现过敏反应,表现出皮肤和胃肠道症状,严重会出现过敏性休克。据国外流行病学研究婴幼儿发生牛乳过敏率约为2%-4%,是牛乳过敏的高危人群。牛乳中约有20多种蛋白成分,其中β-乳球蛋白(βLG)是牛乳中一种主要蛋白,它在人乳中并不存在,是牛乳蛋白中最主要的致敏性蛋白之一[1-3]。婴幼儿配方奶粉中牛乳蛋白会经过处理,致敏性明显降低,一般不含有牛乳βLG。
目前用于牛乳βLG检测的方法有多种,包括高效液相法[4]、酶联免疫吸附法(ELISA)[5]、毛细管电泳法[5,6]、聚丙烯酰胺凝胶电泳法[7]等。荧光偏振免疫技术(FPIA)基于抗原-抗体相互作用和荧光检测,已用于食品、水、农产品中生物毒素、杀虫剂、环境污染物检测,人体药物浓度监测和激素检测、布氏杆菌等检测,它与ELISA法相比,具有操作更简便、检测速度更快的特点,适合于高通量样品的快速筛查[8]。本研究采用FPIA技术建立测定βLG的检测方法,并应用于婴幼儿配方奶粉的检测。
2 材料与方法
2.1 材料
2.1.1 试剂
弗氏完全佐剂与不完全佐剂、异硫氰酸荧光素(FITC)蛋白标记试剂盒、βLG标准品:美国Sigma公司;PBS缓冲液:pH7.4;新西兰家兔:浙江省实验动物中心。
2.1.2 仪器
SpectraMax M5酶标仪:美国MD公司;黑色96孔反应板:美国Corning公司。
2.2 方法
2.2.1 多克隆抗体制备
共免疫3只动物,过程如下:采用家兔背部皮肤多点注射,共免疫4次。首次免疫注射蛋白+弗氏完全佐剂,第21天、35天、45天注射蛋白+弗氏不完全佐剂进行免疫,第51天心脏取血,4℃隔夜静置,离心取血清,用饱和硫酸铵法纯化[9,10],-20℃保存备用。
2.2.2 示踪物的合成和活性鉴定
示踪物的合成和纯化过程:用重碳酸盐缓冲液分别配置待标记的蛋白溶液(5mg/mL)和FITC溶液,取0.2mL蛋白溶液加入到反应管中,逐滴加入FITC溶液共计50μL,并缓慢震荡搅拌,室温孵育2h,用Sephadax G-25M柱分离标记蛋白,收集溶液备用。
示踪物活性鉴定:测定示踪物单独荧光偏振值FP,倍比稀释特异性抗体和倍比稀释非特异性抗体(1/25、1/50…1/12800)结合后的荧光偏振值FP。
2.2.3 FPIA测定
2.2.3.1 示踪物工作浓度
将微孔板中示踪物荧光强度约为60U浓度设定为工作浓度。
2.2.3.2 抗体工作浓度
将多抗用PBS溶液进行倍比稀释,稀释浓度分别为1/25、1/50、1/100、1/200…、1/25600。取100μL抗体稀释液和50μL荧光标记物加入96孔板,反应2 min后测量FP值,取70%结合时抗体稀释度为抗体的工作浓度。
2.2.3.3 标准溶液
用PBS缓冲液配制10个不同质量浓度的蛋白标准品标准溶液105ng/mL、104ng/mL、5×103ng/mL、2000ng/mL、1000ng/mL、500ng/mL、200ng/mL、100ng/mL、50ng/mL和10ng/mL。
2.2.3.4 FPIA程序
将100μL抗体、50μL示踪物与50μL不同质量浓度标准溶液同时加入96孔微孔板,反应5min后测量FP值。
2.2.3.5 标准曲线拟合
应用originPro7.0软件中四参数方程模块拟合竞争标准曲线。计算半数抑制浓度(IC50)、检测限(IC10)和检测范围(IC20-IC80)。
2.2.4 样品检测
2.2.4.1 样品制备
样品制备过程参考文献[5],简述如下:取1g样品加入10 mL蒸馏水,混匀15 min;用Whatman 40滤纸过滤,然后加入1mol/L稀盐酸调节PH值为4.6,室温静置20min;4℃条件下4500g离心20min,收集上清液,PVDF膜(孔径0.45μm)过滤,Tuffryn膜(孔径0.22μm)过滤,最后收集滤液待检。
2.2.4.2 定量测定
对建立方法的动力学、特异性以及回收率进行研究,并应用对市售两类婴幼儿产品(米粉和配方奶粉)共9个样品进行检测,测定样品中βLG水平。
3 结果与讨论
3.1 示踪物的合成与活性鉴定
FITC异构体I因为具有较高荧光量子效率以及结合物非常稳定,是目前最广泛使用的荧光标记试剂,FITC与蛋白的自由氨基反应形成稳定的结合物(见图1)。

图1 示踪物的合成
示踪物与特异性抗体反应活性是FPIA方法建立的基础。用示踪物与抗体、倍比稀释抗体和倍比稀释对照抗体反应测定荧光偏振值来鉴定合成示踪物的活性,结果见图2。测定100μL 荧光标记物的荧光偏振值约为118mp,当加入100μL抗体反应2min后测定荧光偏振值约300mp,表明荧光偏振强度发生显著变化。

图2 荧光标记物的活性鉴定
从图2可见,当用倍比稀释抗体与示踪物反应后,荧光偏振值随抗体稀释度的增加而不断降低,当稀释度到达1/12800,荧光偏振值保持在120mp单位左右;相反,加入阴性对照抗体,荧光偏振值不会随着抗体稀释度增加,因此未发生明显变化,偏振光值保持在120mp波动。试验结果表明,合成的示踪物具有良好的活性,能够与特异性抗体结合。
3.2 示踪物和抗体工作浓度
FPIA方法的灵敏度与示踪物及抗体的工作浓度相关。一般示踪物的浓度越低,则建立的方法灵敏度越高。但如果示踪物浓度过低,则会影响荧光信号的测量[11]。在研究过程中稀释示踪物,荧光强度约60U时示踪物浓度设定为工作浓度取得了较好的灵敏度。
抗体活性/工作浓度是FPIA方法建立的关键。在制备多克隆抗体时,共免疫了3只家兔,获得了3个不同动物个体来源的抗体,3组抗体与示踪物结合后的稀释度曲线见图3。

图3 荧光标记物与βLG蛋白多克隆抗体稀释曲线
从图3可见,3只动物获得的抗体稀释度曲线相差不大,并且2号与3号抗体的曲线较为相似。在3条稀释度曲线中,1号抗体在抗体稀释度最小时(1/25)获得FP值最高,2号和3号抗体的最大FP值相近,当抗体浓度稀释至1/12800时,3个抗体与示踪物结合后FP值相差不大。根据样品稀释度曲线图,选择2号抗体作为本方法中使用的抗体,其工作浓度设定为与示踪物70%结合的抗体稀释度即1/200稀释度作为抗体的工作浓度。
3.3 标准曲线
将100μL示踪物、50μL抗体与10个浓度的50μL标准溶液加入反应孔中,反应后测定的荧光偏振值用软件按照四参数方程拟合标准曲线(见图4)。

图4 βLG的竞争性荧光偏振免疫检测标准曲线
图4显示,曲线呈S形,R2为0.997,表明曲线拟合良好,符合竞争性反应曲线特征。方法检出限(IC10)为0.75 mg/L;半数抑制剂量(IC50)为0.75mg/L;检测线性范围(IC20-IC80)为0.22mg/L-2.53mg/L。
3.4 动力学研究
为选择合适的荧光偏振测定时间,需要研究抗体、示踪物与标准品/样品三者之间竞争性反应体系的动力学特征。将4个浓度(10 ng/mL、100 ng/mL、1000 ng/mL和5000 ng/mL)标准溶液与示踪物及抗体混合,反应2min后开始测定FP值,每min测量一次,连续测10次,测量结果见图5。

图5 βLG的竞争性荧光偏振免疫检测动力学曲线
从图5可见,4条动力学曲线波动较小,基本上保持稳定,这表明样品/标准品、示踪物和抗体三者之间竞争性反应能够快速达到平衡,加入样品后基本上不需等待就可以开始测量。
3.5 方法特异性
方法的特异性主要体现为抗体的交叉反应率,交叉反应率越高,方法特异性越低。应用已建立FPIA程序测定4种主要牛乳蛋白(a-乳白蛋白、酪蛋白、α-酪蛋白和β-酪蛋白)的IC50,计算交叉反应率(CR%),结果见表1。
4种牛乳蛋白的交叉反应率都低于0.1%,表明在检测范围内,本方法特异性较高。

表1 抗体与主要致敏性牛乳蛋白的交叉反应
3.6 添加回收率
用婴儿米粉作空白,添加3种不同质量浓度βLG,按照前样品处理方法和FPIA程序检测,每个浓度设3个平行,每次测定3次,计算平均回收率,结果见表2。
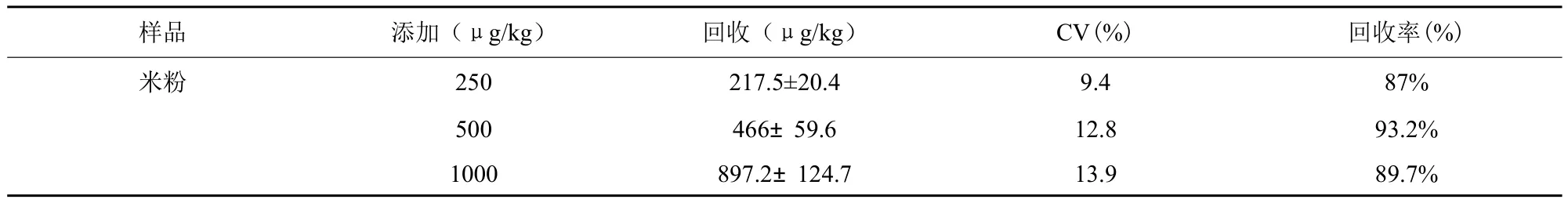
表2 方法回收率
从表2中可见测量结果CV范围为9.4%-13.9%,回收率范围为87%-93.2%。
3.7 样品检测
应用本方法对9种婴幼儿食品中牛乳βLG水平进行检测。结果表明,在3种婴幼儿米粉中均未检测出βLG,在6种婴幼儿配方奶粉有3个产品检测出βLG,含量在23.5mg/g-32.6mg/g。
4 结论
本文制备了牛乳βLG的多克隆抗体,使用FITC合成有活性的示踪物,建立基于FPIA技术的牛乳βLG的检测方法。本方法操作简便、快速,适用于婴幼儿配方奶粉等致敏原牛乳βLG快速检测。
[1]Schulmeister U,Swoboda I,Quirce S,et al.Sensitizaiton to human milk[J].Clinical and Eeperimental allergy,2008,1(38):60-68.
[2]Patrizia R,Cinzia B,Chiara DL,et al.Molecular aspects of milk allergens and their role in clinical events[J].Anal Bioanal Chem,2009,395:47-56.
[3]兰欣怡,王加启,登攀,等.牛奶β-乳球蛋白研究进展[J]. 中国畜牧兽医,2009,36(6):109-112.
[4]赵海霞,李惠.高效液相色谱法测定乳清蛋白主要成分的研究[J].食品科技,2007,32:203-206.
[5]Cristina PL, Jose Carlos DM, Isabel V, et al. A new sample preparation method compatible with capillary electrophoresis and laser-induced fluorescence for improving detection fo low levels of β-lactoglobulin in infant foods[J].Analytica Chimica Acta,2009,649:202-210.
[6]孙国庆,康小红,刘卫星.利用毛细管电泳法测定乳品中β-乳球蛋白含量的研究[J].中国食品卫生杂志,2010,22(5):414-417.
[7]韩奕奕,黄菲菲,王建军,等.凝胶电泳法(SDS-PAGE)测定乳与乳制品中β-乳球蛋白的含量[J].乳业科学与技术,2009,135(2):75-77.
[8]Smith DS, Eremin SA.Fluorescence polarization immunoassays and related methods for simple, high-throughput screening of small molecules[J].Anal Bioanal Chem,2008,391:1499-1507.
[9]李欣,陈红兵.抗水牛β-乳球蛋白兔IgG的亲和纯化[J].食品科学,2007,28(8):276-279.
[10]张和平,岳喜庆,冯巧萍,等.饱和硫酸铵法提取血清中IgG最佳条件的研究[J].中国乳品工业,2006,34(1):4-8.
[11]王战辉,张素霞,沈建忠,等.荧光偏振免疫分析方法分析磺胺二甲基嘧啶[J].分析化学, 2007,26(4):533-536.
