利拉鲁肽对IGT-OLETF大鼠血清糖基化终末产物及炎症指标的影响
2013-11-02杨力郭南京蔡德鸿程彦臻张振张桦
杨力,郭南京,蔡德鸿,程彦臻,张振,张桦
2007-2008年全国流行病学调查显示,目前我国糖尿病前期人群已达总人口的15.5%[1],如不及时干预,约有50%最终会发展为糖尿病。胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)是肠道L细胞分泌的重要肠肽激素[2],具有葡萄糖依赖性的促胰岛素分泌作用[3-4],在糖尿病领域具有广阔的应用前景,但在糖尿病前期方面的作用尚未明确。近期的体外研究发现,GLP-1可抑制糖基化终末产物(advanced glycation endproducts,AGEs)及炎症因子所致的氧化应激作用,防止细胞凋亡[5]。为进一步了解GLP-1的作用,拓展其应用,本研究采用不同浓度GLP-1受体激动剂——利拉鲁肽(liraglutide)对自发性糖耐量异常动物模型雄性OLETF (Otsuka-Long-Evans-Tokushima Fatty)大鼠及同种系LETO(Long-Evans-Tokushima-Otsuka)大鼠进行干预,检测血清中血糖、胰岛素、主要的AGEs及炎症因子水平,观察利拉鲁肽干预对糖尿病前期OLETF大鼠糖代谢的影响,并探讨其相关作用机制。
1 材料与方法
1.1 实验动物 雄性4周龄OLETF大鼠32只,同周龄雄性LETO大鼠8只为其同种系正常对照,均由日本大冢制药株式会社德岛研究所赠送。每笼4~6只饲养于SPF级环境,环境温度控制在21±2℃,湿度为55%±10%,光照与黑暗12h交替。标准饲料喂养,自由进食、饮水。12周龄时进行糖耐量试验(隔夜禁食12h,葡萄糖2g/kg胃管注入),检测0、30、60、90、120min时血糖,参照日本大冢制药株式会社德岛研究所关于OLETF大鼠的实验研究[6],血糖峰值>16.7mmol/L且2h血糖>11.1mmol/L诊断为糖尿病,符合任何一项诊断为糖耐量异常(impaired glucose tolerance,IGT)。将符合IGT诊断的OLETF大鼠(IGT-OLETF)随机分成4组,每组8只,单笼饲养。
1.2 主要试剂与仪器 主要试剂及配制:利拉鲁肽(丹麦诺和诺德制药公司),采用1ml注射器分次抽取利拉鲁肽注射笔(3ml/支,6mg/ml)笔芯注射液,加入4℃ 0.9% NaCl,分别配成200、100、50μg/ml 3种浓度的利拉鲁肽溶液,0.22μm滤膜过滤除菌,分装,放置于4℃保存备用。AGEs、胰岛素、血清超敏C反应蛋白(Hs-CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)ELISA检测试剂盒均购自武汉伊艾博科技有限公司。主要仪器:酶标检测仪器(美国Bio-Rad公司),稳豪®倍优型血糖仪[强生(中国)医疗器材有限公司],-80℃超低温冰箱(美国Thermo Fisher Scientific公司)。
1.3 实验分组 将8只LETO大鼠作为LETO-saline(正常对照)组,给予生理盐水0.5ml/kg,2次/d。另外将造模成功的IGT-OLETF大鼠随机分为4组(每组8只):①OLETF-saline组(给予生理盐水0.5ml/kg,2次/d[7]);②OLETF/LR-50μg/kg组(给予利拉鲁肽50μg/kg,2次/d);③OLETF/LR-100μg/kg组(给予利拉鲁肽100μg/kg,2次/d);④OLETF/LR-200μg/kg组(给予利拉鲁肽200μg/kg,2次/d)。由于实验灌胃失误,导致OLETF/LR-100μg/kg组和OLETF/LR-200μg/kg组各死亡1只。以上药物均为每日早7:30和晚7:30各注射1次,腹腔注射,持续12周后处死实验动物。
1.4 一般项目观察 实验期间每周记录各组实验动物体重和进食量。分别于干预后每周行OGヰ 测定。取鼠尾静脉血进行空腹和服糖后2h血糖测定。于0和12周尾静脉采血,分离血清,-80℃保存备用。
1.5 血清指标检测 检测大鼠均于末次干预给药后次日上午,腹腔注射戊巴比妥钠(50mg/kg)麻醉(此前禁食15h),右心室彻底放血处死大鼠,收集血液离心后-80℃保存。采用ELISA法检测血清AGEs、空腹胰岛素(FIns)、Hs-CRP、TNF-α和IL-6水平。根据公式计算胰岛素抵抗指数(HOMAIR=FBG×FIns/22.5)。
1.6 统计学处理 采用SPSS 18.0软件进行统计分析。所有数据均以表示,重复测量数据多组间比较采用重复测量方差分析,多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较方差齐性采用Bonferroni法,方差不齐采用Dunnet's T3法检验,干预前后数据比较采用配对样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般项目 干预前各组IGT-OLETF大鼠进食量及体重较LETO大鼠增多(P<0.0001)。利拉鲁肽干预1周后,不同剂量干预组IGT-OLETF大鼠体重及进食量均较干预前有所减少,体重较OLETF-saline组大鼠也有所降低(P<0.05)。干预后第2周开始,各组大鼠进食量及体重均逐渐增加,不同剂量利拉鲁肽干预组的体重均较LETO-saline组明显增加(P<0.01),与OLETF-saline大鼠比较差异有统计学意义(P<0.05,图1)。
2.2 血清糖代谢指标的比较 干预前OLETF大鼠空腹血糖(FPG)、糖耐量后2h血糖(2hPG)、空腹胰岛素均高于LETO大鼠,提示胰岛素抵抗导致血糖升高。50、100、200μg/kg利拉鲁肽干预2周后,OLETF大鼠的FPG、2hPG、空腹胰岛素均低于生理盐水干预组(P<0.05),之后血糖一直维持在与LETO大鼠相似的水平,不同剂量组间FPG、2hPG及空腹胰岛素差异均无统计学意义。干预实验结束后,生理盐水干预组8只OLETF大鼠中有7只(87.5%)发展成了糖尿病,利拉鲁肽干预组22只大鼠均未发生糖尿病(图2、表1)。
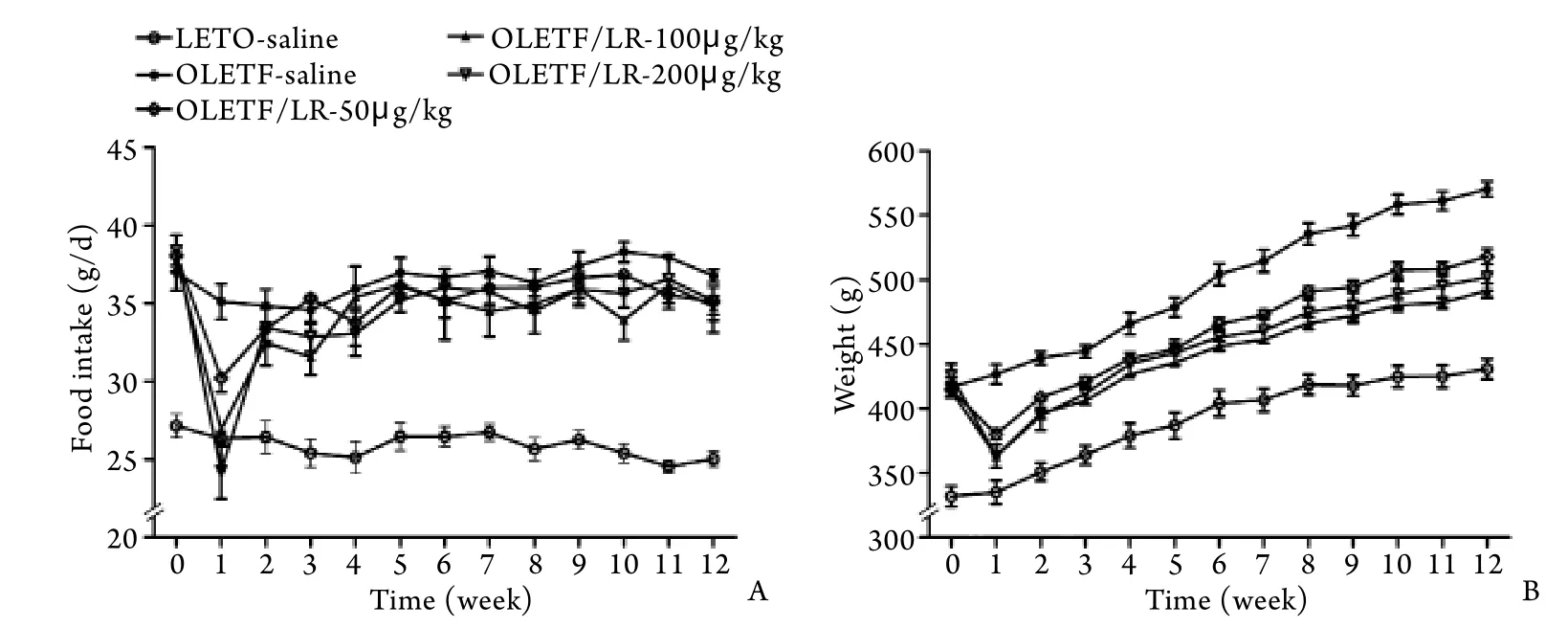
图1 干预处理后大鼠进食量(A)和体重(B)的变化Fig. 1 Changes of food intake (A) and weight (B) after intervention LR. Liraglutide
2.3 各组大鼠AGEs、炎症指标的变化 干预前OLETF大鼠AGEs与TNF-α、IL-6水平均高于LETO大鼠(P<0.05)。给予不同剂量利拉鲁肽干预12周后,OLETF大鼠AGEs、TNF-α、IL-6水平均降低(P<0.01),其中OLETF/LR-200μg/kg 组AGEs较50μg/kg组下降更明显(P<0.05,表2),表明利拉鲁肽降低AGEs呈剂量依赖性。
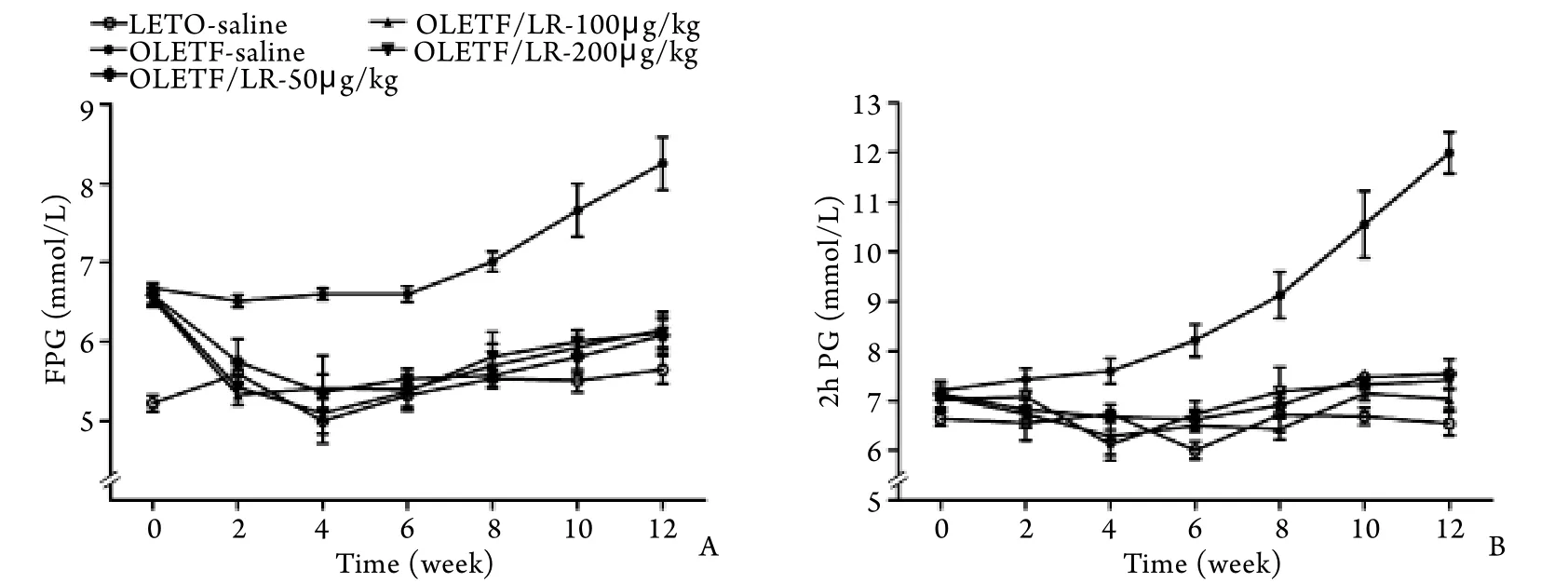
图2 利拉鲁肽干预对空腹血糖(A)、糖耐量2h血糖(B)的影响Fig. 2 Change of fasting blood glucose and 2h post-prandial blood glucose after intervention with liraglutide LR. Liraglutide

表1 血清胰岛素比较(x±s)Tab. 1 Fasting insulin before and after intervention (x±s)
3 讨 论
OLETF大鼠是日本大冢制药公司经20代的传代筛选开发的一种自发性2型糖尿病大鼠,该鼠由于胆囊收缩素(CCK)-A受体基因表达缺失而导致食欲亢进和肥胖。此鼠贪食,不好运动,体形肥胖,逐渐出现糖尿病,与人类2型糖尿病的病理生理进程极为相似,是目前国际上公认的最佳自发性2型糖尿病模型之一[8],而23周龄前的OLETF大鼠则是研究糖尿病前期病理生理机制及干预治疗措施的理想动物模型[9]。
表2 利拉鲁肽干预后血清AGEs及炎症因子的比较(Tab. 2 Serum AGEs and markers of inflammation after intervention with liraglutide (

表2 利拉鲁肽干预后血清AGEs及炎症因子的比较(Tab. 2 Serum AGEs and markers of inflammation after intervention with liraglutide (
(1)P<0.05 compared with LETO-saline group; (2)P<0.05 compared with OLETF-saline group; (3)P<0.05 compared with OLETF/LR-50μg/kg group
Group n AGEs (ng/ml) TNF-α (ng/ml) Hs-CRP (ng/ml) IL-6 (pg/ml)LETO-saline 8 1.275±0.191 34.55±3.62 4.22±0.35 4.73±0.38 OLETF-saline 8 1.755±0.094(1) 53.22±2.09(1) 5.72±0.18 8.72±0.19(1)OLETF/LR-50μg/kg 8 1.564±0.140(1)(2) 35.47±3.29(2) 4.14±0.17 5.63±0.32(2)OLETF/LR-100μg/kg 7 1.392±0.128(2) 33.57±6.29(2) 3.90±0.48(2) 4.79±0.90(2)OLETF/LR-200μg/kg 7 1.351±0.153(2)(3) 34.72±5.06(2) 3.68±0.12(2) 5.11±0.26(2)
GLP-1是肠道细胞分泌的一种促进细胞增殖、抑制细胞凋亡的重要激素,其受体激动剂——利拉鲁肽具有减轻体重,直接刺激胰岛β细胞增殖、诱导细胞再生、阻止胰岛细胞凋亡的作用,故而广泛用于2型糖尿病的治疗。但GLP-1对2型糖尿病前期的作用尚不明确,因此在本研究中我们采用IGT-OLETF大鼠模型作为研究对象,使用不同剂量利拉鲁肽进行干预,结果显示利拉鲁肽不仅可以改善OLETF大鼠的胰岛素抵抗状态及糖耐量异常,同时能够明显降低血清中AGEs和炎症标志物(如Hs-CRP、TNF-α、IL-6)的水平。
近年来多项研究揭示,糖耐量异常阶段人群血清AGEs及多种炎症因子均较健康人明显升高[10],说明非酶糖化及炎症反应在糖尿病前期阶段即已存在,它们造成的氧化应激作用可能加重胰岛β细胞损害及胰岛素抵抗,在糖尿病前期向糖尿病转变过程中发挥着重要推动作用,进行有效的早期干预可延缓2型糖尿病及其并发症的发生和发展。
最新的体外研究发现,GLP-1在多种细胞中均可抑制AGEs-RAGE-氧化应激轴,防止细胞凋亡。Ishibashi等[5]报道在肾小球系膜细胞中GLP-1可下调RAGE表达,从而拮抗AGEs的作用,减少ROS的形成。此后Puddu等[11]在胰腺β细胞HIT-T 15中也发现GLP-1可抑制AGEs诱导的RAGE表达,抵抗AGEs诱导的细胞凋亡和坏死。在我们的研究中,利拉鲁肽可降低自发糖耐量异常动物模型血清中AGEs和炎症标志物的水平。因此,我们推测,利拉鲁肽在糖尿病前期阶段可能通过抑制非酶糖化及抗炎作用,改善胰岛素抵抗及胰岛细胞功能,从而达到延缓糖尿病进展的目的。
[1]Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090-1101.
[2]Li JH, Zhang H, Hou WL. Recent progress in the use of incretin for treating diabetes[J]. Acta Acad Med CPAPF, 2011, 20(7): 597-599, 604. [李敬华, 张红, 候雯莉. 肠促胰岛素生理作用及应用研究进展[J]. 武警医学院学报, 2011, 20(7): 597-599, 604.]
[3]Jin YC, Shen CA, Chai JK, et al. Progress of researches on the structure and biological effects of glucagon-like peptide-1[J].Med J Chin PLA, 2011, 36(8): 875-878. [金玉翠, 申传安, 柴家科, 等. 胰高血糖素样肽-1的结构及生物学作用研究进展[J]. 解放军医学杂志, 2011, 36(8): 875-878.]
[4]Zhang YH. Advances on GLP-1 and analogs for type 2 diabetes[J]. Acta Acad Med CPAPF, 2010, 19(11): 921-924. [张月华. GLP-1及其类似物与2型糖尿病的关系[J]. 武警医学院学报, 2010, 19(11): 921-924.]
[5]Ishibashi Y, Nishino Y, Matsui T, et al. Glucagon-like peptide-1 suppresses advanced glycation end product-induced monocyte chemoattractant protein-1 expression in mesangial cells by reducing advanced glycation end product receptor level[J].Metabolism, 2011, 60(9): 1271-1277.
[6]Kawano K, Hirashima T, Mori S, et al. Spontaneous long-term hyperglycemic rat with diabetic complications. Otsuka Long-Evans Tokushima Fatty (OLETF) strain[J]. Diabetes, 1992,41(11): 1422-1428.
[7]Sturis J, Gotfredse CF, Romer J, et al. GLP-1 derivative liraglutide in rats with β-cell deficiencies: influence of metabolic state on β-cell mass dynamics[J]. British J Pharmacology, 2003,140(1):123-32.
[8]Chen D, Wang MW. Development and application of rodent models for type 2 diabetes[J]. Diabetes Obes Metab, 2005, 4(7):307-317.
[9]Mochizuki K, Fukaya N, Tanaka Y, et al. Treatment with the alphaglucosidase inhibitor miglitol from the preonset stage in Otsuka Long-Evans Tokushima Fatty rats improves glycemic control and reduces the expression of inflammatory cytokine genes in peripheral leukocytes[J]. Metabolism, 2011, 11(60): 1560-1565.
[10]Suga T, Iso T, Shimizu T, et al. Activation of receptor for advanced glycation end products induces osteogenic differentiation of vascular smooth muscle cells[J]. J Atheroscler Thromb, 2011, 18(8): 670-683.
[11]Puddu A, Storace D, Durante A, et al. Glucagon-like peptide-1 counteracts the detrimental effects of Advanced Glycation End-Products in the pancreatic beta cell line HIT-T 15[J]. Biochem Biophys Res Commun, 2010, 398 (3): 462-466.
