中老年女性正常范围内血清γ-谷氨酰转移酶水平与代谢综合征的关系
2013-11-05胡振平邓华聪瞿华王行邓敏魏慧丽李晓宇
胡振平,邓华聪,瞿华,王行,邓敏,魏慧丽,李晓宇
代谢综合征(metabolic syndrome,MS)是心血管疾病多种代谢危险因素在同一个体内聚集的一种病理状态[1],主要成分包括中心性肥胖[2]、高血脂、高血压及高血糖。目前全球有20%~25%的成年人罹患MS,近年来我国MS的发病率也急速攀升,已成为MS患病大国[3]。相对非MS者,MS患者糖尿病及心血管疾病的发生风险成倍增加,因此及早识别MS并给予有效干预将有助于预防糖尿病和心血管疾病的发生。γ-谷氨酰转移酶(γ-GT)是一种反映肝脏功能状态的生化指标,但有研究表明血清γ-GT是MS的独立预测因子[4-5]。国外报道即使处于正常范围内的血清γ-GT水平也与MS的发生密切相关[6],但有关中国人群正常范围内γ-GT水平与MS及其组分的关系尚未见报道。因此,本研究以中国中老年女性人群为研究对象,进一步探讨两者的相关性,以期对于MS的预警因子有更多了解。
1 资料与方法
1.1 研究对象 采取整群抽样的方法选取重庆市南岸区光电路40岁以上女性居民为研究对象。排除已知肝脏疾病(肝炎、肝硬化、肝癌等)患者,排除过去或现在有吸烟及饮酒习惯者,排除有糖尿病家族史及血清γ-GT水平大于40U/L的女性,最终血清γ-GT水平处于正常范围(<40U/L)的1308名女性被纳入为研究对象。将纳入研究人群分别按照γ-GT四分位数(<13、13~16、16~21和≥21U/L)及MS组分(0、1、2、3及≥4个)分为不同组别予以分析。本项研究获重庆医科大学伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法
1.2.1 问卷调查 使用国际化标准的流行病学调查问卷,由经培训的调查员询问并填写问卷内容。问卷条目包括受试者人口学资料、既往病史、用药史、糖尿病家族史、吸烟饮酒史、休闲时体力活动情况、生育史及月经史等。
1.2.2 人体参数测量 由专人对受试者进行常规的体格检查,包括身高、体重、腰围(WC)及血压。身高、WC测量要求精确度为0.1cm,体重测量精确度为0.1kg,计算体重指数(BMI)。静息状态下测量血压3次,分析数据时采用3次读数的均值。
1.2.3 生化指标检测 受试者接受简易的口服葡萄糖耐量试验(OGTT,即在空腹及口服75g葡萄糖后2h测量静脉血糖值)。用全自动生化仪(CX-7 Biochemical Autoanalyser,Beckman,美国)检测肝肾功能及血脂。葡萄糖激酶法检测血糖水平。
1.2.4 诊断标准 MS的诊断符合美国国家胆固醇教育计划成人治疗组第3次报告(NCEP-ATPⅢ)诊断标准(2005年根据亚洲人特点改良),即符合以下3项或3项以上者诊断为MS。①中心性肥胖:女性腰围≥80cm;②高血压:收缩压(SBP)≥130mmHg(1mmHg=0.133kPa)和(或)舒张压(DBP)≥85mmHg或正在服用降压药;③高甘油三酯(TG):TG≥1.70mmol/L;④低高密度脂蛋白胆固醇(HDL-C):女性<1.30mol/L;⑤高血糖:空腹血糖(FPG)≥5.6mmol/L或已确诊糖尿病。
1.3 统计学处理 采用SPSS 18.0软件进行统计分析。计量资料以x±s或M(四分位数间距)表示,非正态分布变量进行自然对数转换后进行分析。计数资料以率表示,组间比较采用方差分析或χ2检验。血清γ-GT水平的影响因素采用多元逐步回归分析,MS及各组分的相对危险度采用logistic多元回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象MS的患病情况 本研究中老年女性人群MS患病率为38.9%,其中绝经期前为20.0%,绝经后为42.4%。绝经后MS患病率明显高于绝经前(χ2=39.21,P<0.01)。
2.2 血清γ-GT水平与各代谢指标及绝经状态的关系 由表1可见,研究对象多个代谢指标随着血清γ-GT水平的增加趋向恶化,即WC增加,血压、FPG、TG、总胆固醇(TC)、丙氨酸氨基转移酶(ALT)均升高(P<0.05)。同时女性绝经人数也随着血清γ-GT水平的增加逐渐增多(P<0.01)。表2显示随着γ-GT水平的升高,MS及其多个组分(除低HDL-C)的患病率均随之升高(P<0.01)。MS患病率从γ-GT第1个四分位至第4个四分位分别为22.5%、27.4%、42.7%、58.5%(P<0.01)。进一步以γ-GT作为因变量,年龄、BMI、WC、SBP、DBP、FPG、2hPG、HbA1C、TC、HDL-C、LDL-C及绝经状态为自变量进行多元逐步回归分析,结果显示,TG、WC、绝经状态、2hPG及BMI为其独立影响因素,标准化回归系数β值分别为0.173、0.117、0.106、0.081、0.076(P<0.05或P<0.01)。
2.3 血清γ-GT水平与MS及各组分患病风险的关系 由表3可见,采用logistic多元回归分析,在校正了多个混杂因素后,MS及各组分(除低HDL-C外)的患病风险随着血清γ-GT水平的升高而增加。以γ-GT第1个四分位组(Q1)作为参照,第4个四分位组(Q4)的MS、中心性肥胖、高TG、高血压及高血糖的患病危险度分别为2.92(1.98~4.30)、2.31(1.63~3.26)、3.76(2.46~5.74)、1.84(1.29~2.62)及1.63(1.15~2.31)。
2.4 血清γ-GT水平与MS组分个数的关系 图1显示,校正了年龄、BMI及绝经状态后,血清γ-GT水平与MS组分聚集度相关,MS组分个数越多,血清γ-GT水平越高。
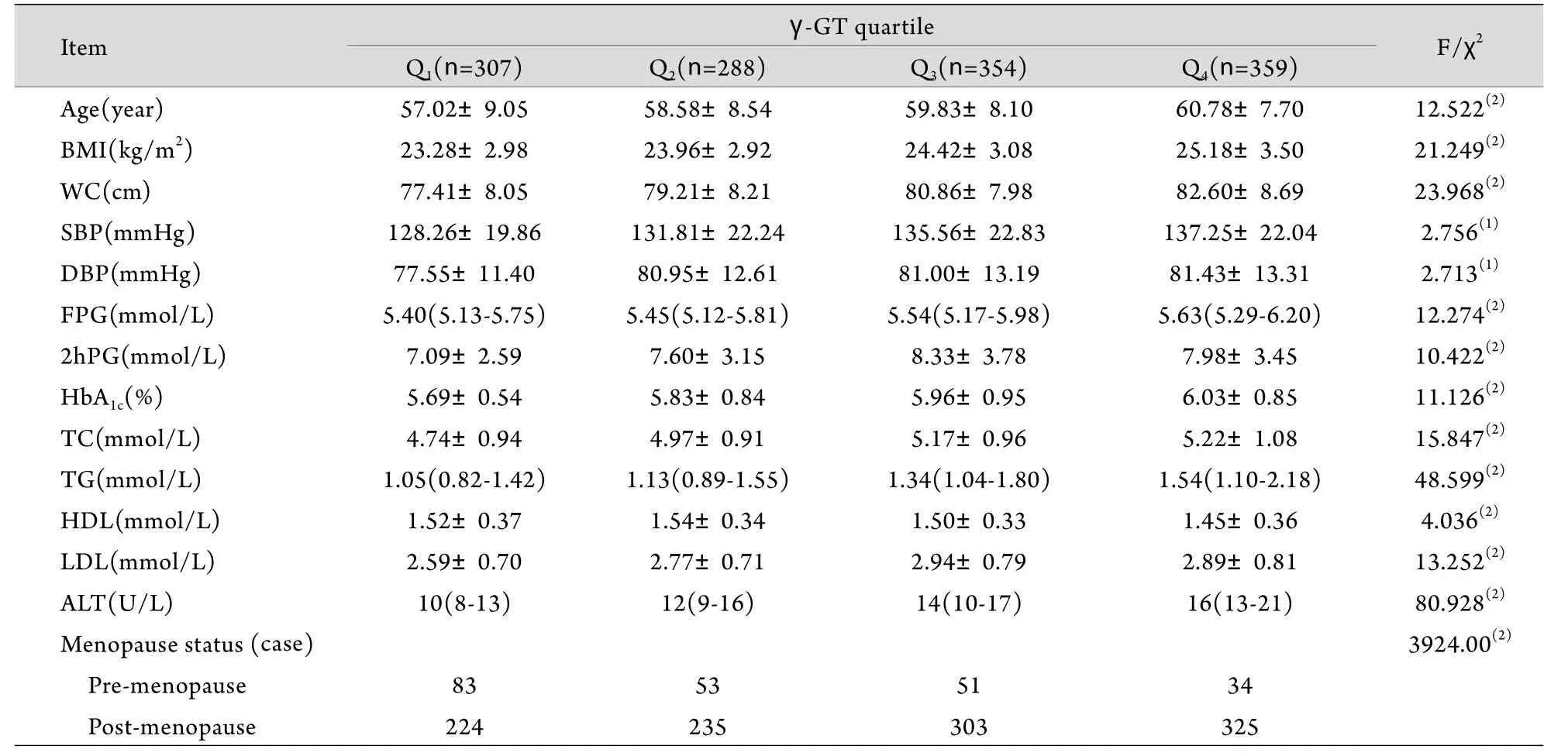
表1 各γ-GT四分位数组患者基本参数的比较[x±s或M(Q1-Q3)]Tab.1 Comparison of basic parameters by γ-GT quartiles [x±s or M(Q1-Q3)]
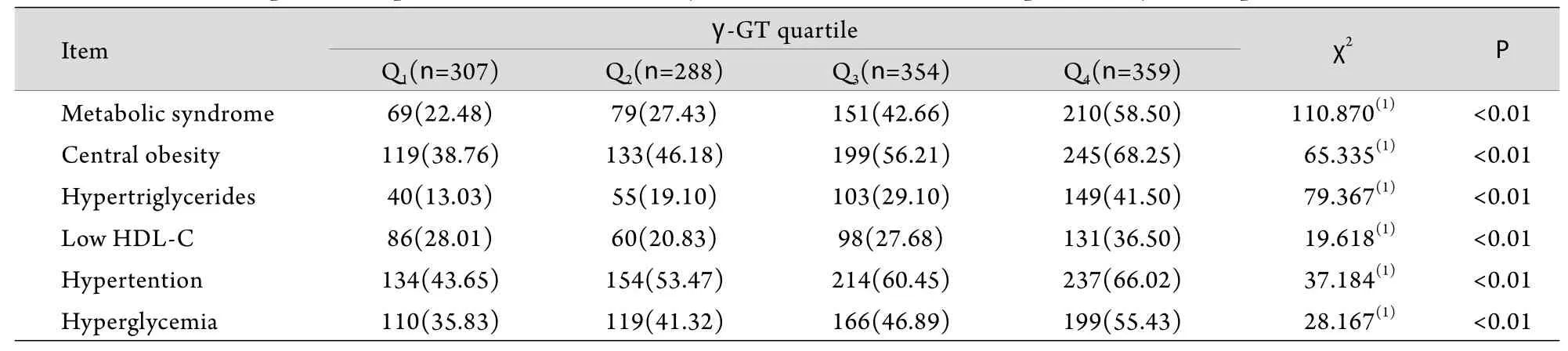
表2 各γ-GT四分位组患者罹患MS及其各组分的患病率[case(%)]Tab.2 Comparison of prevalence of metabolic syndrome and individual components by γ-GT quartiles [case(%)]
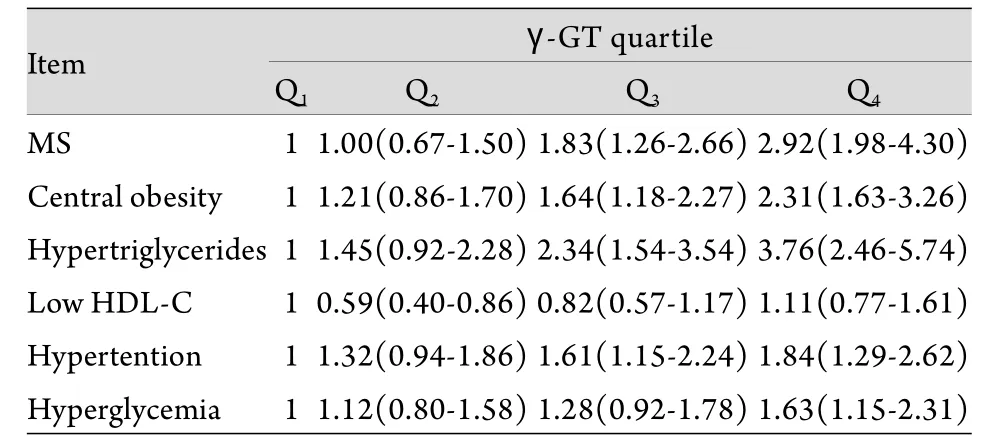
表3 各γ-GT四分位组罹患MS及其各组分的风险[校正的比值比(95%可信区间)]Tab.3 Relative risks for the MS and individual components by γ-GT quartiles [Adjusted OR (95%CI)]
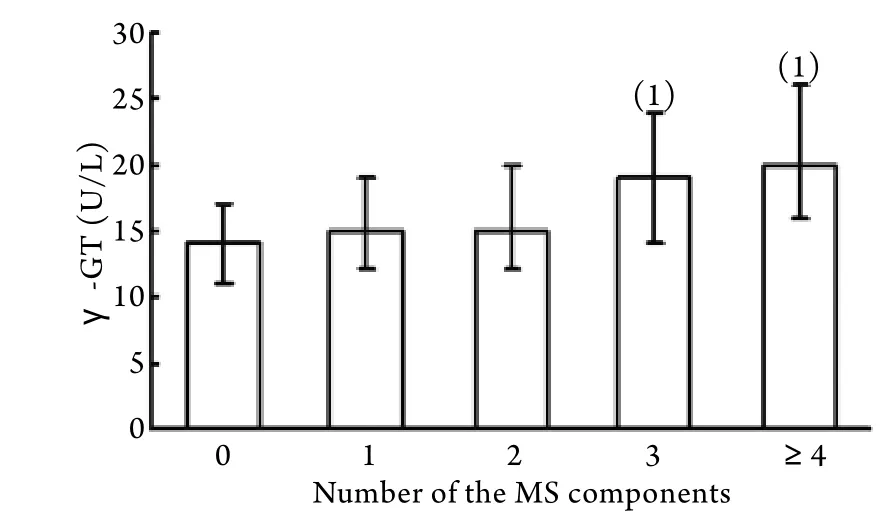
图1 具有MS不同组分个数的受试者血清γ-GT水平比较Fig. 1 Levels of serum γ-GT by different number of MS components
3 讨 论
γ-GT是参与γ-谷氨酰基循环的关键酶,分布于全身多个器官和组织,而血清γ-GT主要来源于肝脏[7]。血清γ-GT水平升高不仅提示肝脏功能受损,还可能提示MS的发生风险增加。本研究在较大样本的中国女性人群中分析血清γ-GT与MS的关系,结果显示即使正常范围内血清γ-GT水平升高也与MS及多个组分的患病风险密切相关。MS及各组分(除低HDL-C外)的优势比值(OR)随着γ-GT水平的升高而升高,呈剂量-效应关系。根据γ-GT水平将研究对象分为4个部分,处于第4个四分位处的人群(75%~100%)罹患MS的风险是γ-GT水平处于第1个四分位人群(0~25%)的2.92倍,相应的罹患中心性肥胖、高血压、高TG及高血糖的风险也明显增加。该结果提示即使γ-GT水平明显低于目前临床使用的参考界值时,MS及其多个组分的患病风险也显著增大。有研究发现当ALT水平明显低于目前临床使用的ALT参考界值时,MS患病风险亦明显增大[8],而Prati等[9]研究认为将ALT正常范围调整至男性0~30U/L、女性0~19U/L更为合适。ALT和γ-GT虽同为反映肝脏功能的敏感指标,但已有报道血清γ-GT对于MS发生风险的预测作用要优于血清ALT[10]。如果把目前既定的血清γ-GT参考范围合理地下调也许更有利于早期筛选出各种潜在的代谢危险因素,但这需要大规模的前瞻性研究加以论证。此外本研究发现,γ-GT水平随着MS组分个数的增加而增加,进一步多元逐步回归分析显示TG、WC、BMI及2hPG是独立影响血清γ-GT水平的因素,这提示γ-GT水平的高低可在一定程度上反映各代谢危险因素聚集程度的大小。
迄今为止MS的病因及发病机制并不清楚,但目前多数学者认为中心性肥胖和胰岛素抵抗是其发病的中心环节,慢性低度炎症及氧化应激等因素也可能参与其中。氧化应激、慢性低度炎症及胰岛素抵抗可能是γ-GT与MS联系的纽带。细胞外γ-GT的反应产物半胱氨酰可还原铁及其他过渡金属离子,生成活性氧自由基,直接参与氧化应激过程[11]。同时γ-GT还是低密度脂蛋白氧化的催化剂[12]。临床研究发现血清γ-GT水平与多种炎性因子及氧化应激指标如C反应蛋白、纤维蛋白原、白细胞计数、尿酸及F2-艾索普斯坦水平呈显著正相关[9,13-14],提示血清γ-GT水平越高,全身慢性低度炎症及氧化应激反应越严重。胰岛素抵抗尤其是肝脏胰岛素抵抗可能也是γ-GT与MS显著关联的内在机制之一。André等[5]进行了一项为期3年的队列研究,发现女性人群血清γ-GT水平对于MS发生风险的预测作用具有胰岛素抵抗依赖性,即在校正了胰岛素抵抗后,血清γ-GT水平与MS的发生风险无明显关联。但是后续的一项研究却得出了相反的结论[10]。慢性低度炎症、氧化应激及胰岛素抵抗本是相互关联的,胰岛素抵抗是否独立介导了γ-GT与MS的关联需要进一步研究。
本研究人群MS总体患病率为38.9%,其中绝经期前为20.0%,绝经后为42.4%。有研究认为绝经后女性MS的发生风险较绝经前显著增加[15]。本研究数据显示绝经后女性MS的患病率是绝经前的2倍以上,与此结论一致。女性绝经后雌激素水平明显降低,而雌激素是一种抗氧化剂,提示绝经后机体可能处于一种氧化应激状态[16]。γ-GT被认为是一种早期的敏感的氧化应激标志物,但其与绝经状态的关系不甚清楚。本研究发现随着γ-GT水平升高,除各种代谢指标趋于恶化外,女性绝经人数也渐趋增多。多元回归分析显示血清γ-GT水平与绝经状态独立相关,表明女性在绝经后这一特定时期γ-GT也许更易出现异常。鉴于多个研究认为γ-GT水平对于MS及心血管疾病的发生具有良好的预测作用,故对绝经后女性γ-GT水平升高,在排除肝脏本身病变的前提下,尤其要警惕机体是否合并其他代谢异常。事实上雌激素可通过多种途径影响肝酶的变化,包括促进肝脏脂肪酸β氧化酶的合成,加速肝脏脂肪的氧化,减少肝脏脂肪沉积[17]。此外,雌激素还能改善肝细胞的氧化应激状态,抑制肝细胞凋亡,促进肝细胞增殖[18-19]。
当前普遍认为血清γ-GT水平超过正常范围预示着肝脏存在病变,抑或预示MS、糖尿病及心血管疾病发生风险增加。但是本研究发现血清γ-GT水平在正常范围内的升高同样增加了MS的发生风险。因此,血清γ-GT处于正常范围内的较高水平也应当引起临床医师的重视,应进一步筛查个体是否合并各种代谢异常因素。
[1]Song X. Advanced on the determination and clinical study of metabolic syndrome[J]. Acta Acad Med CPAPF, 2010, 19(7):591-593. [宋宣. 代谢综合征的检测与临床研究进展[J]. 武警医学院学报, 2010, 19(7): 591-593.]
[2]Xing XY, Yang WY. Relationship between metabolic syndrome and liver diseases[J]. Chin J Pract Inter Med, 2011, 31(9): 659-660. [邢小燕, 杨文英. 代谢综合征与肝病[J]. 中国实用内科杂志, 2011, 31(9): 659-660.]
[3]Li CL, Tian H, Pan CY, et al. Comparison on diagnostic criteria for metabolic syndrome in the senile people[J]. Med J Chin PLA, 2007, 32(10): 1010-1013. [李春霖, 田慧, 潘长玉, 等. 代谢综合征不同诊断标准在老年人群的比较研究[J]. 解放军医学杂志, 2007, 32(10): 1010-1013.]
[4]Lee DS, Evans JC, Robins SJ, et al. Gamma glutamyl transferase and metabolic syndrome, cardiovascular disease, and mortality risk: the Framingham Heart Study[J]. Arterioscler Thromb Vasc Biol, 2007, 27(1): 127-133.
[5]André P, Balkau B, Vol S, et al. Gamma-glutamyltransferase activity and development of the metabolic syndrome(International Diabetes Federation Definition) in middle-aged men and women: Data from the Epidemiological Study on the Insulin Resistance Syndrome (DESIR) cohort[J]. Diabetes Care,2007, 30(9): 2355-2361.
[6]Oh HJ, Kim TH, Sohn YW, et al. Association of serum alanine aminotransferase and gamma-glutamyltransferase levels within the reference range with metabolic syndrome and nonalcoholic fatty liver disease[J]. Korean J Hepatol, 2011, 17(1): 27-36.
[7]Whitfield JB. Gamma glutamyl transferase[J]. Crit Rev Clin Lab Sci, 2001, 38(4): 263-355.
[8]Suh SY, Choi SE, Ahn HY, et al. The association between normal alanine aminotransferase levels and the metabolic syndrome:2005 Korean National Health and Nutrition Examination Survey[J]. Metabolism, 2009, 58(12): 1731-1736.
[9]Prati D, Taioli E, Zanella A, et al. Updated definitions of healthy ranges for serum alanine aminotransferase levels[J]. Ann Intern Med, 2002, 137(1): 1-10.
[10]Xu Y, Bi YF, Xu M, et al. Cross-sectional and longitudinal association of serum alanine aminotransaminase and gammaglutamyltransferase with metabolic syndrome in middle-aged and elderly Chinese people[J]. J Diabetes, 2011, 3(1): 38-47.
[11]Drozdz R, Parmentier C, Hachad H, et al. gamma-Glutamyltransferase dependent generation of reactive oxygen species from a glutathione/transferrin system[J]. Free Radic Biol Med, 1998, 25(7): 786-792.
[12]Paolicchi A, Emdin M, Passino C, et al. Beta-lipoprotein- and LDL-associated serum gamma-glutamyltransferase in patients with coronary atherosclerosis[J]. Atherosclerosis, 2006, 186(1):80-85.
[13]Lee DH, Jacobs DR Jr, Gross M, et al. Gammaglutamyltransferase is a predictor of incident diabetes and hypertension: the Coronary Artery Risk Development in Young Adults (CARDIA) Study[J]. Clin Chem, 2003, 49(8): 1358-1366.
[14]Stark AA. Oxidative metabolism of glutathione by gammaglutamyl transpeptidase and peroxisome proliferation:the relevance to hepatocarcinogenesis[J]. A hypothesis.Mutagenesis, 1991, 6(4): 241-245.
[15]Starcke S, Vollmer G. Is there an estrogenic component in the metabolic syndrome[J]. Genes Nutr, 2006, 1(3-4): 177-188.
[16]Hamden K, Carreau S, Ayadi F, et al. Inhibitory effect of estrogens, phytoestrogens, and caloric restriction on oxidative stress and hepato-toxicity in aged rats[J]. Biomed Environ Sci,2009, 22(5): 381-387.
[17]Toda K, Takeda K, Akira S, et al. Alternations in hepatic expression of fatty-acid metabolizing enzymes in ArKO mice and their reversal by the treatment with 17beta-estradiol or a peroxisome proliferator[J]. J Steroid Biochem Mol Biol, 2001,79(1-5): 11-17.
[18]Omoya T, Shimizu I, Zhou Y, et al. Effects of idoxifene and estradiol on NF-kappaB activation in cultured rat hepatocytes undergoing oxidative stress[J]. Liver, 2001, 21(3): 183-191.
[19]Inoue H, Shimizu I, Lu G, et al. Idoxifene and estradiol enhance antiapoptotic activity through estrogen receptor-beta in cultured rat hepatocytes[J]. Dig Dis Sci, 2003, 48(3): 570-580.
