应用伊立替康治疗一例UGT1A1*28纯合变异型大肠癌患者的体会
2013-10-31蔡炜嵩马赛男吴荣
蔡炜嵩 马赛男 吴荣
·病例讨论·
应用伊立替康治疗一例UGT1A1*28纯合变异型大肠癌患者的体会
蔡炜嵩 马赛男 吴荣
一、病例介绍
患者女性,56岁,体表面积1.54 m2。2010年11月14日,患者以绝经3年,阴道不规则流血2个月为主诉就诊于我院妇产科。腹部彩超检查示:盆腔囊实混合性肿物;肠镜下活检,病理回报:结肠腺癌。遂转入结直肠肿瘤病房。全腹部CT提示盆腔及结肠肝曲占位,肝转移(图1)。患者有间歇房颤6年,高血压病5年,有甲状腺结节及胆囊切除病史,青霉素过敏史。因患者强烈要求手术治疗,于2010年11月26日在全麻下行姑息性右半结肠切除术、盆腔转移瘤切除术、双附件切除术,手术过程顺利,患者恢复良好。病理回报:结肠腺癌。病理分期为T4N0M1,IV期。2010年12月28日,患者入我院肿瘤病房,接受氟尿嘧啶、亚叶酸钙联合伊立替康(mFOLFOX6)方案化疗八个周期,整个过程顺利,无明显不良反应。
二、治疗经过
2012年2月患者因病情进展再次入院。患者一般状态良好,生命体征平稳,中下腹可及包块,有深压痛。心率为90次/分,血压为105/70 mmHg,正常心电图。癌胚抗原(CEA)为248.4 ng/ml,血常规、肝肾功能、凝血、尿便常规及心电图检查均正常。复查CT示病情进展(图2)。
经MDT协作组专家讨论患者为结肠癌肝转移,初始治疗已应用mFOLFOX6方案,现疾病进展。但患者一般状态可以耐受高强度治疗,推荐应用氟尿嘧啶、亚叶酸钙联合伊立替康(FOLFRI)方案联合靶向药物继续治疗。该患虽K-ras基因为野生型,但患者因惧怕皮疹,拒绝使用西妥昔单抗靶向治疗药物。最终经患者同意应用FOLFRI方案联合贝伐单抗治疗。患者检测UGT1A1基因为7/7型(纯合突变)。
根据我院既往对伊立替康的用药经验及相关文献的报道[1],笔者决定将伊立替康按照每周方案分为两次给药,也就是第1天和第8天分次给予开普拓140 mg,氟尿嘧啶等其余药物按照标准FOLFRI方案给予,贝伐单抗于化疗前1 d给药。我们采取了密切监控副反应的措施,未预防性给药防止化疗副反应的发生。
2012年3月6日患者于开始化疗,用药初期未出现明显不良反应。化疗第3 d结束时,患者出现阵发性房颤,舌下含服倍他乐克后当日转为正常心率,行心脏彩超检查未见血栓形成,凝血指标未见异常。化疗第4天,患者腹痛症状消失;化疗第7天,白细胞计数为4.3×109/L,中性粒细胞计数为2.96×109/L,血小板计数为162×109/L。化疗第8天继续给予开普拓140 mg,治疗经过顺利。化疗第17 d,患者因乏力及腹泻急诊入院。自诉腹泻4天(化疗第13天开始出现腹泻),逐渐加重,患者未按出院医嘱口服易蒙停治疗。来院当日出现水样便,量多,6~7次/日,并伴有呕吐症状。入院后患者体温为39.4 ℃,血压为85/50 mmHg,心率为100次/分,血常规检查示白细胞计数为1.4×109/L,中性粒细胞计数为0.576×109/L,肝功检查示谷丙转氨酶为73 U/L,谷草转氨酶为79 U/L,总胆红素为27.3 umol/L,直接胆红素为9.527 umol/L,间接胆红素为17.827 umol/L。患者出现了腹泻,中性粒细胞减少,高热,肝功能异常,血压下降,呕吐等并发症。我们采取了易蒙停、肯特令、谷参胶囊口服治疗腹泻,应用瑞齐泰及爱茂尔止吐,拜复乐抗炎,同时给予营养支持治疗,并给特尔津200 ug每日一次升白细胞。治疗结果:2 d后腹泻症状缓解,体温恢复正常,6 d后腹泻停止,白细胞正常,痊愈出院。
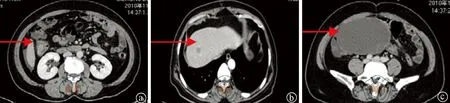
注:a图中箭头所示为结肠肝曲原发病灶;b图中箭头所示为肝脏第8段转移病灶;c图中箭头所示为中下腹转移包块
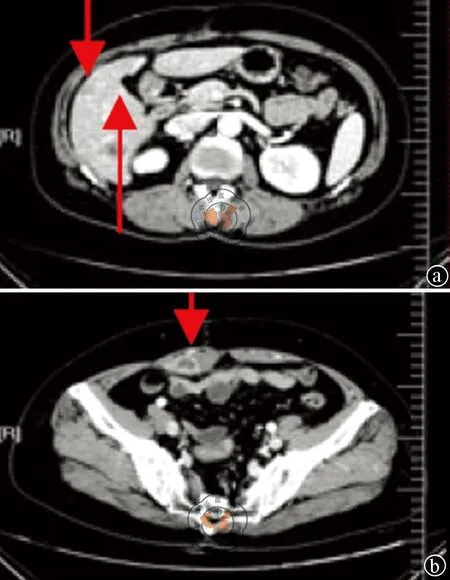
注:a图中箭头所示为肝脏第5、第6段转移病灶;b图中箭头所示为腹壁转移病灶
伊立替康说明书中标明,单次给予伊立替康,腹泻多在24 h后出现,中位时间为用药后5 d,平均持续4 d。如出现腹泻时给予洛派丁胺(易蒙停)治疗有效,用法为:首次4 mg口服,以后每2 h口服2 mg,末次水样便后12 h停止用药,连续用药不得超过48 h,严重腹泻时需静脉补液。该患者采取伊立替康分次给药的方式,在化疗周期第13天开始出现腹泻,由于未及时治疗,第17天出现3级腹泻。经过积极治疗后,于化疗第23天停止腹泻。
2012年4月11日患者行第2周期化疗,入院时患者一般状态良好,伴有轻度下腹痛,血常规检查结果正常。CEA为122.1 ng/ml较前一周期明显下降。现调整治疗剂量,将伊立替康减量为100 mg,其余药物不变。化疗第6天,血常规检查示白细胞计数为2.9×109/L,中性粒细胞计数为2×109/L,当日给予特尔津200 ug治疗,并隔日继续化疗,过程顺利。化疗第12天,患者出现腹泻,3次/天,血常规检查示白细胞计数为1.7×109/L,中性粒细胞计数为1.3×109/L,肝功检查示胆红素升增高,总胆红素为40.8 umol/L,给予每日一次特尔津200 ug,易蒙停、肯特令等治疗,2天后腹泻消失。第2周期化疗结束后复查CT,结果疾病稳定。
此后患者连续进行化疗、局部治疗、中医药治疗,肝脏转移灶采取局部射频消融治疗,腹部包块采用放射治疗的方法。经随访该患者现仍在接受治疗中。
三、讨论
伊立替康(CPT-11)联合氟尿嘧啶类药物(5-氟尿嘧啶、卡培他滨)是治疗晚期结直肠癌的主要化疗方案。尿苷二磷酸葡糖苷酸转移酶(UGT1A1)是与CPT-11药物代谢相关的重要代谢酶,其基因多态性与伊立替康导致的中性粒细胞减少和迟发性腹泻有关。伊立替康剂量探索研究发现,与野生基因型相比,UGT1A1*28纯合变异基因型患者对伊立替康的最大耐受剂量明显较低。研究发现,UGT1A1基因的多态性在不同人种之间存在显著差异,中国人使用含伊立替康方案的剂量探索性研究尚未有结论[2]。
对UGT1A1纯合突变的患者应用FOLFRI方案,全量使用伊立替康应慎重,且应在有经验的医院进行。即使采取分次给药的方式,患者仍容易出现3级及以上不良反应。常见的不良反应是迟发性腹泻和中性粒细胞减少。另外也有胆红素及转氨酶升高,恶心呕吐等。本例患者采用伊立替康分次给药方法,开始出现不良反应在化疗第12~13天,与单次给药不同,如果能在这个时间点及时就医,腹泻是可控的。另外还要密切监测血常规,中性粒细胞减少及发热是迟发性腹泻外的严重不良反应。
对于化疗相关性腹泻,目前研究认为,很多对症治疗药物能够明显减轻化疗性腹泻。治疗伊立替康引起的腹泻,应用易蒙停、布地奈德、黏膜保护剂、活性炭、广谱抗生素、谷氨酰胺、生长抑素、奥曲肽等都有一定的治疗效果。伊立替康引起的迟发性腹泻,通常不推荐应用肠道益生菌类药物,因为很多肠道菌种能产生β-产葡糖醛酸糖苷酶,能将SN-38G再次转换为活性的SN-38,加重伊立替康引起肠粘膜损伤。另外,头孢克肟、喹诺酮类抗生素已经证实对于治疗伊立替康引起的腹泻有效[3-5]。
UGT1A1突变患者通常有更高的伊立替康代谢产物SN-38的血药浓度,但同时也存在更高的不良反应发生率。目前研究认为更高的血药浓度并没有带来更好的疗效[6],主要原因考虑是由于毒副反应的发生,患者不能从前一疗程治疗中恢复,从而影响了下一疗程的用药。毒性反应的发生加大了患者化疗相关性死亡的风险。由于毒性反应的发生,患者在后续治疗中被迫药物减量等。
[1] Yoshimura A,Noro R,Miyanaga A,et al.Combination chemotherapy of alternating etoposide and carboplatin with weekly administration of irinotecan and cisplatin in extensive-stage small-cell lung cancer.Anticancer Res,2012,32(10):4473-4478.
[2] 王岩,葛飞娇,林莉,等.UGT1A1基因多态性与伊立替康为主方案治疗晚期结直肠癌的毒性和疗效的相关性分析.临床肿瘤学杂志,2012,17(11):961-966.
[3] 王颖,蔡炜嵩,张宇,等.奥曲肽对伊立替康化疗后迟发性腹泻小鼠肠黏膜损伤的预防作用.现代肿瘤医学,2010,18(12):2293-2297.
[4] Biason P,Masier S,Toffoli G.UGT1A1*28 and other UGT1A polymorphisms as determinants of irinotecan toxicity.J Chemother,2008,20(2):158-165.
[5] 张程亮,高静,沈倩.预防和治疗伊立替康所致腹泻的研究进展.中国药学杂志,2010,45(22):1704-1707.
[6] Shulman K,Cohen I,Barnett-Griness O,et al.Clinical implications of UGT1A1*28 genotype testing in colorectal cancer patients.Cancer,2011,117(14):3156-3162.
蔡炜嵩,马赛男,吴荣.应用伊立替康治疗一例UGT1A1*28纯合变异型大肠癌患者的体会[J/CD].中华结直肠疾病电子杂志,2013,2(5):256-257.
10.3877/cma.j.issn.2095-3224.2013.05.14.
110004 沈阳,中国医科大学附属盛京医院肿瘤科
吴荣,Email:cailab9@hotmail.com
2013-10-01)
(本文编辑:马天翼)
