N-[2.2]对环芳烷酰基-N’-噁唑啉的合成
2013-10-30徐涵
徐 涵
(黄山学院 化学化工学院,安徽 黄山245041)
0 引 言
平面手性配体作为一类独立而重要的配体近年来在不对称催化反应中得到了广泛的应用并取得了好的结果。平面手性配体主要包括羰基金属络合物类和二茂铁类及新型的环芳烷类。目前,二茂铁类和羰基金属络合物类平面手性化合物是不对称催化反应中应用最广泛的两类平面手性配体,然而构成这两类平面手性化合物的基本构架对光、热、空气、氧化剂、强酸以及强碱等的不稳定性,在一定程度上限制了它们的进一步应用。早在上世纪50年代初,Cram 和Brown 就已实现了[2.2]对环芳烷的合成,[1-3]随后,多种[2.2]对环芳烷类配体被大量的合成出来,并应用于不对称催化反应,取得良好的对映选择性。与二茂铁类和羰基金属络合物类平面手性化合物相比,[2.2]对环芳烷骨架具有如下优点:1.高的化学稳定性(对光、热、酸、碱、氧化剂以及还原剂等);2.不易消旋化(一般在200°C 附近才发生消旋化);3.由于[2.2]对环芳烷骨架的一个苯环的对映面被分子中另一个苯环所屏蔽以及分子本身所具有的高刚性,使得手性[2.2]对环芳烷化合物在参与反应时同样会提供有效的不对称环境,从而能得到较好的不对称诱导结果;4.平面手性的引入较为方便,在其骨架的苯环上只需引入一个取代基就可形成平面手性。[4]我们以[2.2]对环芳烷为基础,引入羧基生成平面手性的4-羧酸[2.2]对环芳烷,4-羧酸[2.2]对环芳烷与草酰氯和硫氰酸胺反应得到异硫氰酸酯,异硫氰酸酯与氨基乙醇反应,并用柱层析纯化以70%-75%的收率得到纯的羟乙基硫脲,羟乙基硫脲在N,N′-二环己基碳酰亚胺和三乙胺的作用下,脱去H2S,发生关环反应,生成N-[2.2]对环芳烷酰基-N′-噁唑啉。
1 实验部分
1.1 试剂与仪器
无水三氯化铝、三氟醋酐、[2.2]对环芳烷、硫氰酸胺、N,N′-二环己基碳酰亚胺、氨基乙醇、盐酸、丙酮、三乙胺等以上试剂均为分析纯,且没有进一步处理。元素分析在Perkin-Elmer240C 元素分析仪上进行;以CDCl3或DMSO-d6为溶剂,于室温下在BrukerAM-500 型核磁共振仪上测定1HNMR 谱,化学位移值以溶剂的残留峰为基准。
1.2 4-羧酸[2.2]对环芳烷的合成
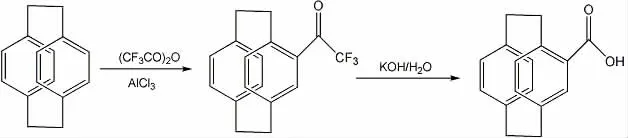
4-羧酸[2.2]对环芳烷用参考文献[5]方法制得,在N2气保护下,1000ml 三颈瓶中加入研细的40g 无水三氯化铝和500ml 无水二氯甲烷,冷却至0℃,然后加入45ml 三氟醋酐,反应0.5h 后缓慢加入21mg[2.2]对环芳烷,2h 后反应完全。加入20ml 蒸馏水直至没有白色烟雾放出。反应混合物依次用蒸馏水、1mol/L 的氢氧化钠清洗。用旋转蒸发仪旋干溶剂,加入10%的氢氧化钾水溶液一起回流反应4h, 冷却至室温,析出大量白色片状固体,加入10%的氢氧化钾溶液至固体溶解。水相用氯仿充分提取。合并萃取液,用旋转蒸发仪旋干溶剂,加入浓盐酸酸化。抽干,干燥,得白色固体23.0g,产率:86%。
1.3 4-羧酸[2.2]对环芳烷的拆分[6]
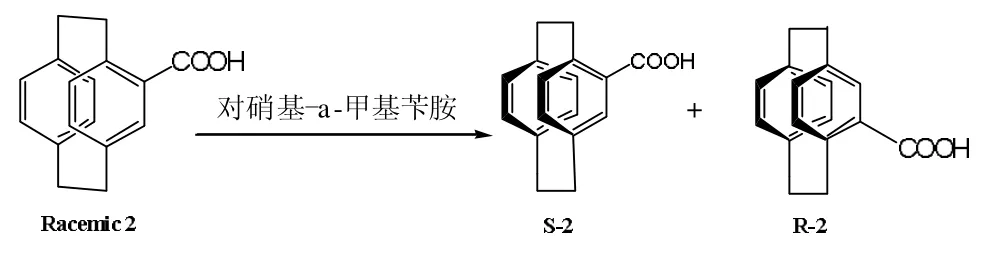
将7.0g (R)-对硝基-α-甲基卞胺溶于120ml 的三氯甲烷溶液。将此溶液与溶有8.2g 的4-羧酸[2.2]对环芳烷的120ml 三氯甲烷溶液混合,50℃搅拌2h。冷至室温,放人冰箱冷藏过夜,次日将析出的白色固体1 过滤出来并将滤液保存。固体1(=+42.5(c=0.8,丙酮))盐酸酸化,过滤,得白色固体2 即为产品R-2。将上述保存溶液用盐酸酸化,过滤得白色固体,再用(S)-对硝基-α-甲基卞胺按照上述方法进行拆分,得到S-2 白色固体。
(R)-4-羧酸[2.2]对环芳烷,产率:24%,熔点:。
(S)-4-羧酸[2.2]对环芳烷,产率:35%,熔点:。
1.4 N-[2.2]对环芳烷酰基-N,-羟乙基硫脲的合成
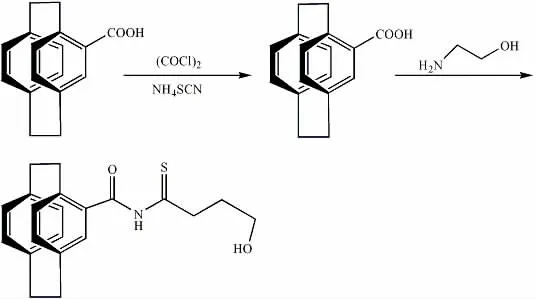
将65ml 苯和1.5g 的(R)/(S)-4-羧酸[2.2]对环芳烷充分混合,搅拌条件下加入3ml 草酰氯,20min 后溶液变成淡黄色澄清透明溶液,继续搅拌反应2h,用旋转蒸发仪旋干溶剂,得淡黄色固体。氮气保护下,迅速加入10g 无水丙酮和1g 硫氰酸胺,搅拌30min,得中间产物[2.2]对环芳甲酰异硫氰酸酯,在[2.2]对环芳甲酰异硫氰酸酯溶液中直接加入10mmol 的氨基乙醇,继续搅拌4h 至反应完全,然后用旋转蒸发仪旋干溶剂得白色粉末状的粗产品。粗产品用硅胶柱层析纯化(洗脱剂:石油醚/乙酸乙酯/丙酮,15:1:1)得纯产品。
(R)-N-[2.2]对环芳烷酰基-N′-羟乙基硫脲,产率:70%,白色固体。=-138.0(c=0.01EtOH)。元素分析(C20H22N2O2S)理论值(%):C67.80;H6.21;N7.91;实 测 值 (%):C67.82;H6.17;N8.15.1HNMR(CDCl3):δ10.94(s,1H),8.44(s,1H),7.19-6.36(m,7H),3.92(m,4H),3.59 (m,1H),3.14 (m,4H),2.90 (m,3H),1.67 (s,1H)。
(S)-N-[2.2]对环芳烷酰基-N′-羟乙基硫脲,产率:58%,白色固体。=+140.7(c=0.02EtOH)。元素分析(C20H22N2O2S)理论值(%):C67.80;H6.21;N7.91;实 测 值 (%):C67.82;H5.91;N8.24.1HNMR(CDCl3):δ10.94(s,1H),8.44(s,1H),7.19-6.36(m,7H),3.92(m,4H),3.59 (m,1H),3.14 (m,4H),2.90 (m,3H),1.67 (s,1H)。
1.5 N-[2.2]对环芳烷酰基-N′-噁唑啉的合成

将(R)/(S)-N-[2.2]对环芳烷酰基-N′-羟乙基硫脲2mmol 溶于15ml 的乙氰中,先加入4mmol 的N,N′-二环己基碳酰亚胺,再1ml 三乙胺调节溶液的PH 值,回流反应12h。待反应完全后,用旋转蒸发仪旋干溶剂,再倒入20ml 四氢呋喃,冷却至0℃放置24h,将溶液中未反应的白色固体N,N′-二环己基碳酰亚胺过滤掉,再次用旋转蒸发仪旋干溶剂,得粗产品。将粗产品用硅胶柱层析纯化(洗脱剂:石油醚/乙酸乙酯=15:1)。
(R)-N-[2.2]对环芳烷酰基-N′-噁唑啉,产率85%,白色固体。=-92.4(c=0.01EtOH)。元素分析(C20H20N2O2)理论值(%):C75.00:H6.25;N8.75;实测值(%):C75.82;H6.17;N8.15.1HNMR (CDCl3):δ9.52 (s,1H),7.19-6.36(m,7H),3.92(m,4H),3.59(m,1H),3.14(m,4H),2.90(m,3H)。
(S)-N-[2.2]对环芳烷酰基-N′-噁唑啉,产率82%,白色固体。=+90.0(c=0.02EtOH)。元素分析:(C20H20N2O2)理论值(%):C75.00;H6.25;N8.75;实测 值(%):C75.12;H6.23;N8.24.1HNMR(CDCl3):δ9.65(s,1H),7.19-6.36(m,7H),3.92(m,4H),3.59(m,1H),3.14(m,4H),2.90(m,3H)。
2 结 论
合成了具有手性的(R/S)-[2.2]对环芳烷酰基-N′-噁唑啉手性配体,从上世纪九十年代后期[2.2]对环芳烷类平面手性化合物作为一类崭新的手性配体结构在不对称催化反应中的应用引起化学家们越来越多的关注。但是,我们必须看到这类平面手性配体的应用仅仅处于起步阶段, 进一步的更深层次的应用和研究仍有很长的路要走。首先,[2.2]对环芳烷类化合物特别是手性化合物的合成方法较少, 可以说这是制约环芳烷类平面手性配体进一步发展和应用的关键问题, 应该大力发展利用不对称催化的方法直接合成平面手性[2.2]对环芳烷的研究。其次,对平面手性[2.2]对环芳烷类配体骨架在不对称催化反应中作用的认识有待研究, 以便进一步有目的地设计、合成和发展高效[2.2]对环芳烷类手性配体。第三,扩大平面手性[2.2]对环芳烷类配体的应用范围,一是丰富和发展配体类型;二是尽可能多地将配体应用于其它类型的不对称催化反应。相信随着在不对称催化反应中应用的不断拓宽和深入,[2.2]对环芳烷类平面手性配体必将显示其独特而广泛的应用前景。
[1]Brown C J,Farthing A C.Preparation and Structure of Di-pxylylene[J].Nature,1949,164:915-916.
[2]Cram D J,Steinberg H,Macro R I.Preparation and Spectra of the Paracyophanes [J].J Am Chem.Soc,1951,73:5691-5704.
[3]Cram D J,Allinger N,Rings L,M.Strteochemical Consequences of Steric Compression in the Smallest Paracyclophane[J].J Am Chem.Soc,1955,77:6289-6294.
[4]巫循伟,孙威,侯雪龙.[2.2]对环芳烷平面手性配体在不对称催化反应中的应用[J].有机化学,2003,(9):906-913.
[5]Waters J F,Sutter J K,Meador M A,et al.Addition curing thermosets endcapped with 4-amino [2.2]paracyclophane[J].Polym Sci,Part A: Polym.Chem,1991,29 (13):1917-1924.
[6]Valeria R,Vladimir K,Dimitri A,et al.Scalemic 2 -Formyl-3-hydroxy [2.2]paracyclophane: A New Auxiliary for Asymmetric Synthesis[J].Angew Chem Int Ed,1994,33(1):91-92.
