气相色谱-三重四级杆串联质谱法测定湖泊沉积物中的有机氯农药
2013-10-30李超灿霍守亮席北斗沈阳航空航天大学辽宁沈阳110136
李超灿,霍守亮,席北斗*1.沈阳航空航天大学,辽宁 沈阳 110136
2.中国环境科学研究院,北京 100012
气相色谱-三重四级杆串联质谱法测定湖泊沉积物中的有机氯农药
李超灿1,2,霍守亮2,席北斗2*
1.沈阳航空航天大学,辽宁 沈阳 110136
2.中国环境科学研究院,北京 100012
建立了索氏提取、气相色谱-三重四级杆串联质谱(GC-MSMS)分析湖泊沉积物中20种有机氯农药的方法。样品萃取液经硅胶氧化铝层析柱净化,使用不同配比二氯甲烷、正己烷混合溶剂对吸附在层析柱上的目标物进行洗脱,洗脱液浓缩后进GC-MSMS检测。应用三重四级杆串联质谱仪的多级反应监测模式,配以有机氯农残分析专用VF-1701色谱柱,完全排除了沉积物基质干扰,对目标化合物进行精准的定性定量分析,简化了前处理过程。该方法灵敏度较高,仪器的线性范围良好。基质样品加标回收率为79.76%~115.04%,相对标准偏差为1.15%~14.08%。方法检出限为0.002 4~0.513 7 μgkg,方法定量限为0.007~1.541 μgkg。该方法适合检测沉积物中痕量有机氯农药残留。
气相色谱-三重四级杆串联质谱;有机氯农药;沉积物
有机氯农药(organochlorine pesticides,OCPs)是一种典型的在全球范围内被广泛生产和使用的持久性有机物(POPs),已成环境界学者和公众的关注热点[1]。沉积物对OCPs的迁移转化起着重要的作用,OCPs通过地表径流、地下水以及大气沉降等过程进入水体并沉积到底泥中长期累积,所以沉积物是有机氯农药重要的“汇”[2-4]。此外沉积物中的OCPs还能通过再悬浮进入水体中造成二次污染[5-6];甚至通过食物链传递和生物富集进入人类食物中[7]。因此准确定量沉积物中的OCPs对研究其在沉积物中的浓度分布等有关键作用,通过对其浓度分析初步确定湖区沉积物可能的生态风险因子,可为当地持久性有机物污染现状评估和治理提供依据[8]。
当前国内外定量OCPs常用的方法主要是化学分析方法,主要包括气相色谱法(GC)[9-10]、气相色谱-质谱法(GC-MS)[11-14]、液相色谱法(LC)[15]等。其中GC法和LC法仅能通过保留时间定性[15-16],难以对目标化合物进行准确的定性;且其选择性不强,相近化合物容易共流出[17],检出限也相对较高[12];而GC-MS法对一些有机氯农药的灵敏度较差[18],在分析沸点相对较高或相对分子量较低的农药时易受复杂基质成分和柱流失的干扰[18-19],会降低方法的灵敏度和检出限,为了消除基质干扰常选择复杂的前处理过程,步骤繁琐耗时耗溶剂。
选用有机氯农残分析专用VF-1701色谱柱,该毛细管色谱柱,是一种超低流失色谱柱,具有强惰性柱内表面,可以大大减少农药吸附,有效提高分析的灵敏度以及解决柱流失带来的各种问题。因此使用三重四级杆串联质谱配以有机氯农残分析专用柱能大大简化样品的前处理过程,同时进行准确地定性和定量。
当前三重四级杆串联质谱法多用于动、植物组织体内农药残留检测[25-30],而在沉积物中的检测还少有报道,因此在前人研究成果的基础上建立了使用气相色谱-三重四级杆串联质谱仪同时测定湖泊沉积物中20种有机氯农药残留的方法。
1 试验
1.1 主要仪器和试剂
索氏抽提器(250 mL,瀚赫国际贸易上海有限公司);Büchi旋转蒸发仪(R114,瑞士BüCHI公司);氮吹浓缩仪;气相色谱(Agilent 7890,美国)-三重四级杆串联质谱仪(Agilent 7000A,美国)。
正己烷(HPLC级,德国Merck公司);二氯甲烷(HPLC级,德国CNW公司);丙酮(HPLC级,美国J&K公司);甲醇(HPLC级,美国J.T. Baker公司)。
CLP有机氯农药混标样(美国Supelco公司),其中包括4种六六六(α-HCH、β-HCH、γ-HCH和δ-HCH)、p,p’-DDD、p,p’-DDE、p,p’-DDT、硫丹Ⅰ(α-Endosulfan)、硫丹Ⅱ(β-Endosulfan)、α-氯丹(α-chlordane)、γ-氯丹(γ-chlordane)、艾氏剂(Aldrin)、狄氏剂(Dieldrin)、异狄氏剂(Endrin)、环氧七氯(Heptachlor exoepoxide)、七氯(Heptachlor)、异狄氏剂醛(Endrin aldehyde)、异狄氏剂酮(Endrin ketone)、硫丹硫酸酯(Endosulfan sulfate)、甲氧DDT(Methoxychlor)、PCB-209。
样品试验添加的回收率指示物为2,4,5,6-四氯间二甲苯(TMX,农残级,美国Supelco公司);13C-PCB-208(农残级,美国Andover,MA公司)。
进样内标五氯硝基苯(PCNB,农残级,美国Ultra-Scientific公司)。
所用层析硅胶(试剂级,80~100目,青岛海洋化工厂)经甲醇、二氯甲烷依次索氏抽提36 h净化后,于180 ℃烘箱中烘烧12 h,加3%纯净水去活,置于磨口玻璃瓶中备用[31]。氧化铝(试剂级,100~200目,上海五四化学试剂有限公司)经甲醇、二氯甲烷依次索氏抽提36 h净化后,置于250 ℃烘箱烘干12 h,加3%的超纯水去活备用[32]。无水硫酸钠为分析纯,450 ℃灼烧6 h,置于干燥器备用。
所用玻璃器皿均经浓硫酸-重铬酸钾洗液洗涤,然后用自来水和纯净水各冲洗3遍,烘干,置于450 ℃马弗炉中焙烧,备用。
1.2 样品预处理
1.2.1 沉积物样品的萃取
选取湖泊若干沉积物样品(保存于-20 ℃冰箱中),经冷冻干燥机(ALPHA 2-4,德国CHRIST公司)干燥后研磨,过100目筛。称取磨好的沉积物样品10 g,于索氏提器滤筒中用200 mL二氯甲烷和正己烷混合溶剂(体积比为1∶1)抽提,同时向提取溶剂中加入回收率指示物(20 ng的TMX和10 ng13C-PCB-208),以及少量铜片除去干扰元素硫[33];水浴恒温51 ℃,索氏抽提48 h。
1.2.2 提取液的净化
提取液经无水硫酸钠脱水后使用旋转蒸发仪浓缩至1~2 mL,经硅胶氧化铝层析柱进一步净化。层析柱采用人工湿法装柱,向内径为1 cm的玻璃层析柱内自下而上分别装入6 cm中性氧化铝、12 cm中性硅胶和2 cm的无水硫酸钠。洗脱溶剂为70 mL二氯甲烷和正己烷混合溶剂(体积比为1∶1,F1组分,含绝大部分OCPs目标化合物)和70 mL二氯甲烷(F2组分,做保留组分)。随后,洗脱液经浓缩氮吹至0.2 mL以下,加入10 ng进样内标PCNB,定容至200 μL后冷冻保存,待上机检测。
1.3 仪器分析条件
目标化合物的检测通过气相色谱(Agilent 7890,美国)-三重四级杆串联质谱仪(Aglient 7000A,美国)在多级反应监测(Multiple Reaction Monitoring,MRM)模式下进行。色谱柱采用有机氯农残分析专用VF-1701 色谱柱(35 m×0.25 mm;i.d. 0.25 μm;美国Aglient公司)。载气为99.999%高纯氦气,采用恒流模式,柱流量为1.2 mLmin;脉冲不分流进样,自动进样1 μL(自动进样器G4513A,美国Agilent公司);进样口温度250 ℃。
升温程序共设定5段:130 ℃持续1 min;以30 ℃min的速率升至160 ℃保持10 min;以0.5 ℃min的速率升至170 ℃保持10 min;以0.5 ℃min的速率升至180 ℃保持20 min;以2 ℃min速率升至200 ℃并保持20 min。传输线温度设为280 ℃,离子源温度为230 ℃,2个四级杆温度均为150 ℃;碰撞反应气为氮气,流速为1.5 mLmin;淬灭气为氦气,流量为2.25 mLmin。
2 结果与讨论
2.1 样品的定性与定量分析
表1 检测OCPs的GC-MSMS方法参数条件
Table 1 The GC-MSMS method parameters for determinate OCPs

表1 检测OCPs的GC-MSMS方法参数条件
时间∕minOCPs保留时间∕min定性离子对碰撞能量∕eV定量离子对碰撞能量∕eV10 00~19 50TMX15 699244>20910242>2071019 50~21 00α⁃BHCPCNB20 08620 128256>183293>2631015219>183295>265101521 00~22 10γ⁃BHC21 805256>18310219>1831022 10~23 00七氯22 564372>23715272>2372023 00~24 30艾氏剂23 661329>2935263>1931024 30~25 35β⁃BHC24 903256>18310219>1831025 35~26 05δ⁃BHC25 792256>18310219>1831026 05~27 00环氧七氯26 375353>2635390>2535硫丹Ⅰ27.404241>20610195>159527.00~28.00γ⁃氯丹27.615373>26410375>26610α⁃氯丹27.813373>26410375>26610
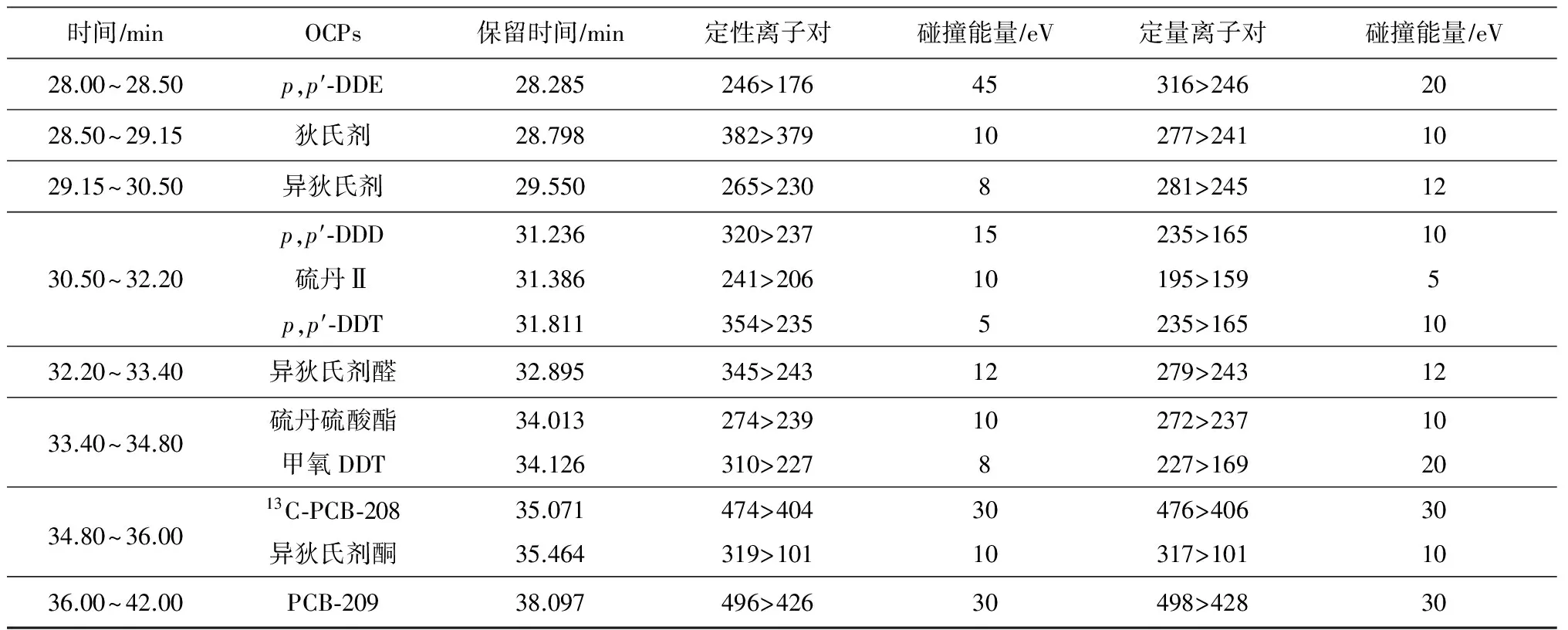
(续表1)
2.2 方法的线性关系和检出限

表2 OCPs的标准工作曲线和方法检出限
从表2可以看出,各种有机氯农药的校正曲线相关系数(R)都在0.995以上。
方法检出限和定量限采用US EPA规定的方法检出限的计算方法进行测算,即按照1.2节和1.3节提出的样品处理和测定方法,测定7个重复的低浓度加标样品,计算各种物质的相对标准偏差(s),在99%置信水平下,自由度为n-1时确定的Student’s值t〔t99(n-1)〕,查表得t99(n-1)=3.143。则方法检出限(MDL)=3.143s(表2)。把方法定量限设定为10倍的估计定量限浓度,则对7个加标控制样(6度自由)来说,t99(n-1)=103.143=3.182,取近似值3,方法定量限(MQL)可定义为:MQL=3×MDL(表2)。
2.3 方法的回收率和精密度
采用基质加标的方法对基质样品进行加标回收检测,通过20种有机氯农药的加标回收率和相对标准偏差的波动考察所建立的仪器检测方法在不同基质中的准确度和精密性。
取5个不同的沉积物基质样品,分别向其中加入10 μL浓度为2 μgmL的20种OCPs标准样品,按照1.2节所述的样品预处理方法对基质样品进行处理,进气相色谱-三重四级杆串联质谱仪分析,结果显示,在洗脱组分F1中,除异狄氏剂醛外的19种有机氯农药和2种回收率指示物均可检出,加标回收率为79.76%~115.04%,5个不同基质样品所测结果的相对标准偏差为1.15%~14.08%。由于异狄氏剂醛极性过强,在净化过程中被淋洗到F2中,检测保留组分F2,5个不同基质样品中异狄氏剂醛的平均回收率为87.58%,相对标准偏差为11.83%。由此可见,该方法在检测的过程中完全可以排除基质效应的干扰,检测结果稳定可靠。图1为20种有机氯农药的加标回收情况。
HIV/AIDS患者因细胞免疫功能低下而容易发生各种侵袭性真菌感染(IFI),引起IFI的真菌几乎包含所有已知的致病性真菌和某些条件致病性真菌,对患者危害较大[1-2]。而临床症状缺乏典型、影像结果特异性低、活检病理送检率不高、直接或间接涂片镜检的检出率低以及培养法所需时间长等不利因素,严重影响诊断的准确性和及时性,因此获得准确、及时的诊断非常有必要[3]。 目前,(1,3)-β-D-葡聚糖检测(G试验)和半乳甘露聚糖检测(GM试验)在国内外已广泛应用于IFI的诊断,并且被证实效果良好。为此,本研究拟探讨G试验联合GM试验对明确诊断HIV/AIDS患者合并IFI的价值。
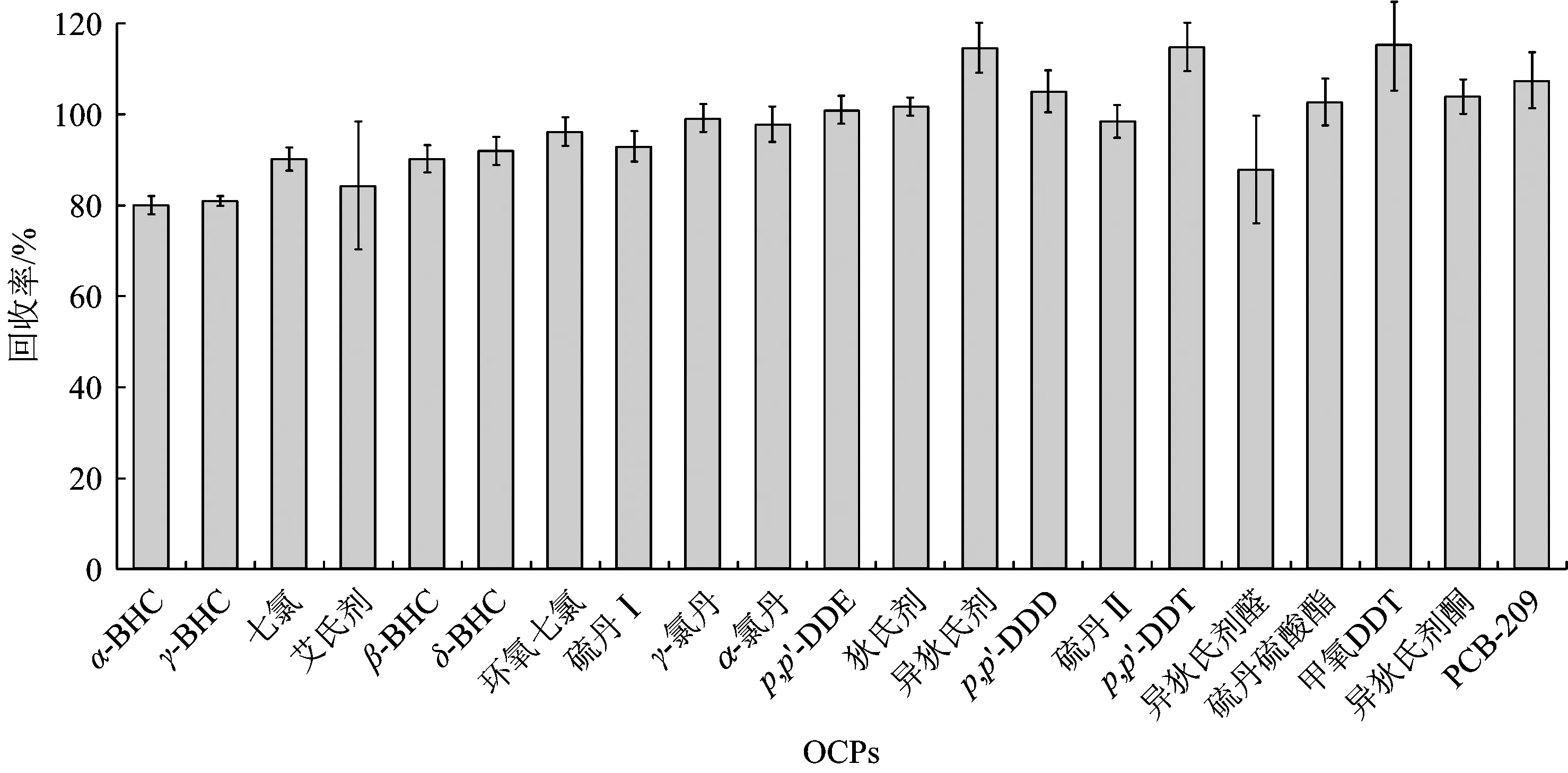
图1 不同基质中农药在2 ngg添加水平下的平均回收率及RSD值Fig.1 Average recoveries and RSDs of OCPs spiked in different matrixes at 2 ngg for each organochlorine pesticide
由图1可以看出,该检测方法中所有目标化合物的加标回收率及相对标准偏差均能够满足实际测定的要求。US EPA要求不同种有机氯农药的回收率为17%~160%,该方法检测结果与US EPA所规定的OCPs回收率范围完全符合[34]。且该方法大大降低了基质干扰的影响,精密度更可靠。
2.4 质量控制和质量保证
为了确保试验结果的准确性,在预处理方面增加方法空白、加标空白以及基质加标来避免前处理过程中的样品污染,定量方法采用内标校正,利用前处理过程中添加回收率指示物四氯间二甲苯(TMX)和13C-PCB-208监测样品处理过程中的回收率。在仪器质控方面,进样前利用p,p’-DDT标准溶液检测进样口对其的降解率,DDTs的降解率必须小于15%才可对样品进行正常检测,每个工作日调试1次;同时每隔1组样品进1针20种有机氯农药的标样作为质控来进行进样过程中仪器的稳定性检测。
在试验预处理方面,方法空白样品中除回收率指示物TMX和13C-PCB-208,以及进样内标PCNB被检出外,没有检测到目标化合物,可见在整个试验流程中没有人为因素和实验室背景因素对目标化合物的影响。在空白加标分析中,20种有机氯的回收率平均值为78.7%~100.8%。基质加标分析后回收率为79.76%~115.04%。
在仪器的检测方面,仪器进样前进样口处DDTs降解检测所得DDT的降解率为9.5%~14.3%,低于15%。用于检测仪器稳定性的20种标样的质控样品在不同时段的仪器响应信号标准偏差为3.92%~14.61%。
根据上述质量控制和质量保证措施所得结果,试验过程所得的数据真实可靠,完全符合质量控制和质量保证的基本要求[35-36]。
2.5 实际样品分析

注:a为TMX;b为α-BHC;c为γ-BHC;d为七氯;e为艾氏剂;f为β-BHC;g为δ-BHC;h为环氧七氯;i为硫丹Ⅰ;j为γ-氯丹;k为α-氯丹;l为p,p′-DDE;m为狄氏剂;n为异狄氏剂;o为p, p′-DDD;p为硫丹Ⅱ;q为p,p′-DDT;r为异狄氏剂醛;s为硫丹硫酸酯;t为甲氧DDT;u为异狄氏剂酮;v为PCB-209。图3同。
应用所建立的沉积物中OCPs仪器分析方法,对某湖泊中表层沉积物中的实际样品进行分析测定,样品经预处理后进气相色谱-三重四级杆串联质谱仪分析检测,样品的总离子流图如图3所示。由图3可见,该样品受到不同种类有机氯农药的污染,在该样品中主要检测出α-BHC、β-BHC、γ-BHC、δ-BHC、p,p′-DDE、p,p′-DDD、p,p′-DDT以及异狄氏剂醛8种有机氯农药。根据所建立的定性定量分析方法,计算出在该采样点中8种有机氯农药的浓度分别为1.08、1.68、0.42、0.45、4.31、6.78、1.80和0.05 ngg,所有检出有机氯农药的总浓度为16.57 ngg,可见该湖泊区域内存在着一定的有机氯农药污染。
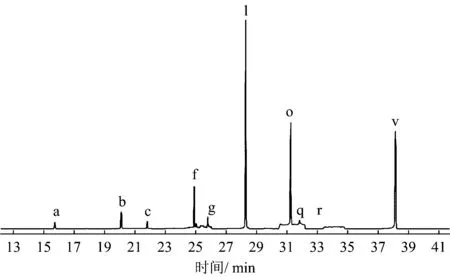
图3 湖泊沉积物样品的检测色谱总离子流图Fig.3 The chromatograms of the lake sediment samples
3 结论
建立了气相色谱-三重四级杆串联质谱检测湖泊沉积物中的痕量有机氯农药的方法,沉积物样品先经索氏提取和多层复合硅胶和氧化铝层析柱净化后经GC-MSMS在多级反应监测模式下进行检测与分析。经验证,该方法灵敏度高,标准品工作曲线线性关系良好,仪器检出限的方法定量限均低于国际纯粹与应用化学联合会(IUPAC)规定的方法检出限和定量限的规定限值,并且通过对于不同基质样品加标回收率的验证,完全实现了复杂基质干扰的影响,并且通过气相色谱-三重四级杆串联质谱法的特殊的MRM模式下母离子对和子离子对的一一对应的定性定量分析上克服了一些物质难以识别的难点。该方法稳定性和精密性可靠。使用该方法能够在简化前处理的前提下完成对沉积物中有机氯农药残留的精确定性和定量,符合农残检测的分析要求。
[1]JIANG Y F,WANG X T,JIA Y,et al.Occurrence,distribution and possible sources of organochlorine pesticides in agricultural soil of Shanghai,China[J].Journal of Hazardous Materials,2009,170(23):989-997.
[2]BAKAN G,ARIMAN S.Persistent organochlorine residues in sediments along the coast of mid-Black Sea region of Turkey[J].Marine Pollution Bulletin,2004,48(1112):1031-1039.
[3]乔敏,黄圣彪,朱永官,等.太湖梅梁湾沉积物中多环芳烃的生态和健康风险[J].生态毒理学报,2007,2(4):456-463.
[4]YANG R Q,JIANG G B,ZHOU Q F,et al.Occurrence and distribution of organochlorine pesticides (HCH and DDT) in sediments collected from East China Sea[J].Environment International,2005,31(6):799-804.
[5]WANG Z,YAN W,CHI J,et al.Spatial and vertical distribution of organochlorine pesticides in sediments from Daya Bay,South China[J].Marine Pollution Bulletin,2008,56(9):1578-1585.
[6]WU Y,ZHANG J,ZHOU Q.Persistent organochlorine residues in sediments from Chinese riverestuary systems[J].Environmental Pollution,1999,105(1):143-150.
[7]赵中华,张路,于鑫,等.太湖表层沉积物中有机氯农药残留及遗传毒性初步研究[J].湖泊科学,2008,20(5):579-584.
[8]HU L,ZHANG G,ZHENG B,et al.Occurrence and distribution of organochlorine pesticides (OCPs) in surface sediments of the Bohai Sea,China[J].Chemosphere,2009,77(5):663-672.
[9]TOR A,AYDIN M E,ÖZCAN S.Ultrasonic solvent extraction of organochlorine pesticides from soil[J].Analytica Chimica Acta,2006,559(2):173-180.
[10]BARAKAT A O,MOSTAFA A,WADE T L,et al.Assessment of persistent organochlorine pollutants in sediments from Lake Manzala,Egypt[J].Marine Pollution Bulletin,2012,64(8):1713-1720.
[11]王英,亓学奎,马召辉,等.气相色谱负化学电离源质谱法测定底泥中的有机氯农药[J].化学通报,2011,74(3):264-269.
[12]董静,潘玉香,秦亚萍,等.气相色谱-负化学离子源质谱法同时检测蔬菜中103种农药残留[J].分析科学学报,2010(3):323-328.
[13]LIU G,LI J,YIN L,et al.Distribution characteristics of organochlorine pesticides in surface and vertical sediments from the Zha Long Wetland,China[J].Environmental Science and Pollution Research,2012,19(7):2681-2689.
[14]SOJINU O S,SONIBARE O O,EKUNDAYO O O,et al.Assessment of organochlorine pesticides residues in higher plants from oil exploration areas of Niger Delta,Nigeria[J].Science of The Total Environment,2012,433:169-177.
[15]徐恒振,宣秋江,周传光,等.10种多氯联苯和16种有机氯农药的分离与检测[J].环境化学,2009,28(4):585-589.
[16]杨佳佳.离子阱串联质谱法测定土壤和沉积物中有机氯农药和多氯联苯[D].北京:中国地质科学院,2010.
[17]张伟国,明红,王勇为.气相色谱三重四极杆质谱用于农药多残留的快速分析[J].环境化学,2009,28(1):160-161.
[18]刘毅,郑国灿,王晶,等.气相色谱-串联质谱法测定牛奶中20种有机氯农药残留[J].检验检疫学刊,2012(4):38-45.
[19]沈伟健,余可垚,桂茜雯,等.分散固相萃取-气相色谱-串联质谱法测定蔬菜中107种农药的残留量[J].色谱,2009,27(4):391-400.
[20]MEDINA C M,PITARCH E,PORTOL S T,et al.GC-MSMS multi-residue method for the determination of organochlorine pesticides,polychlorinated biphenyls and polybrominated diphenyl ethers in human breast tissues[J].Journal of Separation Science,2009,32(12):2090-2102.
[21]王树槐.串联四极杆和离子阱质谱仪的性能与用途比较[J].中国兽药杂志,2004,47(12):52-53.
[22]ESPADA M C P,FRENICH A G,VIDAL J L M,et al.Comparative study using ECD,NPD,and MSMS chromatographic techniques in the determination of pesticides in wetland waters[J].Analytical Letters,2001,34(4):597-614.
[23]SANDRA P,BELTRAN J,DAVID F.Enhanced selectivity in the determination of trianzines in environmental samples by Benchtop CGC-MS-MS[J].Journal of High Resolution Chromatography,1995,18(9):545-550.
[24]郑亚辉.串联质谱技术在食品安全分析中的应用[J].现代科学仪器,2006(1):32-35.
[25]ARREBOLA F J,MARTINEZ VIDAL J L,MATEU-S NCHEZ M,et al.Determination of 81 multiclass pesticides in fresh foodstuffs by a single injection analysis using gas chromatography-chemical ionization and electron ionization tandem mass spectrometry[J].Analytica Chimica Acta,2003,484(2):167-180.
[26]GON ALVES C,ALPENDURADA M F.Solid-phase micro-extraction-gas chromatography-(tandem) mass spectrometry as a tool for pesticide residue analysis in water samples at high sensitivity and selectivity with confirmation capabilities[J].Journal of Chromatography A,2004,1026(12):239-250.
[27]贾丽娟,邓芸芸.气相色谱-串联质谱法测定土壤中的有机氯农药[J].色谱,2008(6):697-703.
[28]陈其煌,朱曼洁,康燕玉,等.气相色谱-离子阱-多级质谱法测定土壤中14种有机氯农药[J].环境化学,2012,31(8):1289-1290.
[29]GARRIDO-FRENICH A,ROMERO-GONZ LEZ R,MART NEZ-VIDAL J L,et al.Characterization of recovery profiles using gas chromatography-triple quadrupole mass spectrometry for the determination of pesticide residues in meat samples[J].Journal of Chromatography A,2006,1133(12):315-321.
[30]CHUNG S W C,CHEN B L S.Determination of organochlorine pesticide residues in fatty foods:a critical review on the analytical methods and their testing capabilities[J].Journal of Chromatography A,2011,1218(33):5555-5567.
[31]US EPA.Method 3630C silica gel cleanup[EBOL].(1996-12-20)[2012-11-01].http:www.epa.govwasteshazardtestmethodssw846pdfs3630c.pdf.
[32]US EPA.Method 3610B,alumina cleanup[EBOL].[2012-11-01].http:www.epa.govwasteshazardtestmethodssw846pdfs3610b.pdf.
[33]GUO J,WU F,LUO X,et al.Anthropogenic input of polycyclic aromatic hydrocarbons into five lakes in Western China[J].Environmental Pollution,2010,158(6):2175-2180.
[34]US EPA.Sw-864 test method for evaluating solid waste[S].3rd ed.Washington DC:US EPA,1986.
[35]林峥,麦碧娴,傅家谟,等.沉积物中多环芳烃和有机氯农药定量分析的质量保证和质量控制[J].环境化学,1999,18(2):115-121.
[36]CURIE L A.Nomenclature in evaluation of analytical methods including detection and quantification capabilities (IUPAC recommendations) [J].Pure Appl Chem,1995,67:1699-1723. ▷
DeterminationofOrganochlorinePesticidesResiduesinLakeSedimentbyUsingGasChromatography-(Tandem)MassSpectrometry
LI Chao-can1,2, HUO Shou-liang2, XI Bei-dou2
1.Shenyang Aerospace University, Shenyang 110136, China
2.China Research Academy of Environmental Sciences, Beijing 100012, China
A sohxlet- extraction- gas chromatography-(tandem) mass spectrometry (GC-MSMS) as a tool for 20 organochlorine pesticides residue analysis in lake sediment was developed. Chromatographic column of silica gel and alumina was employed to remove impurities in the concentrated extraction by different ratios of hexane and dichloromethane eluents. Then the concentrated eluent was analyzed by the gas chromatography-(tandem) mass spectrometry. The matrix interferences were eliminated owing to Multiple Reaction Monitoring (MRM) mode of GC-MSMS together with the Chromatographic column of VF-1071. The pretreatment was simplified and accurately qualitative and quantitative analysis of the target compounds was supplied. This method was of high sensitivity and showed a good linearity. Recoveries obtained by analyzing the spiked standard in matrix were in the range of 79.76%-115.04%, whereas the relative standard deviation (RSD) values were ranging from 1.15% to 14.08%. The method detection limit was between 0.002 4 and 0.513 7 μgkg and limits of quantification of the method were between 0.007 and 1.541 μgkg. This new method is stable and reliable for trace analysis of organochlorine pesticides residues in the sediment.
gas chromatography-(tandem) mass spectrometry; organochlorine pesticides; sediment
2012-11-16
收稿日期:国家水体污染控制与治理科技重大专项(2009ZX07106-001);国家自然科学基金项目(40901248)
李超灿(1987—),女,硕士研究生,主要研究方向为污染物迁移转化,liccann@126.com
*责任作者:席北斗(1969—),男,研究员,博士,主要研究方向为流域水污染控制,xibeidou@263.net
X830.2
A
10.3969j.issn.1674-991X.2013.05.065
