低位恶性梗阻性黄疸242例介入引流治疗的预后分析
2013-10-30施海彬杨正强夏金国周春高周卫忠李麟荪
徐 川,施海彬,刘 圣,杨正强,夏金国,周春高,周卫忠,李麟荪
低位恶性梗阻性黄疸一般指壶腹周围恶性肿瘤所致的梗阻,包括胰头癌、胆总管末端癌及壶腹癌,部分起源于壶腹附近的十二指肠癌及淋巴瘤也可致低位胆道梗阻。由于此类患者获得临床诊断时往往已属中晚期,能行外科根治手术患者只有7%,而姑息性手术也仅占19%,因此,对于不能根治性切除患者,首选胆道引流术[1]。经皮穿刺介入内外引流治疗是该类患者较为常用的治疗方式,以期提高患者生存质量并为其他辅助治疗提供机会[2]。为了更加准确地评估影响该类患者生存期的相关因素,对2005年9月—2011年12月在我科接受介入治疗的242例该类患者的相关临床资料进行回顾性总结分析,冀为今后治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 临床资料 收集2005年9月—2011年12月在我科接受介入引流治疗的低位恶性梗阻性黄疸患者共242例(男124例,女 118例),年龄33~93岁(平均59岁)。患者主要临床表现为皮肤黏膜黄染、瘙痒、上腹部不适、消瘦乏力伴陶土色样粪便等。所有患者中53例经病理学证实,其余通过至少2 项影像学检查(B 超、CT、MRI)结合生化、肿瘤指标进行确诊,所有患者影像学检查证实梗阻部位位于胆总管及以下。其中术前感染44例,术前总胆红素(TBIL)为 71.3~835.7 μmol/L(平均 286.5 μmol/L),黄疸病史 5~60 d(平均 21 d)。
1.1.2 操作器械 肝脏穿刺全套(Cook公司生产),内装21 G细穿刺针、0.018英寸微导丝和预扩张3件套管。5 F的Corba或猎人头导管,0.035英寸超滑微导丝(必要时需配备交换和超硬导丝、多侧孔导管等)。8~12 F引流管(包括外引流管或内外引流管)、三通和引流袋。胆道支架多用直径8~10 mm、长度4~8 cm的国产或进口支架。根据支架输送系统的外径选择6~8 F鞘管系统,需要时准备直径6~10 mm的球囊对严重狭窄的胆道进行支架置入前的预扩张。
1.2 方法
1.2.1 操作方法 根据术前检查所示肝内胆管扩张情况与肿瘤所在部位,确定经皮胆道穿刺点,穿刺道应避开肿瘤组织。所有患者术前均行经皮肝穿刺胆管造影 (percutaneous transhepatic cholangiography,PTC),了解梗阻部位,程度及范围,然后透视下经右肝管或左肝管分支重新穿刺插管,确定进入胆管后,退出针芯,换入0.018英寸微导丝,退出穿刺针后顺导丝置入穿刺套管针,确定鞘进入胆管后即可撤出细导丝、内金属针与扩张管,证实鞘位于胆管内后,从鞘内插入0.035英寸超滑导丝,退出鞘后换成5 F造影导管,并根据造影情况及术中导丝是否顺利通过梗阻部位进入十二指肠决定手术治疗方式。术中导丝能顺利通过梗阻段进入十二指肠者并结合患者意愿及经济情况(术前向患者及家属交代清楚)优先考虑支架植入。而术前感染者则先予以外引流,待感染控制后行支架植入,导丝未能通过梗阻段则行单纯外引流。
1.2.2 分组标准 参照相关研究[3-4],恶性梗阻性黄疸中位生存期一般为6个月左右,遂将该类病例分为小于6个月组(179例)和大于等于6个月组(63例)。
1.2.3 相关因素 参考相关文献[5-6]选择性别、年龄、肿瘤类型、术前梗阻时间、术前感染、引流方式、肝功能Child-Pugh评分,血清TBIL、白蛋白、肌酐(Cr),术后TBIL下降程度以及术后是否针对肿瘤治疗作为研究参数。其中术前梗阻时间为患者出现黄疸症状至接受介入引流手术之间的天数;术前感染以术前1周内患者有寒战高热伴或不伴腹痛、黄疸、外周血WBC>10.0×109/L、中性粒细胞比率 >0.75,结合血、胆汁培养确定诊断,并排除其他原因引起的感染;引流方式分为外引流、支架内引流和外引流+支架双引流;TBIL和Cr水平选择术前1 d检查为标准,并根据张学强等[5]报道,TBIL以300μmol/L、Cr以115 μmol/L为界;术后 TBIL下降程度依据术后1周和术前检查相比较,低于25%或升高为无效组;术后抗肿瘤治疗可根据患者肝功能恢复情况和体质状况行局部动脉内灌注化疗栓塞术。
1.2.4 术后处理及随访 所有患者术后予以保肝、抗炎等支持治疗。并通过复查病例记录、门诊或电话进行随访,随访时间由介入引流时间至患者死亡或2012年8月31日末次随访时间。
1.3 统计学方法
运用SPASS13.0统计软件行统计学分析,先行χ2检验单因素分析,在此基础上对有统计学差异的参数行多因素Logistic回归分析,设定P<0.05为差异有统计学意义。
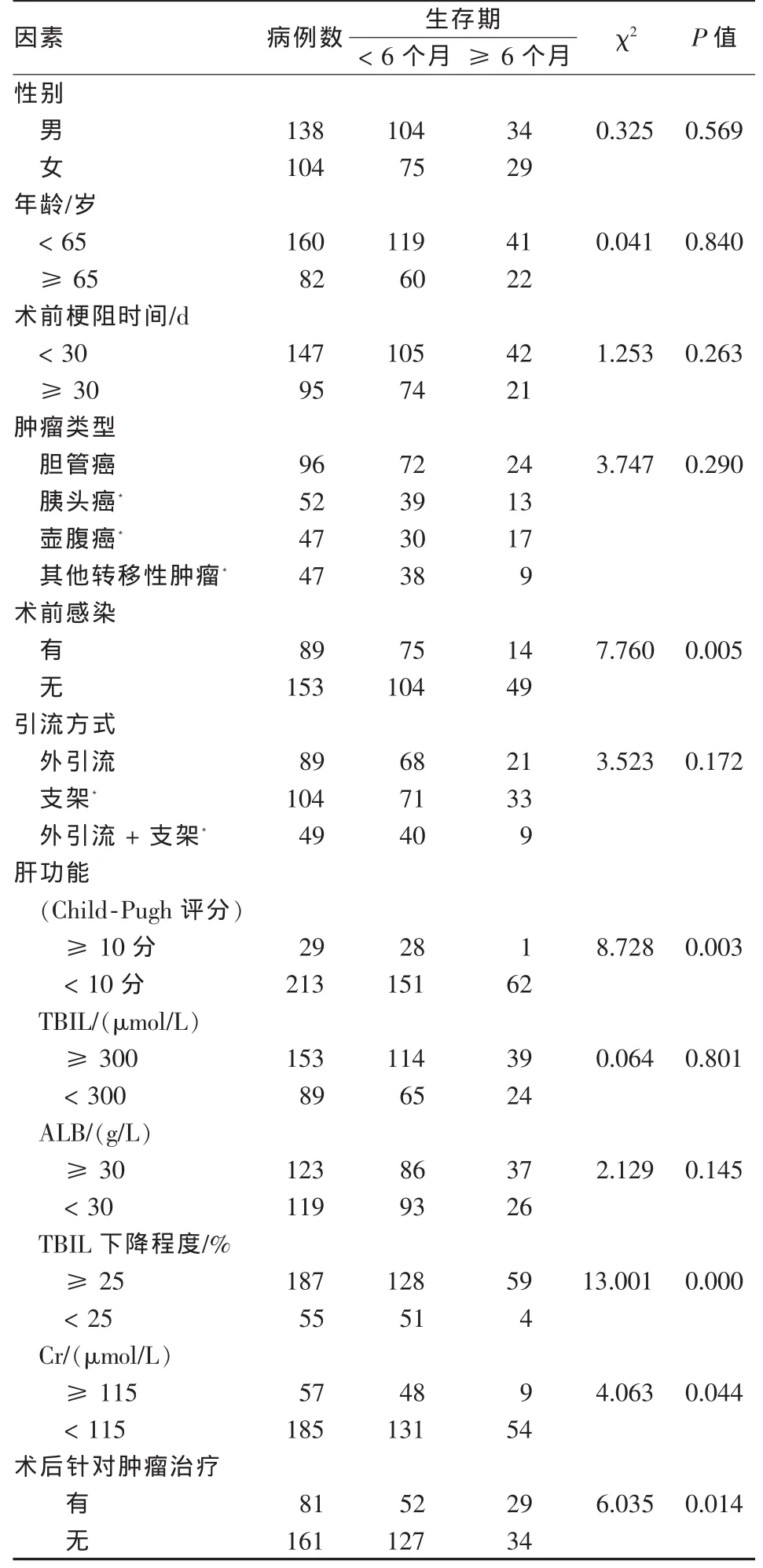
表1 低位恶性梗阻性黄疸患者长期预后的单因素分析
2 结果
242例低位恶性梗阻性黄疸患者中术前感染89例,6个月生存率为15.7%(14/89),远低于未感染者32.0%(49/153,P=0.005)。 其中感染控制 67例,感染未控制22例,1个月内因感染未控制发生败血症、多器官功能衰竭等并发症死亡17例。介入引流术后根据患者意愿及肝肾功能恢复情况,有81例患者针对局部肿瘤行动脉内灌注化疗术,其中69例患者行2次或2次以上灌注化疗,接受抗肿瘤治疗的患者6个月生存率为35.8%(29/81),明显高于未接受抗肿瘤治疗者的21.1%(34/161,P=0.014)。
2.1 影响生存期的单因素分析
对两组患者的所有相关因素进行χ2检验,结果显示术前感染、肝功能Child-Pugh评分,血清Cr、TBIL的下降程度及术后抗肿瘤治疗5个因素是影响低位恶性梗阻性黄疸患者生存期的相关因素(表 1)。
2.2 影响生存期的多因素分析
以P=0.2为标准,将性别和年龄调整,剔除肿瘤类型、术前梗阻时间、引流方式、术前血清TBIL水平、术前血清ALB水平后,把性别、年龄、术前感染、肝功能Child-Pugh评分、Cr、TBIL的下降程度及术后抗肿瘤治疗纳入多因素Logistic回归分析,结果显示:术前感染、肝功能Child-Pugh评分≥10分及术后未行抗肿瘤治疗是影响低位恶性梗阻性黄疸患者生存期的危险因素(表2)。
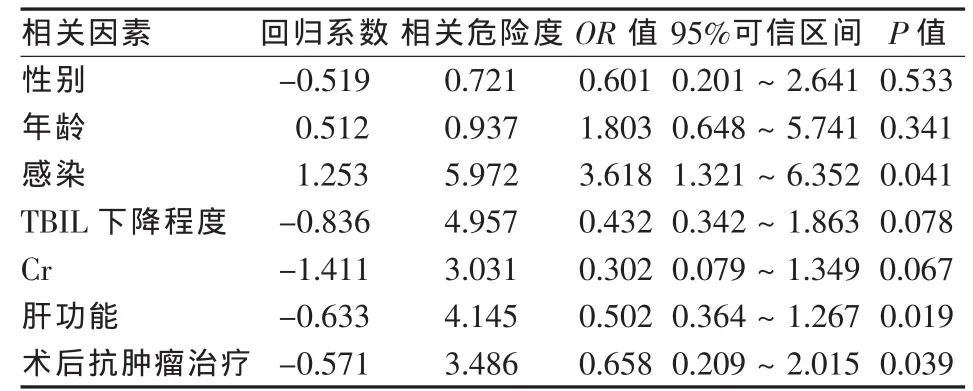
表2 低位恶性梗阻性黄疸患者长期预后多因素Logistic回归分析
3 讨论
低位恶性梗阻性黄疸患者诊断明确时多为晚期,大多已失去手术机会,近年来介入引流术治疗低位恶性梗阻性黄疸越来越多,对因低位胆管梗阻引起的肝功能损害,行胆汁引流术可明显改善肝功能、缓解临床症状,延长生存期、提高生存质量[7]。对于影响恶性梗阻性黄疸预后的相关因素,我们之前的研究表明,梗阻部位位于肝总管以上、肝功能Child-Pugh评分≥10分、仅接受1次介入引流治疗及术后未行抗肿瘤治疗,是影响高位恶性梗阻性黄疸长期预后的危险因素[8]。更早期的研究认为介入联合局部抗肿瘤治疗的双途径治疗可明显延长患者的生存期[3]。 周猛等[9]认为术前胆红素水平是影响患者生存期的独立危险因素,而梗阻类型、引流方式、术后是否化疗不是影响其预后的独立危险因素。本研究发现,TBIL下降程度、Cr单因素分析有统计学意义,而多因素分析无相关性;多因素分析显示术前感染、肝功能Child-Pugh评分 ≥10分及术后未行抗肿瘤治疗是影响低位恶性梗阻性黄疸生存期的危险因素。
胆道感染是梗阻性黄疸常见的并发症之一,之前的报道中,恶性梗阻性黄疸的感染发生率高达30%~50%[10],感染是导致患者围手术期死亡的重要原因。胆道梗阻引起的胆汁淤积,有利于细菌繁殖,而高TBIL血症易引起肠道菌群,肠黏膜屏障损伤和细菌易位。于平等[6]分析206例恶性梗阻性黄疸患者,术前合并胆道感染85例,分析认为感染组肝功能恢复、TBIL下降较无感染组明显延缓,病死率明显高于未感染组。结合本研究,术前感染89例,术后6个月仅15例存活,生存率仅为16.8%,而未感染者6个月生存率为32.1%,两者比较差异有统计学意义,与上述研究相符。由于梗阻性黄疸患者的体质较弱,机体免疫功能差,进一步增加了感染可能,术前合并感染患者术前术后积极予以抗感染治疗,可提高远期生存率[11]。
梗阻性黄疸患者最明显的生化指标是直接胆红素(DBIL)升高,高TBIL血症不仅损伤肝细胞,降低肝脏合成能力,而且对心血管系统有抑制作用,严重者导致肝肾功能不全[12]。本研究TBIL水平高低对患者远期生存期未见明显差异,而TBIL下降程度单因素分析有统计学意义,因此尽早解除梗阻、引流胆汁、降低TBIL显得更为重要;而多因素分析未有统计学意义,可能是由于干扰变量肝功能Child-Pugh分级的出现消弱了DBIL的意义。该研究中肝功能Child-Pugh分级达C级的患者为29例,其生存期大于6个月者仅1例,其中有13例术后1个月因肝功能衰竭死亡。考虑肝功能严重受损者一般手术耐受性较差,且术后并发症较多,易发生感染及肝功能衰竭[12]。 对比我们之前的研究[3],针对恶性梗阻性黄疸术后对梗阻部位的肿瘤行局部治疗能明显延长再梗阻时间及患者的生存时间,本研究中术后行针对肿瘤的治疗远期预后优于未行抗肿瘤治疗的患者。局部抗肿瘤治疗可在一定程度上抑制局部肿瘤的生长,有限延长生存时间[3-4]。因此,介入引流术后,根据患者肝功能的恢复程度及患者体质状况,积极行局部抗肿瘤治疗,可有限延长患者生存时间。
综上所述,采用经皮介入引流治疗低位恶性梗阻性黄疸患者时,术前感染、肝功能Child-Pugh评分≥10分及术后未行抗肿瘤治疗患者的生存期较短,是影响肝门部胆管癌致梗阻性黄疸长期预后的危险因素,对术前评估该类患者的预后及手术方案的选择有一定参考意义。但因为本研究是单中心的回顾性分析,且病例数量有限,其临床价值还有待进一步验证。
[1]窦科峰,上官建营.恶性肿瘤梗阻性黄疸的治疗策略[J].腹部外科,2009,22:324-326.
[2]Khan SA,Taylor-Robinson SD,Toledano MB,et al.Changing international trends in mortality rates for liver,biliary and pancreatic tumours[J].Hepatology,2002,37: 806-813.
[3]施海彬,刘 圣,冯耀良,等.双途径介入治疗原发性肝癌合并梗阻性黄疸[J].介入放射学杂志,2003,12:352-354.
[4]Xiao-Jun Qian,Ren-You Zhai,Ding-Ke Dai,et al.Treatment ofmalignantbiliaryobstruction by combined percutaneous transhepatic biliary drainage with local tumor treatment [J].World J Gastroenterol,2006,12: 331-335.
[5]张学强,翟仁友.恶性梗阻性黄疸介入治疗短期预后的多因素分析[J].介入放射学杂志,2009,18: 846-849.
[6]于 平,戴定可,钱晓军,等.胆管引流或支架置入术后感染的临床分析与处理[J].介入放射学杂志,2007,16:693-695.
[7]苏亚文,江 涛.低位胆道恶性梗阻性黄疸患行十二指肠切除术术前减黄的临床价值分析 [J].中国综合临床,2011,7:747-750.
[8]徐 川,施海彬,刘 圣,等.肝门部胆管癌致梗阻性黄疸介入引流治疗的预后分析[J].介入放射学杂志,2012,21,21:752-755.
[9]周 猛,菅志远,沈先锋,等.无法手术切除的肝门部胆管癌患者的预后分析[J].肝胆外科杂志,2011,19:58-60.
[10] Suk KT,Kim HS,Kim JW,et al.Risk factors for cholecystitis after meyl stent placement in malignant biliary obstruction [J].Gastrointest Endosc,2006,64: 522-529.
[11] Yu Li Sol,Chang Won Kim,Ung Bae Jeon,et al.Early Infectious Complications of Percutaneous metallic Stent Insertion for maliganant Biliary Obstruction [J].Vasc Intervent Radiol,2010,194: 261-265.
[12] DA Westwood,C Fernando,Sj Connor.internal and external percutaneous transhepatic billary drainage for malignant biliary obstruction: a retrospective analysis[J].J Med Imaging Radiat Oncol,2010,54: 108-110.
