丹酚酸B体外诱导MSCs向心肌细胞分化中β-catenin表达的实验研究*
2013-10-28胡先同范英昌
季 红,高 青,胡先同,范英昌
(天津中医药大学中医学院,天津 300193)
心肌梗死后心肌细胞损失并缺少内生修复机制是导致心力衰竭的主要原因,通常认为心肌细胞是终末分化细胞,成体心肌细胞本质上不具有修复能力,因此损伤的心肌由纤维疤痕取代,继而出现病理性心室重构最终导致心室功能丧失,而干细胞移植通过取代梗死心肌细胞成为治疗心肌梗死的最具前景的方法之一。
骨髓间充质干细胞(MSCs)由于其体外易于分离、扩增,遗传稳定性,对多种重要组织有增强修复的潜能等优点,可能成起目前细胞治疗首选的干细胞模型。Friedenstei在1966年首次报道了MSCs的存在,并将其称为骨形成前体细胞[1]。MSCs可在体外克隆扩增超过100万倍仍保留多向分体的能力[2-4]。MSCs仅占有核细胞的0.001%~0.01%,较造血干细胞少约10倍[5-6]。研究证明MSCs在体内外均可分化为肌细胞、成骨细胞、成软骨细胞、脂肪细胞、成纤维细抱、内皮细胞、神经细胞等多种细胞,并可在体外克隆扩增超过100万倍仍然保留多系分化能力[7-11]。
MSCs自我更新的调控机制目前尚不清楚,现已发现多条信号通路控制着MSCs不同的分化方向和途径,如丝裂素活化蛋白激酶(MAPK)[12-14]通路、转化生长因子-β(TGF-β)超家族与Smad信号通路[15-16]、Wnt信号通路[17-19]等,近年来对 Wnt信号通路的研究逐渐成为热点。
本研究在体外分离、扩增MSCs,并用丹酚酸B诱导MSCs向心肌细胞分化,通过检测Wnt信号通路中关键物质糖原合成激酶(GSK)-3β和βcatenin的浓度变化以阐明Wnt信号通路在MSCs向心肌细胞的分化中所起的作用。
1 材料
1.1 动物 清洁级Wistar雄性大鼠,体质量(200±20)g。(购于中国医学科学院放射医学研究所实验动物中心,动物许可证号:scxk2005-0001)。
1.2 主要试剂与仪器 丹酚酸B(Salvianolic acid B标准品,纯度99%,Sigma公司);L-DMEM培养液(Low glucose-Dulbecco’s-modified Eagle’s medium,美国GIBCO公司);特级胎牛血清(FBS,以色列BioInd公司);胰蛋白酶(1∶250,美国Hyclone公司);乙二胺四乙酸(EDTA,天象人生物技术研究所);青霉素、链霉素(美国 Hyclone公司);D-Hanks缓冲液[氯化钠(NaCl)、氯化钾(KCl)、磷酸氢二钠(Na2HPO4)、磷酸二氢钾 (KH2PO4)、氢氧化钠(NaOH)、碳酸氢钠(NaHCO3),苯酚红,南京化学试剂厂];CD44兔多克隆抗体、CD34兔多克隆抗体(HCAM)、甘油醛-3-磷酸脱氢酶(GAPDH)、心肌肌钙蛋白 T(cTnT)、GSK、β-catenin引物由生工生物工程(上海)有限公司合成,即用型SABC免疫组化染色试剂盒,DAB显色试剂AR1025,均由武汉博士德生物工程有限公司提供;DNA/RNA/Protein Isolation Kit (OMEGA)。 TaqMan Reverse Transcription Reagents试剂盒(DRR014A,宝生生物公 司)、SYBR Green PCR MasterMix reagent kit(Applied Biosystems公司)。
2 方法
2.1 MSCs的分离培养、纯化及鉴定 取雄性Wistar大鼠,颈椎脱臼处死,无菌条件下取双侧股骨、胫骨,适量D-Hank’s液冲洗骨髓,100目筛网过滤,以(0.1~2)×106个/L 的密度接种于完全培养液(L-DMEM含体积分数为10%胎牛血清、100 mg/L青霉素、100 mg/L链霉素),置于37℃、5%二氧化碳(CO2)饱和湿度的培养箱中继续培养,24 h后首次换液,去除悬浮细胞,以后隔天更换一次培养液。造血细胞、纤维细胞和其他非贴壁细胞随着换液被逐渐洗去,12~16 d后,细胞融合达80%~90%,用0.25%胰酶(含 0.01%EDTA)消化,1∶2~3传代。反复传到第3代,细胞得到纯化,形成均一、同质的细胞克隆。用链霉亲和素—生物素—过氧化物酶复合物(SABC)法检测细胞表面抗原CD44和CD34。
2.2 MSCs分组及诱导 将第3代的MSCs随机分为4个诱导组,空白对照组(0组)、5-氮胞苷组(5-aza组)、丹酚酸B组(SalB组)、5-氮胞苷联合丹酚酸B组(5-aza+SalB组)。诱导方法:对照组:MSCs仅在含10%胎牛血清的DMEM培养基中培养;5-aza组:加入10 μmol/L的5-aza,37℃避光孵育 24 h后,换新鲜的完全培养基继续培养,隔天换液;SalB组:加入16 mg/L的SalB孵育24 h后,换新鲜完全培养基继续培养,隔天换液;5-aza+SalB组:加入10 μmol/L 的 5-aza、16 mg/L 的SalB 孵育 24 h后,换新鲜的完全培养基继续培养,隔天换液;各组诱导4周。
2.3 免疫细胞化学鉴定心肌特异性蛋白cTnT 将诱导4周的细胞,按即用型SABC免疫组化染色试剂盒说明进行免疫组化染色,DAB显色5~30 min,显微镜下观察,每组随机选取8张染色的细胞爬片,于400倍光镜下每张爬片选5个不同的视野,数码相机拍摄后,用Image Pro Plus6.0软件检测免疫细胞化学染色后的细胞阳性表达率(胞浆出现棕黄色颗粒的细胞占总细胞数的百分比)。
2.4 实时荧光定量逆转录-聚合酶链反应(RTPCR)检测心肌特异性基因cTnT及Wnt/β-catenin信号通路中关键物质含量的表达 将各诱导组胰酶消化细胞,按照DNA/RNA/Protein Isolation Kit说明书,首先抽提总 RNA,取 2 μg总 RNA,按照逆转录试剂盒操作说明进行逆转录,反应体系20 μL,反应条件 25 ℃ 10 min;37 ℃ 120 min;85℃ 5 min;4℃,然后依照SYBR Green PCR MasterMix reagent kits说明书,以获得的cDNA为模版,用PCR扩增仪(ABI7500)进行实时灾光定量核酸扩增检测系统(QPCR),分别扩增 GAPDH、心肌肌钙蛋白(cTnT)、GSK-3β、β-catenin,反应体系 25μL,扩增条件:95℃预变性10min,95℃变性15秒,退火/延伸60℃1min,共40个循环。所得CT值经转换后以2-ΔΔCT相对定量法获得目的基因相对表达量数值。目的基因及内参基因引物序列见表1。
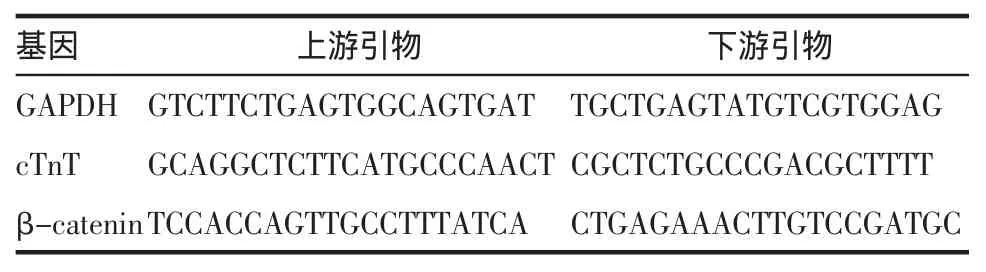
表1 QPCR目的基因及内参照基因引物序列Tab.1 Primer sequence of QPCR target gene and internal reference gene
2.5 统计学方法 应用SPSS18.5软件对数据进行统计学处理,计量数据用均数±标准差(±s)表示,两组计量资料比较采用两独立样本t检验,多组间计量比较采用单因素方差分析,P<0.05表明差异有统计学意义。
3 结果
3.1 各诱导组MSCs形态特征变化 倒置相差显微镜下,MSCs诱导前多呈纺锤形或长梭形,细胞形态较一致,呈“旋涡”样生长。药物诱导后各组细胞有大量死亡,随着时间的推移,细胞形态逐渐开始变化,形态呈梭形,长方形、柱形的细胞数量相对增多,同时细胞增殖能力减弱,细胞数量较诱导前减少。个别胞浆中可见明显颗粒状物质,部分视野可见肌丝样结构,而且细胞立体感强,折光性好。4周时细胞间发生融合,排列具有方向性,且更多视野可以观察到明显的肌丝样结构,见图1-4。
3.2 大鼠MSCs的表型特征 SABC法检测MSCs表面抗原CD44和CD34。结果显示CD44呈阳性表达,CD34呈阴性表达。见图5-6。
3.3 cTnT免疫组化结果 免疫组化结果显示,除SalB组外其余各诱导组cTnT均有一定程度的表达,各诱导组MSCs的cTnT免疫组化阳性表达率见表2。
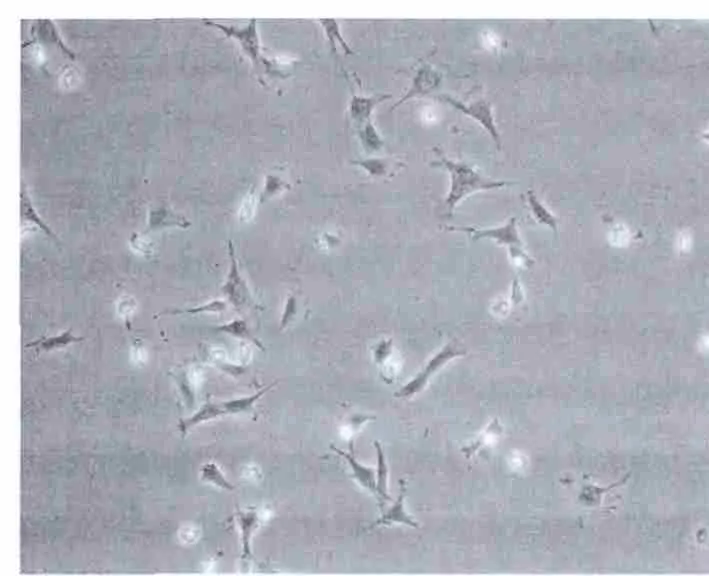
图1 MSCs原代培养4 d×100Fig.1 MSCs primary culture 4 d×100
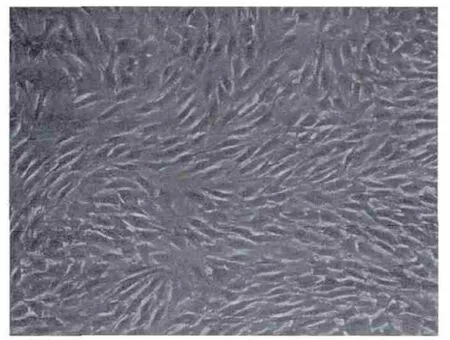
图2 MSCs原代培养12 d×100Fig.2 MSCs primary culture 12 d×100

图3 MSCs诱导10 d 5-aza组×100倍Fig.3 MSCs induction 10 d 5-aza group×100

图4 MSCs诱导10 d 5-aza+SalB组×100倍Fig.4 MSCs induction 10 d 5-aza+SalB group×100
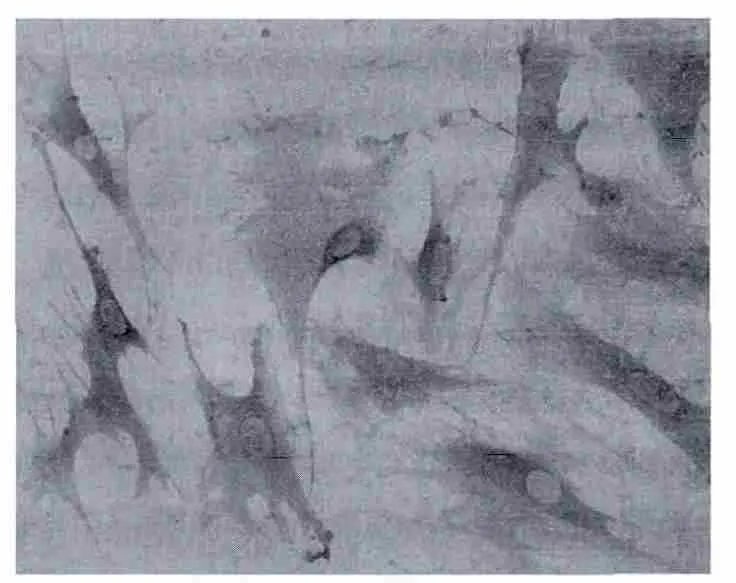
图5 MSCs CD44染色阳性×400Fig.5 MSCs CD44 staining positive×400
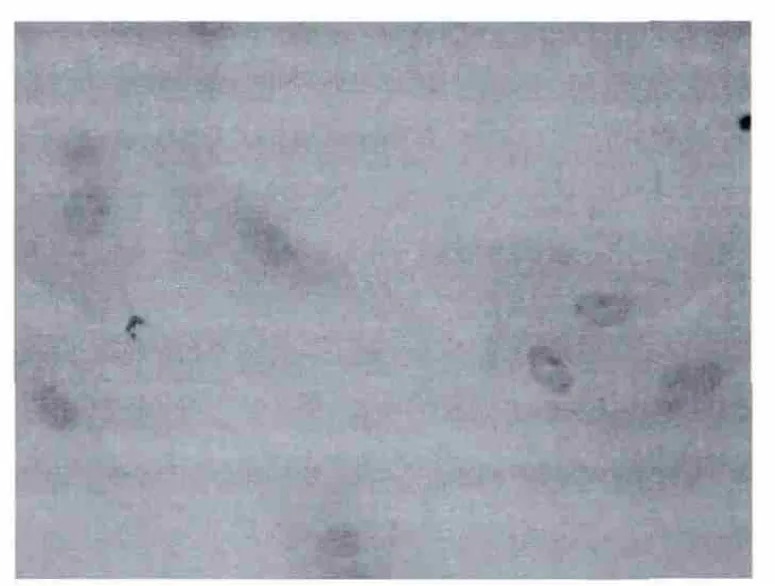
图6 MSCs CD34染色呈阴性×400Fig.6 MSCs CD34 staining negative×400
表2 各诱导组MSCs的cTnT免疫组化阳性表达率(±s)Tab.2 cTnT immunohistochemistry positive expression rate of MSCs in each induction group(±s)%
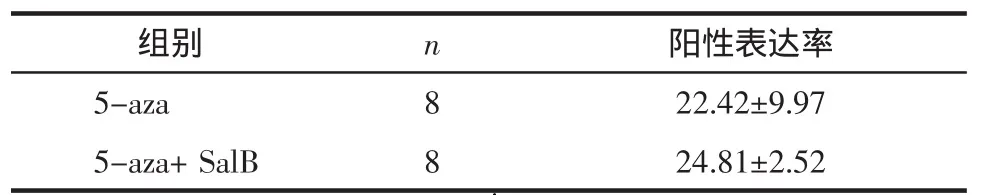
表2 各诱导组MSCs的cTnT免疫组化阳性表达率(±s)Tab.2 cTnT immunohistochemistry positive expression rate of MSCs in each induction group(±s)%
注:两组比较,P<0.05。
组别 n 阳性表达率5-aza 8 22.42±9.975-aza+SalB 8 24.81±2.52
3.4 各诱导组cTnT及Wnt信号通路中关键物质GSK-3β及β-catenin基因表达的改变 见表3。
表3 各组mRNA相对表达量的比较(±s)Tab.3 Comparison of mRNA relative transcript level in each group(±s)
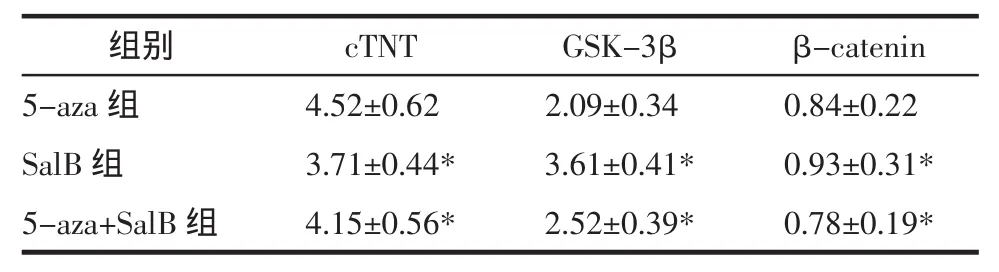
表3 各组mRNA相对表达量的比较(±s)Tab.3 Comparison of mRNA relative transcript level in each group(±s)
注:5-aza组与各组两两比较,P<0.05。
组别 cTNT GSK-3β β-catenin 5-aza组 4.52±0.62* 2.09±0.34* 0.84±0.22*SalB 组 3.71±0.44* 3.61±0.41* 0.93±0.31*5-aza+SalB 组 4.15±0.56* 2.52±0.39* 0.78±0.19*
4 讨论
MSCs是一种具有多种分化能力成体干细胞,由于其取材方便、易于体外培养扩增,而且免疫原性也较低[20],对组织损伤小。而成为基因治疗、组织修复等方面的研究热点,对MSCs的分离、纯化、培养还没有统一的方法,目前主要有4种方法即贴壁法、密度梯度离心法、流式细胞仪分离法和免疫磁珠法[21],其中密度梯度离心法和贴壁法最为常用。研究证明,percoll分离得到的细胞较为均一,但多能分化性和增殖力不如贴壁培养的细胞,而MSC贴壁培养得到的细胞多能分化能力和增殖力好,缺点是纯度不够,但有研究表明扩增二代后的细胞纯度可达到98%,因此本实验中选取贴壁法对MSCs进行分离。根据是利用细胞贴壁时间及贴壁牢固性的不同逐步通过换液去除造血细胞,通过传代去除单核细胞和淋巴细胞,取纯度较高且增殖分化能力较强的第3代MSCs用作实验。
关于MSCs的分离和鉴定仍然没有十分特异性的标记,通常结合MSCS能够自我更新、多向分化等干细胞特性以及排除造血干细胞标记的方法进行分选和鉴定,CD44是细胞黏附分子,是MSCs的重要标志物,CD34分子是普遍认同的造血干细胞的代表性标志,MSCs高表达CD44,而不表达或弱表达CD34,本实验使用免疫细胞化学鉴定,观察到细胞染色CD44阳性,CD34呈阴性,符合文献报道。
cTnT作为心肌细胞内的一种特异性结构蛋白,参与组成细肌丝,并与心肌收缩和舒张的调节有关,cTnT仅在心肌细胞中表达,是鉴定心肌源性细胞的特异性标志物[22]。本实验采用免疫细胞化学方法检测各组cTnT阳性表达率,发现SalB组未见心肌分化,其余组均有不同程度的心肌分化,而SalB+5-aza组阳性表达率明显高于单独使用5-aza组,差异有统计学意义。RT-PCR在检测发现诱导4周后的各组MSCs表面cTnT表达明显增加,而SalB+5-aza表达略高于5-aza,但差异无统计学意义。进一步证明SalB协同5-aza可促进向心肌分化。可以认定成功将MSCs诱导为心肌样细胞。
Wnt/β-catenin信号通路是无脊椎动物和脊椎动物发育过程中起关键作用的信号转导通路之一,在整个进化过程中有高度的保守性。在Wnt信号缺失时,GSK-3β与结肠腺癌样息肉基因产物(APC)和轴蛋白(Axin)结合形成蛋白三体复合物,磷酸化βcatenin N基末端,使其被泛素化进而通过蛋白酶体机制[23]被破坏。当Wnt蛋白连接到Frizzled家族受体激活相关下游组件Dishevelled,可使GSK-3β失活,使β-catenin不断累积,继而进入胞核与TCF/LEF相互作用,引起靶基因的转录。调控与细胞周期有关的一系列基因的表达,因此在胞内的表达水平被认为与细胞的增殖和迁移密切相关[24-25]。
研究证明Wnt信号系统在调节细胞的黏附、形态、增殖、迁移及结构修复均起着重要的作用[26-28]。一般认为Wnt信号可以通过非经典通路促进BMSCs向心肌细胞分化[29-30],近年来的研究表明,经典Wnt信号通路在心肌形成初期被激活,并在心肌分化过程中发挥着至关重要的作用。Zelarayan L等发现Wnt/β-catenin通路在间充质细胞向心肌分化早期被激活,然而心肌细胞后期的分化却需要下调βcatenin[31]。TeruyaNakamura等也发现Wnt/β-catenin信号通路在P19CL6细胞向心肌分化早期中被激活[32]。因此有人提出,Wnt经典信号传导对心脏的形成和分化也不是单一的抑制作用,而是表现为双向作用,早期为促进作用,晚期为抑制作用。笔者将诱导4周后的MSCs,用RT-PCR方法检测了Wnt信号通路中两个关键信号分子GSK-3β和β-catenin的表达,结果显示MSCs诱导后,GSK-3β表达上调,β-catenin的表达有所下调,说明在其向心肌细胞分化后期中经典的信号通路受到抑制。本研究的结果进一步论证了这种说法。
[1]Friedenstein AJ,Piatetzky-Shapiro II,Petrakova KV.Osteogenesis in transplants of bone marrow cells[J].J Embryol Exp Morphol,1966,16:381-390.
[2]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284:143-147.
[3]Muraglia A,Cancedda R,Quarto R.Clonal mesenchymal progenitors from human bone marrow differentiate in vitro according to a hierarchical model[J].J Cell Sci.,2000,113:1161-1166.
[4]Sottile V,Halleux C,Bassilana F,et al.Stem cell characteristics of human trabecular bone-derived cells[J].Bone,2002,30:699-704.
[5]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284:143-147.
[6]Le Blanc K,Pittenger M.Mesenchymal stem cells:progress towardpromise[J].Cytotherapy,2005,7:36-45.
[7]Bruder SP,Jaiswa1 N,Haynesworth SE.Growth kintics,self-renewal,and the osteogenic potential of purified human mesenchmal stem cells during extensive s ubeultivation and following cryopreserv ation[J].J CellBioehem,1997,64(2):278-94.
[8]Ferrari G,Coletta M,Paolucci E,et al.Musele regeneration by bone marrow-derived myogenic pogenitors[J].Seience,1998,279:1528.
[9]Roekop DJ.Marrow stromal cells as stem cells for nonhematopetic tissues[J].Science,1997,276(5309):71-74.
[10]Sanehez-Ramos J,Song S,Cardozo-pelaze F,et al.Adult bone Marrow stromal eells differentiatein to neuraleells in vitro[J].Exp Neurol,2000,164(2):247.
[11]Nuttall ME,Patton AJ,Olivera DL,et al.Human trabecular bone Cells are able to express both osteoblastic and adipocytic phenype:implications for osteogenic disorders[J].J Bone Miner Res,1998,13(3):371.
[12]Ward DF,Salasznyk RM,Klees RF,et al.Mechanical strain enhances extracellular matrix-induced gene focusing and promotes osteogenic differentiation of human mesenchymal stem cells through an extracellular-related kinase-dependent pathway[J].Stem Cells Dev,2007,16(3):467-480.
[13]Asiwal RK,Jaiswal N.Adult human mesenchymal stem cell differentiation to the osteogenic or adipogenic lineage is regulated by mitogen-activated protein kinase[J].Bionl Chem,2000,275(13):9645-9652.
[14]Kanno T,Takahashi T,Tsujisawa T,et al.Mechanical stressmediated Runx activation is dependent on Ras/ERK1/2 MAPK signaling in osteoblasts[J].Cell Biochem,2007,101(5):1266-1277.
[15]Attisano L,Wrana JL.Signal transduction by the TGF-beta superfamil[J].Science,2002,296(5573):1646-1647.
[16]ZhouS,EidK,Glowacki J,et al.Cooperation between TGF-βand Wnt pathways during chondrocyte and adipocyte differtiation of human marrow stromal cells[J].Bone Miner Res,2004,19(3):463-470.
[17]Ke Z,Zhou F,Wang L,et al.Down-regulation of Wnt signaling could promote bone marrow derived mesenchymal stem cells to differentiate into hepatocytes[J].Biochem Biophys Res Commun,2008,367(2):342-348.
[18]Jaeyeaon Cho,Rameshwar,Pranela et al.Distinct Roles of Glycogen SynthaseKinase(GSK)-3αandGSK-3βin Mediating Cardiomyocyte Differentiation in Murine Bone Marrow-derived Mesenchymal Stem Cells[J].Journal of Biological Chemistry,2009,284(52):36647-36658.
[19]GuoW,FlanaganJ,Jasuja R,et al.The effects of myostatin on adipogenic differentiation ofhuman bone marrow -derived mesenchymal stem cells are mediated through cross-communication between Smad3 and Wnt/beta-catenin signaling pathways[J].BiolChem,2008,283(14):9136-9145.
[20]庄淑波,刘 毅,陈克明,等.大鼠骨髓间充质干细胞体外分离、纯化与培养适宜条件的筛选 [J].中国组织工程研究与临床康复,2007,11(20):3886-3891.
[21]黄华艺,农朝赞,查锡良.新癌基因β-catenin研究进展[J].中华消化杂志,2002,22(8):497-498.
[22]朱 辉.心肌肌钙蛋白的研究和应用[J].实用医技杂志,2008,14(15):1900-1902.
[23]Mao W,Wordinger RJ,Clark AF.Functional analysis of disease-as sociated polymorphism LRP5[J].Mol Vis,2011,17:894-902.
[24]MariaOM,KllosraviR MezeyE,et al.Cells from bone marrow that evolve into oral tissues and their clinical applications[J].OralDis,2007,13(l):11-16.
[25]GmubinerBM.Careinogneesis:abalnaeebewteenb-eateninnadAPC[J].CurrBiol,1997,(7):R443-R446.
[26]Reya T,Clevers H.Wnt signaling in stem cells and cancer[J].Nature,2005,434:843-850.
[27]Bejsovec A.Wnt pathway activation:new relations and locations[J].Cell,2005,120:11-14.
[28]Charron F,Tessier-Lavigne M.Novel brain wiring functions for classical morphogens:a role as graded positional cues in axon guidance[J].Development,2005,132:2251-2262.
[29]Belema-Bedada F,Technau A,Ebelt H et al.Activation of myogenic differentiation pathways in adult bone marrow-derived stem cells[J].Mol Cell Biol,2005,25(21):9509-9519.
[30]Schulze M,Belema-Bedada F,Technau A,et al.Mesenchymal stem cells are recruited to striated muscle by NFAT/IL-4-mediated cell fusion[J].Genes Dev,2005,19(15):1787-1798.
[31]Zelarayan L,Gehrke C,Bergmann MW.Role of β-catenin in adult cardiac remodeling[J].Cell Cycle,2007,6(17):2120-2126.
[32]Teruya Nakamura,Motoaki Sano,Zhou Songyang,et al.A Wnt-and β-catenin-dependent pathway for mammalian cardiac myogenesis[J].PNAS,2003,100(10),5834-5839.