不同性别大鼠局灶性脑缺血脑血流及梗死体积的变化
2013-10-25刘向荣赵海苹王荣亮吉训明赵咏梅罗玉敏
闫 峰 刘向荣 赵海苹 王荣亮 吉训明 赵咏梅 陶 真 罗玉敏
(首都医科大学宣武医院脑血管病研究室北京市老年病医疗研究中心,北京 100053)
脑血管病(cerebrovascular disease,CVD)是目前导致人类死亡的三大主要疾病之一,其高发病率、高病死率给社会和家庭带来沉重的负担。脑卒中是大脑供血障碍,如血栓或外伤等引起的局限或全面性脑功能缺损综合征。大量长期的临床调查[1]表明:绝经前妇女卒中的发病率较同年龄段的男性低,且缺血损伤程度也较轻,绝经后妇女卒中的发病率则显著增高。上述研究提示体内高雌激素水平可能与脑卒中发生有关,近年的研究[2]也显示,雌激素可以促进脑卒中后的神经再生。因此在脑卒中的实验研究中,为了避免雌激素对卒中的影响,通常采用健康的雄性大鼠。另外在脑卒中的研究中还经常采用去卵巢雌性大鼠,绝经雌性大鼠,或者雄性大鼠作为研究对象,进行长期(2~7 d)生理或高剂量雌激素替代治疗观察雌激素对卒中损伤的保护作用。但正常的生理激素水平下,同等程度损伤下,性别因素对卒中的影响,特别是缺血再灌短期内(如24 h)性别因素是否对卒中产生影响这一问题,对动物模型性别的选择具有指导意义。因此本研究探讨了在正常生理激素条件下性别因素对大鼠局限性脑缺血的影响。
1 材料与方法
1.1 实验动物及分组
选用SPF级成年雌性、雄性sprague dawley(SD)大鼠,购自北京维通利华实验动物公司,实验动物许可证号:SCXK(京)2012-0001。按性别采用数字表法随机分为2组,每组12只,体质量280~310g,标准配方饲料喂养,自由进水。大鼠饲养及实验均在本院SPF级实验动物室内进行。
1.2 实验仪器
小动物呼吸机(Harvard Apparatus 683)、双极电凝(德威,DEVEL,ACC100)、显微镜(Carl Zeiss)、脑血流监测仪(PERIMED,PF5001)、反馈式温度调节仪(Harvard Apparatus)、精密电子天平(Adventurer)、Image-Pro Plus计算机图像分析系统(美国,Larser Sharp)、数码照相机(苏州富士胶片映象机器有限公司)、大鼠手术操作台、显微手术器械。
1.3 实验试剂
0.9%NaCl注射液、多聚甲醛、恩氟烷(Enflurane,河北九派制药)、医用耳脑型胶(广州市香雪生物医学工程有限公司),10%水合氯醛(华瑞制药)、2,3,5-氯化三苯四氮唑(TTC,伊瑞德生物技术),磷酸二氢钠及磷酸氢二钠(北京化学试剂公司)。
1.4 实验方法
1.4.1 脑血流监测
大鼠称体质量后,在4% ~5%恩氟烷、30%O2/70%N2O下诱导麻醉。约5 min后将其尾部抬起无任何张力且随重力自然落下表示诱导成功。将大鼠固定于操作台上,在手术显微镜下进行气管插管。插管成功后迅速连接动物呼吸机,在1% ~2%恩氟烷、30%O2/70%N2O下维持麻醉。头顶皮肤备皮消毒后,沿中线切开皮肤,剥离骨膜。脑血流测定点为前囟后方3 mm,中线右侧旁开5 mm处。在上述测定点以牙钻进行钻孔开窗,使用医用耳脑型胶将直径为0.5 mm的光学纤维探头固定在骨窗上,应用激光多普勒监测大鼠大脑中动脉供血区的血流量。
1.4.2 模型制备
将大鼠仰卧于手术台上,取颈部正中切口,小心分离皮下脂肪和肌肉、右侧颈总动脉(common carotid artery,CCA)、颈 外 动 脉 (external carotid artery,ECA)和颈内动脉 (internal carotid artery,ICA);分离ECA主干,钝性分离出甲状腺动脉和枕动脉,并电凝切断。在CCA分叉处远端约1cm处结扎、电灼、切断ECA,并在CCA分叉处结扎一道缝合线,不做紧密结扎。仔细分离ICA至其发出翼腭动脉(pterygopalatine artery,PPA)和入颅颈内动脉处。用微小动脉夹临时夹闭CCA和ICA,用眼科剪在ECA残端剪一个小口,插入线栓,扎紧缝合线,松开ICA动脉夹,慢慢推动线栓进入ICA,使其进入ICA入颅动脉支。线栓穿过距ICA和ECA分叉处约2.0cm有阻力感时,表明线栓已将大脑中动脉堵塞,放开CCA动脉夹。当所监测的脑血流下降至插栓前20%~40%,说明大脑中动脉的血供已阻断。MCAO2 h,再灌注24 h后处死。
1.4.3 TTC染色
用于计算脑梗死体积的大鼠再灌注24 h后,腹腔注射过量水合氯醛,深度麻醉后迅速断头取脑,观察鼠脑大体形态。0~4℃ 0.9%NaCl注射液冲洗后放入模具,去除小脑和脑干,按2 mm厚度连续做6个脑组织冠状切片,立即置20 mL·L-1TTC/磷酸盐缓冲液(phosphate buffered saline,PBS)中,37℃恒温孵育30 min,染色后置40 g·L-1多聚甲醛/PBS中固定6 h,观察脑组织切片呈色情况并拍照,后以Image-Pro Plus软件进行梗死面积测定。
1.5 统计学方法
采用SPSS 17.0软件进行统计分析。计数资料用例数和百分数表示,组间比较使用Fisher确切概率法。计量资料用均数±标准差(x ±s)表示,组间比较使用单因素方差分析方法。以P<0.05为差异有统计学意义。
2 结果
2.1 不同性别大鼠局灶性脑缺血再灌注损伤后病死率的比较
MCA阻断24 h内的大鼠病死率分别为:正常雄鼠为16.67%,正常雌鼠为8.33%。采用Fisher确切概率法进行假设检验,差异无统计学意义(P>0.05,n=12),如图1所示。
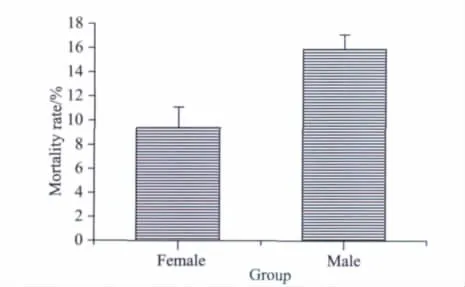
图1 MCA阻断24 h内的大鼠病死率Fig.1 The mortality rate 2 hours after MCAO and 24 hours reperfusion
2.2 不同性别大鼠脑梗死体积的比较
大鼠MCAO 2 h,再灌注24 h后,处死大鼠,TTC染色检测脑梗死体积。雌雄2组相比差异有统计学意义,雌性大鼠脑梗死体积明显小于雄性对照组,且差异有统计学意义(P<0.05),如图2所示。
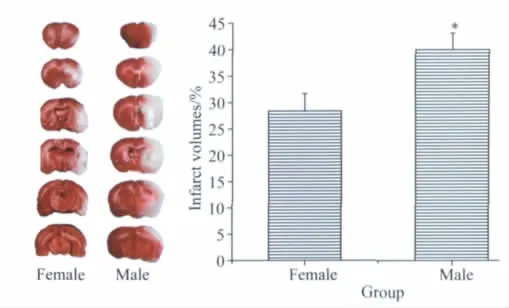
图2 MCAO2 h,再灌注24 h脑梗死面积比较Fig.2 The infarct volumes 2 hours after MCAO and 24 hours reperfusion
2.3 不同性别大鼠脑血流的比较
脑血流监测基础值雌性为(154±20)PU,雄性为(212±24)PU,雌性显著低于雄性(P<0.01);线栓插入后,雌性为(48±3)PU,雄性为(78±21)PU,雌性显著低于雄性(P<0.05),下降百分比雌性为(68±4)%,雄性为(63±12)%,差异无统计学意义(P>0.05,n=12);拔栓后脑血流雌性为(159±5)PU,雄性为(196±36)PU,恢复百分比雌性为(104±11)%,雄性为(91±14)%,差异无统计学意义(P>0.05,n=12),详见图3、4。

图3 手术过程中大鼠脑血流变化Fig.3 Changes of the brain blood flow in operation
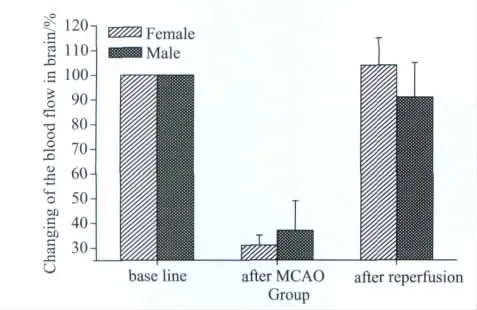
图4 手术过程中大鼠脑血流变化Fig.4 Changes of the brain blood flow in operation
3 讨论
缺血性脑血管病是目前严重危害人类健康的主要疾病之一。在我国,随着老龄化人口增加,缺血性脑血管病发病率也在不断提高。临床资料[2]表明,在缺血性脑卒中患者中,男性和绝经后女性脑损伤程度比绝经前女性严重,绝经期前的女性比同龄男性的卒中发生率低,因此推测雌激素对脑缺血有一定的保护作用。Kooperberg等[3]做了一个样本数为27 347人的绝经后女性的病例对照研究,证实经雌孕激素治疗的确可以降低绝经后女性的卒中风险。Lisabeth等[4]做了一个样本数为1 430人的前瞻性研究,将女性的自然绝经年龄分为<42岁42岁~54岁>54岁3组,结果显示过早绝经的妇女组(绝经年龄<42岁)和其他两组相比发生缺血性脑卒中的风险增加2倍。以上的研究再一次印证了雌激素对脑缺血有一定的保护作用。
进一步的动物实验发现,缺血性脑损伤的程度与动物的种类和性别有关。Alkyaed等[5]在大鼠的大脑中动脉阻塞模型中发现大脑的受损程度存在着性别差异,雌鼠的脑梗死面积显著小于同龄雄鼠,并且这种差异随着雌鼠卵巢的切除而消失。这些研究结果在不同品系的大鼠和自发性高血压大鼠的研究中亦得到证实。这表明内源性雌激素与缺血性脑损伤的发生以及所造成神经组织损伤的严重程度密切相关。Simpkins等[6]采用切除雌性SD大鼠卵巢后MCAO模型,首次证实补充外源性雌激素能明显降低急性缺血性卒中的发生率和24 h的病死率,并能缩小梗死面积。Toung等[7]给予雄性大鼠长期应用或即刻给予雌激素预处理后,发现均能减轻MCAO后的神经组织损伤,呈现明显的脑保护作用。这些研究表明,外源性雌激素对两性大鼠的缺血性脑损伤都有明显影响。此后,又有不少学者[8-11]在不同的缺血模型使用不同剂量及剂型的雌激素均发现了雌激素能减轻缺血性脑损伤。
另外还有学者[12]对雌激素对缺血区脑血流量的影响进行研究。采用大鼠的脑缺血模型,应用雌激素治疗和安慰剂对比结果显示雌激素干预可使脑梗死周边的新生血管密度增加20%,增加了脑血液灌注。此外在半球缺血动物模型上,长期使用雌激素治疗可以增加缺血区的残余血量[13]。
Vitale等[14]对134名绝经后的女性给予雌激素口服治疗,通过高频超声检测肱动脉内皮依赖性舒张功能,研究显示经过5年的雌激素治疗后和从未用过雌激素治疗的女性相比,血管的扩张能力明显改善,经治疗后血管表现出更好的弹性,更有利于血液在脑血管中的灌注。
本实验在生理水平上探讨了性别对局灶性大鼠脑缺血模型脑血流及梗死体积的影响。在对大鼠进行MCAO术中全程监测大脑中动脉灌注区域脑血流,记录梗死前脑血流的基础值,插栓后脑血流的下降值及拔栓后脑血流的恢复值,从而进一步比较雌雄两组之间的差异。正常生理条件下,雌性大鼠脑血流基础值显著低于雄性,单侧MCAO缺血再灌过程中,虽然雌雄两组脑血流和各自基础值相比下降和恢复的程度差异无统计学意义,但雌性再灌注后脑血流量较基础值的恢复要优于雄性。此结果可能是由于雌激素可以改变血管的状态,增加了一部分血流量,另外Dhandapani等[15]用雌二醇处理大鼠脑皮质的星形胶质细胞6 h至36 h发现可诱导释放转化生长因子,而转化生长因子的增加在脑缺血时有保护作用,推测雌激素可以通过刺激星形胶质细胞转化生长因子途径在缺血性卒中时起到神经保护作用。这虽然与脑血流恢复百分比差异无统计学意义,但最终的梗死体积差异却有统计学意义。另外,我们还推测雌性大鼠脑血流基础值较雄性基础值更低的状态可能提高其对缺血再灌注损伤的耐受性。综上,我们推测性别因素中除了雌激素外,脑血流的差异也可能是导致脑梗死面积统计中雌性大鼠显著低于雄性大鼠的原因。另有报道[16]称雄激素亦具有神经保护作用。但雌激素具有周期性,在实验过程中,实验人员无法准确计算雌激素水平,这就为雌性动物应用于脑血管病动物模型造成了一定的困难,不利于模型的稳定,而雄激素的周期性并不明显,对其他生理指标的影响也并不显著,故雄性动物更适合于脑血管病的研究。
[1]夏海波,张英谦.雌激素与缺血性脑卒中关系研究进展[J].中华老年心血管病杂志,2012,14(4):444-446.
[2]刘照寒,曲松滨.雌激素与女性缺血性脑卒中[J].现代生物医学进展,2012,1(12):195-197.
[3]Kooperberg C,Cushman M,Hsia J,et al.Can biomarkers identify women at increased stroke risk?The Women's Health Initiative Hormone Trials [J].PLoS Clin Trials,2007,2(6):e28.
[4]Lisabeth L D,Beiser A S,Brown D L,et al.Age at natural menopause and risk of ischemic stroke:the framingham heart study[J].Stroke,2009,40(4):1044-1049.
[5]Alkyaed N J,Harukunil,Kimes A S,et al.Genderlikned brain injury inexperimented stroke[J].Stroke,1998,29(1):159-166.
[6]Simpkins J W,Rajakuma G,Zhang Y Q,et al.Esortgens may reduce mortality and ischemic damage caused by middle cerebral artery occlusion in the female rat[J].J Neurosurg,1997,87(5):724-730.
[7]Toung T J,Tragsmtna R J,Hurn P D.Esrtogen-mediated neuroprotection after experimented sortke in male rats[J].Stroke,1998,29(8):1666-1670.
[8]吴乐,黎红华,陈文军,等.雌激素对绝经后雌性大鼠缺血性脑损伤的保护作用及机制[J].卒中与神经疾病,2008,15(1):6-8.
[9]Liao S,Chen W,Kuo J,et al.Association of serum estrogen level and ischemic neuroprotection in female rats[J].Neuorsci Lett,2001,297(3):159-162.
[10]McCullough L D,Alkayed N J,Traystman R J,et al.Postischemic estrogen reduces hypoperfusion and secondary ischemia after experimental[J].Stroke,2001,32(3):796-803.
[11]Strom J O,Theodorsson E,Holm L,et al.Different methods for administering 17b-estradiol to ovariectomized rats result in opposite effects on ischemic brain damage[J].BMC Neuroscience,2010,39(5):1407-1415.
[12]Ardelt A A,Anjum N,Rajneesh K F,et al.Estradiol augments peri-infarct cerebral vascular density in experimental stroke[J].Exp Neurol,2007,206(1):95-100.
[13]Hurn P D,Little-Kearney M T,Kirsch J R,et al.Postischemic cerebral blood flow recovery in the female:effect of 17 beta-estradiol[J].J Cereb Blood Flow Metab,1995,15(4):666-672.
[14]Vitale C,Mercuro G,Cerquetani E,et al.Time since menopause influences the acute and chronic effect of estrogens on endothelial function[J].Arterioscler Thromb Vasc Biol,2008,28(2):348-352.
[15]Dhandapani K M,Wade F M,Mahesh V B,et al.Astrocyte-derived transforming growth factor-{beta}mediates the neuroprotective effects of 17{beta}-estrogen:involvement of nonclassical genomic signaling pathways [J].Endocrinology,2005,146(6):2749-2759.
[16]于海燕,宫殿荣,陈德哲.雄激素与缺血性脑血管病[J].国际脑血管病杂志,2010,18(10):773-776.
