石墨烯修饰电极检测有机过氧化物的研究
2013-10-25袁兴宽杨海浪刘华俊刘慧宏
袁兴宽,杨海浪,刘华俊,杨 锋,刘慧宏
石墨烯修饰电极检测有机过氧化物的研究
袁兴宽1, 2,杨海浪1*,刘华俊1,杨 锋2,刘慧宏2
(1. 湖北文理学院 化学工程与食品科学学院,湖北 襄阳 441053;2. 武汉纺织大学 化学与化工学院,湖北 武汉 430073)
过氧化物在裸玻碳电极表面还原过电位较高,反应速度较慢。而石墨烯修饰电极能催化还原有机过氧化物,降低过电位441mV。本文研究了石墨烯修饰电极催化还原过氧化氢、氢过氧化异丙基苯、氢过氧化叔丁基、过氧化丁酮等过氧化物的反应机理。石墨烯修饰电具有较高的稳定性和重现性, 可用于这些物质的定量检测。
有机过氧化物;石墨烯;电化学传感器;修饰电极
有机过氧化物比双氧水具有更复杂的结构(见结构图)。有机过氧化物广泛地应用于工业过程,如纺织工业中的漂白剂,造纸工业中的氧化剂以及材料工业中高分子合成的引发剂等[1]。因此建立有机过氧化物的分析方法具有实际应用价值。有机过氧化物的电分析方法中,一是利用酶催化的高选择性,构筑电化学生物传感器[2];另一方法是利用化学修饰电极,将催化剂固定于电极表面,以降低氧化还原的过电位,促进电子的传递[3]。
近几年,由于碳纳米管和石墨烯的催化活性及电子特性,在电分析化学领域的研究方兴未艾[4-5]。其中石墨烯是一种具有独特量子效应的碳纳米结构的物质[6],一些文献报道了碳纳米管和石墨烯及其复合物检测过氧化氢[7-11],但石墨烯应用于电分析有机过氧化物,还未见报道。本文选择三种结构具有代表性的有机过氧化物(见图1)。实验表明,石墨烯修饰电极在较低电位下检测有机过氧化物,具有较高灵敏度和较高稳定性的特点。
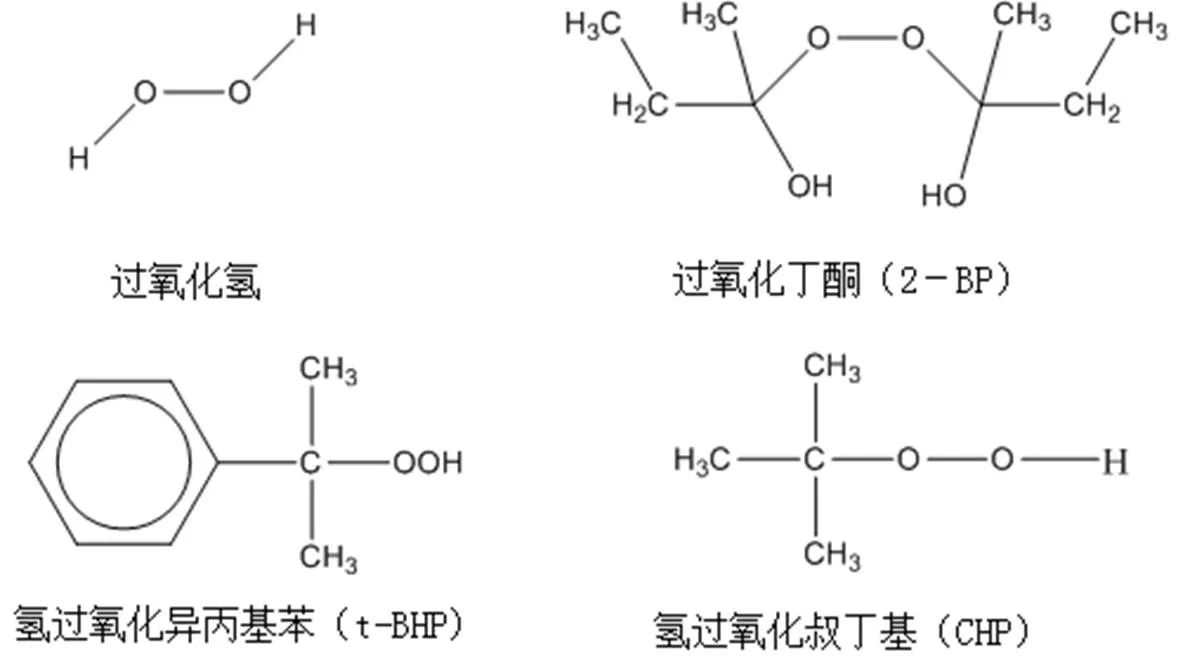
图1 过氧化物的结构图
1 实验部分
1.1 试剂和仪器
石墨烯 (5mg/ml,先锋纳米科技有限公司,南京),双氧水 (30%,凯通化学试剂有限公司,天津),有机过氧化物(Sigma),如氢过氧化异丙基苯(t-BHP)、氢过氧化叔丁基(CHP)和过氧化丁酮(2-BP)等过氧化物。所有化学试剂均为分析纯,直接使用配制贮备溶液。实验中使用超纯水(18.3MΩ)由超纯水系统制备(优普,成都)。
电化学测量使用电化学工作站(CHI812B,辰华,上海)。电化学池由参比电极腔和电化学反应腔两部分构成, 其间由鲁金(Luggin)毛细管连接. 参比电极为饱和甘汞电极(SCE),铂丝网为辅助电极, 工作电极为石墨烯修饰电极。所有实验在室温下进行。
1.2 石墨烯修饰电极的制备
玻碳电极(GC,Φ3mm, CHI) 用砂纸细磨后, 再用0.05 μm 粒度的Al2O3悬浊液在抛光布上抛光, 洗去表面污物,在水中超声清洗三次, 每次2 min。取5μL石墨烯溶液均匀涂布在新处理的电极表面,室温干燥约3~4小时。制备的修饰电极表示为GR/GCE。
2 结果与讨论
2.1 过氧化物在GR/GCE表面的电化学还原
用循环伏安法研究了过氧化物在GR/GCE表面的电化学性质。考虑石墨烯对氧有催化还原活性,首先对比研究了在溶解氧存在下,过氧化物在裸电极及GR/GCE表面的电化学行为。在溶解氧饱和的磷酸缓冲溶液(pH 7.0)中,电势在0.2~-0.8V范围内扫描,氧气,双氧水和过氧化丁酮在在裸玻碳电极表面氧化缓慢,其还原峰电位在-0.683V(图2Aa,2Ba,2Ab,1Bb)。但在GR/GCE表面,氧气在-0.242V有一明显的还原峰,这是氧气的2电子电化学还原反应(图2Ac,2Bc)。而加入过氧化物,也在-0.242V有一明显的还原峰,还原峰电流明显增加(图2Ad,2Bd),是过氧化物的2电子2质子的电化学还原反应。说明固定在玻碳电极表面的石墨烯,能有效地催化还原过氧化物。还原机理如下:
图2 过氧化氢(A)和过氧化丁酮(B)的循环伏安图:(a,b) GCE,(c,d) GR/GCE
计时电流法(i-t曲线)就是固定电位,测定加入待测物的响应电流,由于是在搅拌溶液的条件下进行,能消除充电电流及扩散电流的影响,因而能提高检测灵敏度和降低检测下限。图3是固定电位-0.15V,每间隔20秒,加入20μmol L-1过氧化物,在裸玻碳电极和GR/GCE上的i-t曲线。可见四种过氧化物在GR/GCE上产生的电流较大,约是GC上的4~11倍。
图3 电流-时间图:(A) H2O2, (B) 2-BP, (C)CHP and (D) t-BHP
2.2 pH的影响
过氧化物的电化学还原反应伴随着质子的传递,因此溶液的pH对过氧化物的还原电流有较大的影响。在实验溶液pH3.0-10.0范围内,对于双氧水(图4A)和过氧化丁酮(图4B),随着溶液pH从3.0增加到7.0,电流逐渐增加。但进一步增加溶液的pH ,电流逐渐减小。pH 7.0时,相同浓度的过氧化物获得最大的电流。所以分析样品时的溶液选择为磷酸缓冲溶液pH7.0.
图4 电流随溶液pH变化图:(A) 2-BP 和(B)H2O2
2.3 GR/GCE检测过氧化物
利用计时电流方法建立四种过氧化物的线性回归方程,从而求得检测过氧化物的线性范围和检测下线。固定电位-0.15 V ,在10mL的电解池中,盛装5mL的磷酸缓冲溶液(pH 7.0)。开启磁力搅拌装置,向溶液中连续加入10μL,浓度为0.05mol L-1过氧化物。i-t曲线显示(图5),随着过氧化物浓度增加,电流也逐渐增大。还原反应速度较快,在5s之内,电流达到稳态。电流与过氧化物的浓度呈线性关系。四种过氧化物的浓度与电流的关系列于表1中。
图5 电流-时间曲线及电流浓度线性关系图:(A)H2O2, (B)2-BP, (C)CHP, (D)t-BHP
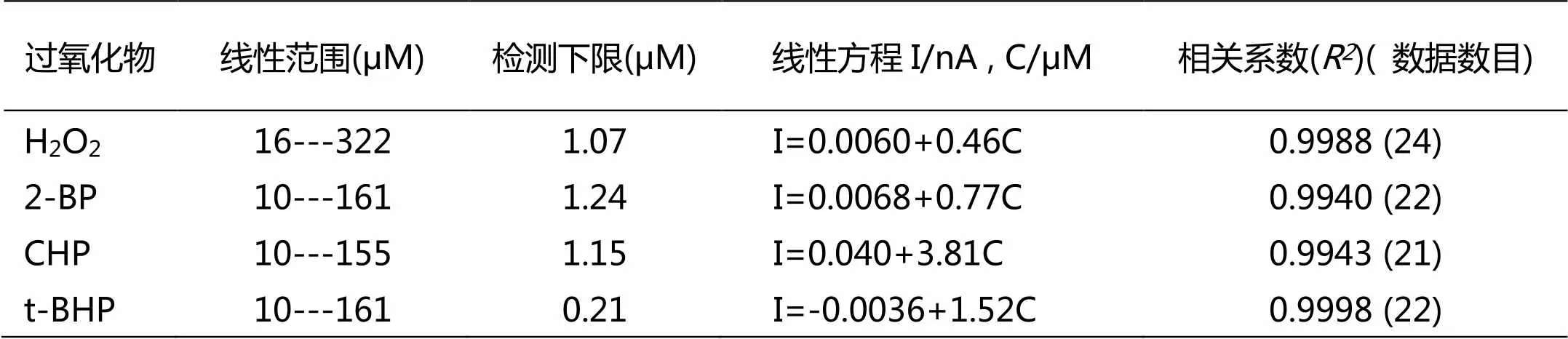
表1 过氧化物的分析特性
2.4 GR/GCE的稳定性,重现性,选择性及样品的测定
GR/GCE具有较好的稳定性。电极放置在磷酸缓冲溶液中保存3天后,过氧化氢、过氧化丁酮、氢过氧化叔丁基和氢过氧化异丙基苯的响应电流分别只下降4.2%, 5.9%, 3.1% 和4.3%。
GR/GCE具有较好的重现性。电极连续在过氧化物溶液中连续测定10次,过氧化氢、过氧化丁酮、氢过氧化叔丁基和氢过氧化异丙基苯电流测定的相对标准偏差分别为0.17%, 0.2%, 0.19% 和0.04%。
GR/GCE具有较高的选择性。一些常用的金属离子,如浓度为100倍的Cu2+, Fe3+,Ca2+, Mg2+, K+, Na+;10倍的葡萄糖,尿酸,多巴胺,抗坏血酸等有机物不干扰过氧化物的响应。
GR/GCE应用于检测实际水样中过氧化物的可能性实验。分别取自来水和汤逊湖水,采用多次标准加入法,用双氧水和过氧化丁酮为模型物,求得的回收率分别为:97.21~103.96(自来水)和98.48~102.53(汤逊湖水)。说明GR/GCE应用于水样中过氧化物的检测,结果满意。
3 结论
相对裸玻碳电极,石墨烯修饰电极对过氧化物具有较强的催化效果,表现为还原过电位大幅度下降和电化学反应速度大幅度提高。此电极应用于检测有机过氧化物,具有操作简单,检测线性范围宽,检测下限低的特点。标准加入法实验显示,该方法应用于实际水样的检测,结果满意。
[1] Wang J, Angnes L, Liang C. Electrocatalysis and amperometric detection of organic peroxides at modified carbon-paste electrodes[J].Talanta, 1991, 38: 1077-1081.
[2] Liu HH, Tian ZQ, Lu ZX, et al. Direct Electrochemistry and Electrocatalysis of Heme-proteins Entrapped in Agarose Hydrogel Films[J].Biosensors and Bioelectronics, 2004, 20: 294-304.
[3] Liu HJ, Yang DW, Liu HH.A hydrogen peroxide sensor based on the nanocomposites of poly(brilliant cresyl blue) and single walled-carbon nanotubes[J].Anal Methods, 2012, 4: 1421-1426.
[4] Ahammad A J S,Lee JJ,Rahman M A.Electrochemical Sensors Based on Carbon Nanotubes[J].Sensors, 2009, 9: 2289-2319.
[5] Liu YX, Dong XC, Chen P. Biological and chemical sensors based on graphene materials[J].Chem Soc Rev,2012, 41: 2283-2307.
[6] Chen D, Tang LH, Li JH.Graphene-Based Materials in Electrochemistry[J].Chem Soc Re v, 2012,112: 6027-6053.
[7] Cui L,Chen LJ,Xu MR,et al. Nonenzymatic amperometric organic peroxide sensor based on nano-cobalt phthalocyanine loaded functionalized graphene film[J].Anal Chim Acta, 2012, 712: 64-71.
[8] Woo S,Kim YR,Chung TD,et al. Synthesis of a graphene-carbon nanotube composite and its electrochemical sensing of hydrogen peroxide[J].Electrochim Acta, 2012, 59: 509-514.
[9] Xu FG,Sun YJ,Zhang Y,Shi, et al. Graphene-Pt nanocomposite for nonenzymatic detection of hydrogen peroxide with enhanced sensitivity[J].Electrochem Commun,2011, 13: 1131-1134.
[10]Li LM,Liu SA,Hao QY,et al. A novel nonenzymatic hydrogen peroxide sensor based on MnO2/graphene oxide nanocomposite[J].Talanta, 2010, 82:1637-1641.
[11]Lin WJ, Liao CS, Jhang JH, et al.Graphene modified basal and edge plane pyrolytic graphite electrodes for electrocatalytic oxidation of hydrogen peroxide and beta-nicotinamide adenine dinucleotide[J].Eelectrochem Commun, 2009, 11: 2153-2156.
Graphene-modifided Glassy Carbon Electrode for the Determination of Organic Peroxides
YUAN Xing-kuan1,2, YANG Hai-lang1, LIU Hua-jun1, YANG Feng2, LIU Hui-hong2
(1.School of Chemical Engineering & Food Science, Hubei University of Arts and Science, Xiangfan Hubei 441053, China;2. School of Chemistry & Chemical Engineering, Wuhan Textile University, Wuhan Hubei 430073, China)
This paper demonstrates that organicperoxides can be catalytically reduced at a graphene modified electrode. While on a bare glassy carbon electrode, none of the peroxides can be reduced within the potential range studied. When used in amperometric analysis, the modified electrode permits the detection of model organic peroxides such as t-butyl hydroperoxide, 2-butanone peroxide and cumene hydroperoxide by reduction mechanism at higher potentials without the interference from oxygen. The response is stable and has a wide dynamic range.
Organic Peroxides;Graphene;Electrochemical Sensor;Modified Electrode
TN383-1
A
2095-414X(2013)06-0023-04
湖北省教育厅科技项目(D20122503).
杨海浪(1962-),男,教授,研究方向:复合材料.
