海滨锦葵块根皂苷及多糖的分离、纯化及对细胞增殖活性的影响
2013-10-25李思宇袁亚光张鹤云张太平
李思宇,袁亚光,钦 佩,张鹤云,张太平
南京大学盐生植物实验室,南京210093
海滨锦葵(Kosteletzkya virginica)是锦葵科海滨锦葵属多年生宿根和耐盐油料植物,分布于美国含盐沼泽地带,1993年由南京大学生命科学学院盐生植物实验室引种进入国内[1]。皂苷(saponin)是一类皂苷元与糖结合处的糖苷,在植物界分布广泛,是最常见的中药有效成分之一[2],很早就被发现具有抑制肿瘤细胞生长的特性[2-6]。根据皂苷苷元部分的不同,把皂苷分为甾体皂苷和三萜皂苷两大类[2],海滨锦葵块根内的皂苷经鉴定,属于三萜皂苷。植物多糖(polysaccharides)是由10个以上单糖通过糖苷键连接而成的线性或分支的聚合物[7],在生命活动中,多糖参与机体自身免疫防御系统[8]。除了比利时鲁汶大学的学者对海滨锦葵体内的多糖粘液做了定位与成分分析,探讨了多糖粘液在海滨锦葵抗盐生理中的作用以外[9],国内外尚未见将上述两种活性成分从海滨锦葵块根中同步分离的报道[10,11],本实验对海滨锦葵块根中的皂苷及多糖进行了分离、提纯,并对皂苷的体外抑制肿瘤细胞增殖特性、多糖的免疫活性进行了初步研究,旨在推动海滨锦葵块根活性成分的研发。
1 材料与方法
1.1 实验材料与仪器
海滨锦葵块根,采自江苏大丰金海农场种植基地;昆明种小白鼠,雌雄各半,体重17~22 g,由南京医科大学动物饲养中心提供,清洁级;肝癌HepS细胞株由中科院上海药物研究所提供,本实验室培养传代;四甲基偶氮唑盐(MTT),南京大治生物科技有限公司提供;ConA,FluKa公司产品;胎牛血清,北京元亨圣马生物技术研究所提供;其他常用试剂均为分析纯。
DG5033A酶联免疫检测仪,南京华东电子集团医疗装备有限公司;CO2培养箱,Thermo Forma公司;TG162W型微量高速离心机,长沙湘仪离心机仪器公司。
1.2 实验方法
1.2.1 海滨锦葵块根皂苷及多糖的提取
取海滨锦葵块根洗净、干燥、粉碎,取50 g,以1:15(w:v)的比例加蒸馏水,用超声仪超声提取,超声条件:温度60℃,功率200 w,时间1 h,超声后用纱布过滤,滤液存放,滤渣再用上述条件重复一次。两次滤液合并,减压蒸发,得浓缩液。加70%的酒精沉淀多糖,用真空泵抽滤多次,得到粗多糖和滤液。滤液旋转蒸发得到少量皂苷粗提液。
将皂苷粗提液上D101大孔树脂,先用蒸馏水洗去杂质,然后用40%乙醇洗涤其他物质,最后使用80%乙醇洗脱,得到含有锦葵皂苷的乙醇洗脱液,将此溶液旋转蒸发去乙醇,得到精制的含锦葵块根皂苷的浓缩液。
将锦葵粗多糖加入适量水溶解后,加入等体积20%三氯乙酸,沉淀去除蛋白,离心得上清液,减压蒸馏后的浓缩液对水透析,透析后的溶液加乙醇沉淀,干燥,得去蛋白块根多糖溶液。将该溶液上DEAE-纤维素柱层析,用0~1 mol/LNaCl溶液梯度洗脱,分部收集,测定各管以得洗脱峰,合并洗脱峰浓缩,干燥得初步纯化的多糖。
1.2.2 皂苷的酸水解获取皂苷元
取上述提取的部分皂苷,吹干,溶于20 mL,4%的硫酸溶液中,加入20 mL的石油醚,在80℃水浴酸解4 h。完毕后倾入分液漏斗中,冷却、分层,取上层(石油醚溶液),先用碳酸钠溶液洗至中性,再用蒸馏水洗涤,回收石油醚,蒸干,置60℃下真空干燥,得到提取物皂苷元,称重即可。
1.2.3 MTT法细胞体外增殖分析
1.2.3.1 海滨锦葵块根皂苷、皂苷元对肝癌细胞(HepS)体外增殖的抑制作用
无菌条件下取接种7~10 d的HepS瘤源小鼠的腹水,加Hanks洗涤,制成单个细胞悬液,1500 rps离心5 min,去上清,将细胞悬浮在5 mL的RPMI-1640培养基(内含10%小牛血清)中,用血球计数板进行细胞计数,调整细胞浓度为1×106/mL,加入2块96孔板中,80 μL/孔。随后加入用PRMI-1640培养基稀释的不同浓度皂苷和皂苷元样品,80 μL/孔,对照孔加RPMI-1640培养基80 μL/孔。将板置于37℃ 5%CO2培养箱内,一块培养24 h,一块培养48 h。到时间后每孔加入2.5 mg/mL的MTT 8.5 μL,继续培养4 ~6 h,再加入20%SDS 溶液40 μL/孔,培养过夜。次日于酶标仪上,490 nm下测OD值。做三次重复,每组的复孔取均值,并计算细胞生长抑制率。
细胞生长抑制率 =(A空白对照-A实验)/A空白对照×100%
1.2.3.2 海滨锦葵块根多糖对淋巴细胞体外增殖的影响
于无菌条件下,取雄性17~22 g重小鼠脾脏和胸腺,分别置培养皿中,加Hanks洗涤,在无菌不锈钢网上研磨,制成单个细胞悬液,1500 rps离心5 min,去上清,将细胞悬浮在5 mL的RPMI-1640培养基(内含10%小牛血清)中,用血球计数板进行细胞计数,调整细胞浓度为1×106/mL,加入96孔板,80 μL/孔。随后加入不同稀释浓度的纯化后的多糖样品,80 μL/孔,对照孔加 PRMI-1640培养基80 μL/孔。脾脏和胸腺得到的细胞悬液分别同时做两块板,一块板加入25.0 μg/mL 的 ConA40 μL/孔,另一块板补加RPMI-1640培养基40 μL/孔,观察细胞增殖反应。将板置于37℃ 5%CO2培养箱内培养24 h。每孔加入2.5 mg/mL的MTT 8.5 μL,继续培养4 ~6 h,再加入 20%SDS 溶液 40 μL/孔,培养过夜。次日在酶标仪490 nm下测OD值,以无细胞培养基调零。做三次重复,每组的复孔取均值,并计算细胞生长促进率。
细胞生长促进率 =(A实验-A空白对照)/A空白对照×100%
1.3 数据分析
用Excel 2010进行数据统计整理,用SPSS18.0进行差异显著性检验。
2 结果与分析
2.1 海滨锦葵块根活性物质提取得率
实验得到精制的含锦葵块根皂苷的浓缩液73 mL,经检测浓度为0.61 mg/mL,即皂苷含量为44.53 mg,每克海滨锦葵块根能提取0.89 mg皂苷(0.89 mg/g);实验得到粗多糖干重2.55 g(51 mg/g),粗多糖提取率5.10%。粗多糖经由沉淀结合蛋白、DEAE-纤维素柱层析洗脱后,收集三个主要洗脱峰(图1),合并洗脱液并旋转蒸发浓缩,浓缩液干燥后得到纯多糖干重为446 mg。
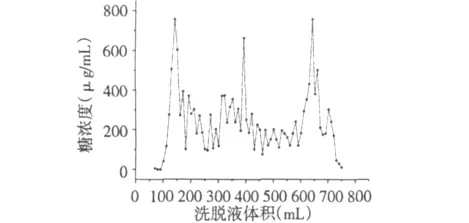
图1 粗多糖经DEAE-纤维素柱层析洗脱曲线Fig.1 Elution curve of polysaccharides by DEAE-cellulose
2.2 海滨锦葵块根皂苷及皂苷元的体外抑制肿瘤细胞增殖活性
海滨锦葵块根皂苷及皂苷元对体外培养的HepS细胞增殖的影响结果分别见表1和表2。由表可知,皂苷和皂苷元对HepS肿瘤细胞均有抑制作用,且皂苷元的抑制效果好于皂苷;培养24 h与培养48 h抑制率差别不大;培养24 h情况下,皂苷浓度达到60 μg/mL时,才有显著抑制效果(P<0.05),抑制率10%,而皂苷元在20 μg/mL时,抑制率便达到26.32%,差异极显著(P<0.01);皂苷浓度与抑制效果有明显的量效依赖关系,随着浓度的增加,抑制效果增强;皂苷元由于在低浓度就能达到很高的抑制效果,量效依赖关系不明显。
表1 海滨锦葵皂苷对鼠肝癌HepS细胞增殖的影响(±s,n=12)Table 1 Effects of saponin from Kosteletzkya virginica on mouse hepatoma cell HepS proliferation(±s,n=12)
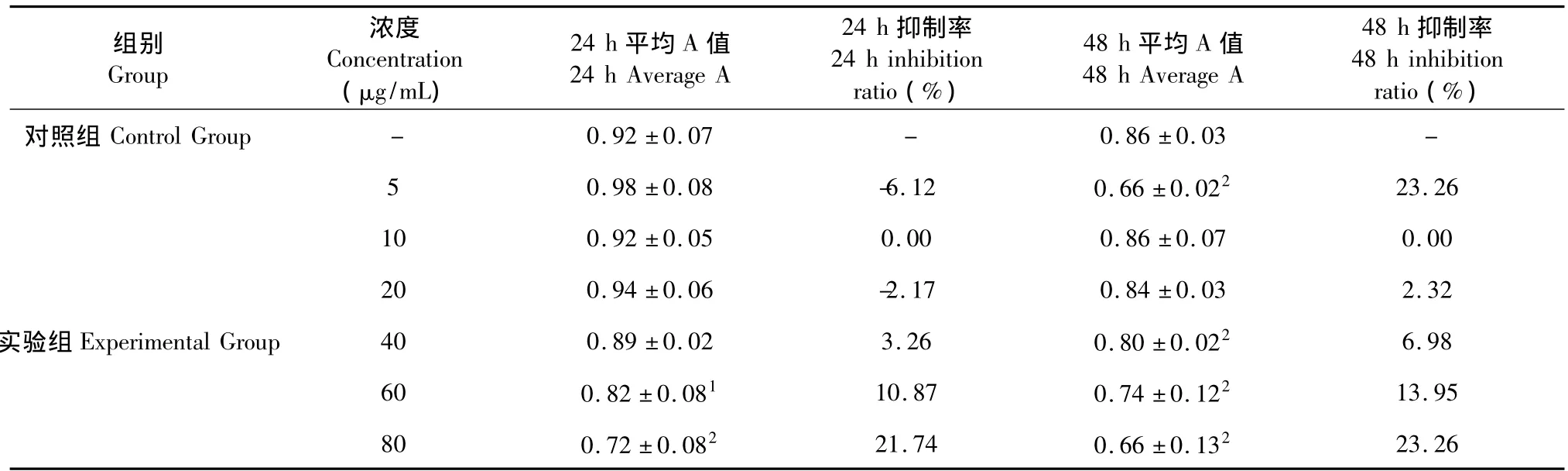
表1 海滨锦葵皂苷对鼠肝癌HepS细胞增殖的影响(±s,n=12)Table 1 Effects of saponin from Kosteletzkya virginica on mouse hepatoma cell HepS proliferation(±s,n=12)
注:与对照组相比:1P<0.05,2P <0.01。Note:Compared with control group:1P <0.05,2P <0.01.
组别Group浓度Concentration(μg/mL)24 h平均A值24 h Average A 24 h抑制率24 h inhibition ratio(%)48 h平均A值48 h Average A 48 h抑制率48 h inhibition ratio(%)对照组Control Group - 0.92±0.07 - 0.86±0.03 -5 0.98±0.08 -6.12 0.66±0.022 23.26 10 0.92±0.05 0.00 0.86±0.07 0.00 20 0.94±0.06 -2.17 0.84±0.03 2.32实验组Experimental Group 40 0.89±0.02 3.26 0.80±0.022 6.98 60 0.82±0.081 10.87 0.74±0.122 13.95 80 0.72±0.082 21.74 0.66±0.13223.26
表2 海滨锦葵皂苷元对鼠肝癌HepS细胞增殖的影响(±s,n=12)Table 2 Effects of genipin from Kosteletzkya virginica on mouse hepatoma cell HepS proliferation(±s,n=12)
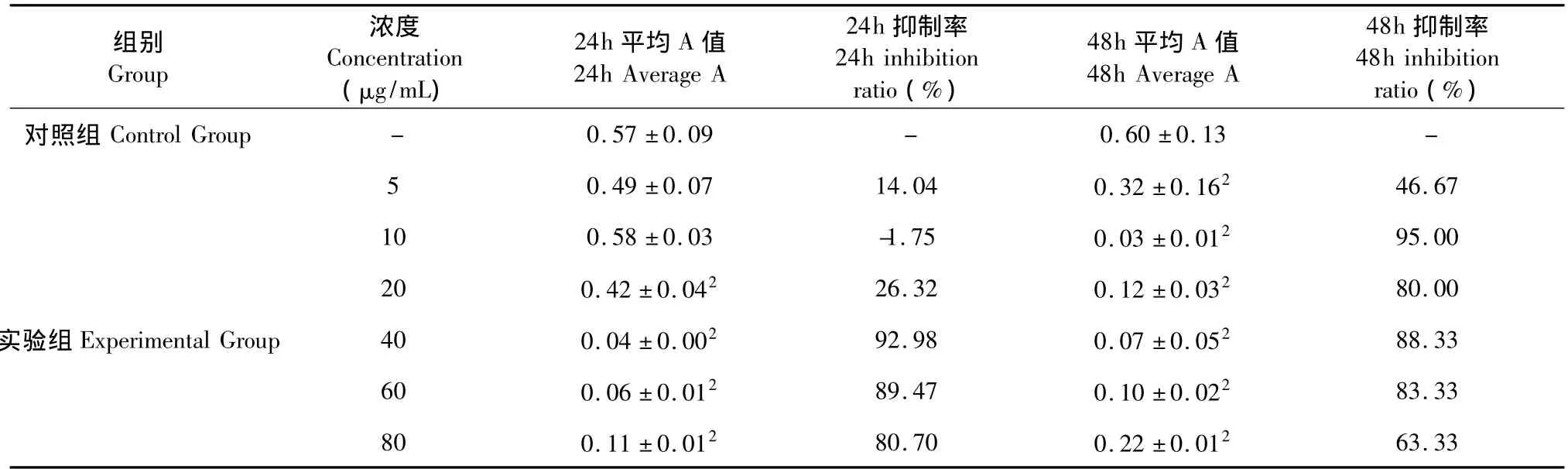
表2 海滨锦葵皂苷元对鼠肝癌HepS细胞增殖的影响(±s,n=12)Table 2 Effects of genipin from Kosteletzkya virginica on mouse hepatoma cell HepS proliferation(±s,n=12)
注:与对照组相比:1P<0.05,2P <0.01。Note:Compared with control group:1P <0.05,2P <0.01.
组别Group浓度Concentration(μg/mL)24h平均A值24h Average A 24h抑制率24h inhibition ratio(%)48h平均A值48h Average A 48h抑制率48h inhibition ratio(%)对照组Control Group - 0.57±0.09 - 0.60±0.13 -5 0.49±0.07 14.04 0.32±0.162 46.67 10 0.58±0.03 -1.75 0.03±0.012 95.00 20 0.42±0.042 26.32 0.12±0.032 80.00实验组Experimental Group 40 0.04±0.002 92.98 0.07±0.052 88.33 60 0.06±0.012 89.47 0.10±0.022 83.33 80 0.11±0.012 80.70 0.22±0.01263.33
2.3 海滨锦葵块根多糖的免疫活性
海滨锦葵块根多糖对正常小鼠胸腺淋巴细胞增殖的影响结果见表3。与空白对照组相比,各浓度块根多糖样品在体外都能直接促进小鼠胸腺淋巴细胞的增殖,且效果极显著(P<0.01),随着浓度的提高,促进效果增强,有明显的量效依赖关系。块根多糖与有丝分裂原ConA联合刺激胸腺淋巴细胞时,与不添加ConA的实验组相比,促进效果无太大差异,未见有协同作用。
表3 海滨锦多糖对胸腺淋巴细胞增殖的影响(±s,n=12)Table 3 Effects of polysaccharides from Kosteletzkya virginica on thymus lymphocyte proliferation(±s,n=12)
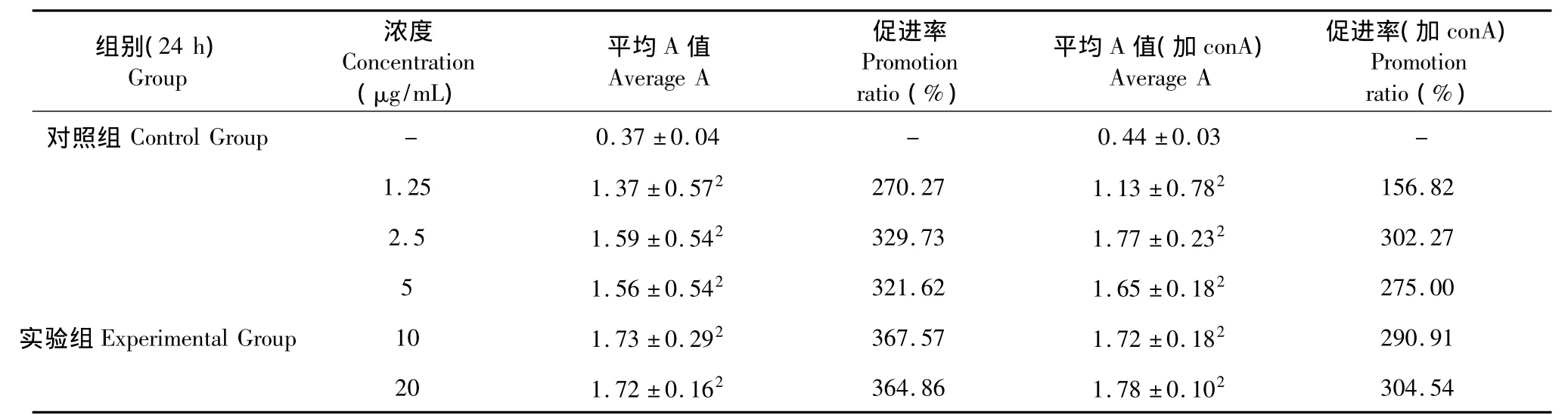
表3 海滨锦多糖对胸腺淋巴细胞增殖的影响(±s,n=12)Table 3 Effects of polysaccharides from Kosteletzkya virginica on thymus lymphocyte proliferation(±s,n=12)
注:与对照组相比:1P<0.05,2P <0.01。Note:Compared with control group:1P <0.05,2P <0.01.
组别(24 h)Group浓度Concentration(μg/mL)平均A值Average A促进率Promotion ratio(%)平均A值(加conA)Average A促进率(加conA)Promotion ratio(%)对照组Control Group - 0.37±0.04 - 0.44±0.03 -1.25 1.37±0.572 270.27 1.13±0.782 156.82 2.5 1.59±0.542 329.73 1.77±0.232 302.27 5 1.56±0.542 321.62 1.65±0.182 275.00实验组Experimental Group 10 1.73±0.292 367.57 1.72±0.182 290.91 20 1.72±0.162 364.86 1.78±0.102304.54
海滨锦葵块根多糖对正常小鼠脾淋巴细胞增殖的影响结果见表4。与空白对照组相比,在最低浓度1.25 μg/mL时,块根多糖对脾淋巴细胞体外增殖促进增殖效果显著(P<0.05),其余各浓度组促进效果极显著(P<0.01)随着浓度的提高,促进效果同样增强,有明显的量效依赖关系。块根多糖与有丝分裂原ConA联合刺激脾淋巴细胞时,与没添加ConA的实验组相比,无太大差异,未见有协同促进增殖作用。
表4 海滨锦多糖对脾淋巴细胞增殖的影响(±s,n=12)Table 4 Effects of polysaccharides from Kosteletzkya virginica on spleen lymphocyte proliferation(±s,n=12)
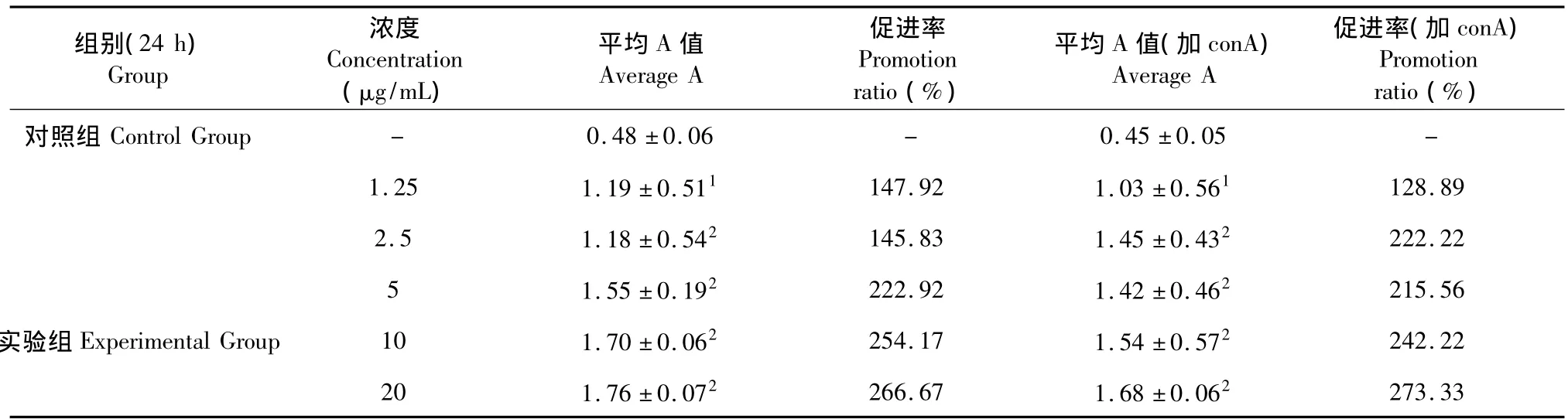
表4 海滨锦多糖对脾淋巴细胞增殖的影响(±s,n=12)Table 4 Effects of polysaccharides from Kosteletzkya virginica on spleen lymphocyte proliferation(±s,n=12)
注:与对照组相比:1P<0.05,2P <0.01。Note:Compared with control group:1P <0.05,2P <0.01.
组别(24 h)Group浓度Concentration(μg/mL)平均A值Average A促进率Promotion ratio(%)平均A值(加conA)Average A促进率(加conA)Promotion ratio(%)对照组Control Group - 0.48±0.06 - 0.45±0.05 -1.25 1.19±0.511 147.92 1.03±0.561 128.89 2.5 1.18±0.542 145.83 1.45±0.432 222.22 5 1.55±0.192 222.92 1.42±0.462 215.56实验组Experimental Group 10 1.70±0.062 254.17 1.54±0.572 242.22 20 1.76±0.072 266.67 1.68±0.062273.33
3 讨论
海滨锦葵块根皂苷提取率仅为0.089%,皂苷含量不高;李鹏飞等用水提法提取人参、西洋参总皂苷,提取率分别为6.02%、5.01%[12]。海滨锦葵粗多糖提取率为5.10%;韩真贤等对黄芪多糖进行提取,发现水提醇沉法的提取率为4.47%[13];海滨锦葵多糖提取率比黄芪多糖高。不同物种之间的皂苷、粗多糖含量、粗多糖结合蛋白量等有所差异,另外不同的提取方法测定出来的结果也不尽相同。人参、黄芪本就是传统药物,其生物活性物质的研究工作已有很多学者报导。因此,就海滨锦葵块根而言,其活性物质的分离、纯化工艺还需进一步研究及改善,通过正交实验来确定最佳的超声波功率、处理时间、温度等等,并尽量减少操作过程中的损耗,从而提高得率、纯度。
体外抑制肿瘤细胞增殖活性实验表明,海滨锦葵块根皂苷能对HepS肿瘤细胞起到抑制作用,且皂苷浓度与抑制效果有量效依赖关系;皂苷元对HepS的抑制效果强于皂苷,且低浓度皂苷元便有很高抑制效果,所以量效依赖关系不明显。海滨锦葵块根多糖对胸腺淋巴细胞及脾淋巴细胞体外增殖的促进效果明显,量效依赖关系显著,且与ConA无协同效应。
以上实验说明,海滨锦葵块根皂苷及有一定体外抑制肿瘤细胞增殖的活性,海滨锦葵块根多糖具备增强体液免疫力的功效,其具体机理机制有待深入发掘。本实验仅是一个初步研究,为合理开发利用海滨锦葵资源提供依据。同时为了推进耐盐油料植物的综合利用,在改进栽培方式以利生物活性物质积累、改进提取工艺(如用CO2超临界萃取)以利提高得率等方面再继续推进相关研究。
1 Xu WG(徐万国),Qin P(钦佩),,Xie M(谢民),et al.A study on the trial planting ecology of Kosteletzkya virginica in China.J Nangjing Univ Nat Sci Ed(南京大学学报,自科版),1996,32:268-274.
2 Shang LL(尚丽丽),Sun JG(孙建国),Xie HT(谢海棠),et al.Saponins in tumor therapy.Chin J Clin Pharm Ther(中国临床药理学与治疗学),2010,15:225-232.
3 Zha LY(查龙应),Chen LL(陈兰兰),Luo HJ(罗海吉).Advances on anticancer bioactivities of soyasaponins.Nat Prod Res Dev(天然产物研究与开发),2009,21:1076-1079.
4 Yan B(闫冰),Li L(李玲),Yi YH(易杨华),et al.Study on bioactive triterpene glycosides of sea cucumber Holothuria scabra Jaeger.Acad J Sec Mil Med Univ(第二军医大学学报),2005,26:626-631.
5 Li W(李伟),Qi Y(齐云),Wang Z(王梓),et al.Study on anti-tumor activity of saponins from Platycodi Radix in vitro.Phar Clin Chin Mat Med(中药药理与临床),2009,25(2):37-40.
6 Shang XL(尚西亮),Fu HQ(傅华群),Liu J(刘佳),et al.Inhibitory effects on human hepatocarcinoma cells with panax notoginseng saponins.Chin J Clin Rehab(中国临床康复),2006,10:121-123.
7 Liu XK(刘星垲),Wang MY(王美英),Wu HS(吴厚生),et al.Studies on isolation of astragalan and its immunological activities.Nat Prod Res Dev(天然产物研究与开发),1994,6:23-31.
8 Wang J(王健),Gong XG(龚兴国).Advances in the studies on the antitumor activity and immune-modulating action of polysaccharides.Chin J Biochem Phar(中国生化药物杂志),2001,22:52-54.
9 Ghanem ME,Han R.Mucilage and polysaccharides in the halophyte plant species Kosteletzkya virginica:Localization and composition in relation to salt stress.J Plant Physiol,2010,167:382-392.
10 Islam MN,Wilson CA,Watkins TR.Nutritional evaluation of seashore mallow seed Kosteletzkya virginica.J Agric Food Chem.1982,30:1195-1198.
11 Ruan CJ,Guo YQ,Qin P,et al.Kosteletzkya virginica,an agroecoengineering halophytic species for alternative agricultural production in China's east coast:Ecological adaptation and benefits,seed yield,oil content,fatty acid and biodiesel properties.Ecol Eng,2008,32:320-328.
12 Li PF(李鹏飞),Liu CY(刘春莹),Guo JY(郭俊莹),et al.Comparison of the Saponin Composition in the Stem and Leaf of Different Type of Ginseng.J Anhui Agri(安徽农业科学),2010,38:13077-13079.
13 Han ZX(韩真贤),Zhang Y(张宇),Zhang YJ(张云杰),et al.Comparison of three extraction processes for Astragalus polysaccharide.Heilongjiang Med Phar(黑龙江医药科学),2009,32(4):72-73.
