聚球藻Synechococcus sp.中活性物质分离及活性研究
2013-10-25赵小惠孙利芹刘红辉汲红丽
赵小惠,孙利芹,刘红辉,汲红丽,卫 东
烟台大学生命科学学院,烟台 264005
天然产物始终是新药的源泉,作为海洋的初级生产者和海洋生物种属的主体,海洋微藻在海洋生态系统的物质循环和能量流动中起着重要作用,独特的生存环境和原始地位赋予了微藻多种新颖独特的具有生物活性的代谢产物,并具有生长快、产量高、可定向培养、易调控等特点,成为丰富的开发新药的潜在资源[1]。聚球藻(Synechococcus)是蓝藻(Cyanobacteria)的一种单细胞藻类,细胞呈圆柱形、卵形或椭圆形,广布于世界各大洋,数量巨大,特别是在近岸水域数量丰富,在热带和温带海洋中的丰度通常在103~105个/mL,是超微型浮游生物中的优势组分[2]。目前,对于聚球藻的研究主要集中在其生长条件、对环境的影响、分子生物学等方面[3,4],我们实验室已经在聚球藻油脂成分及培养条件优化方面作了深入研究[5],但是对其胞内活性成分的研究尚未见报道。本研究主要通过溶剂提取、柱层析分离等手段从聚球藻中分离活性化合物成分,并跟踪其生物活性,以便为从海洋微藻中寻找新的抑菌、抗氧化活性成分奠定基础。
1 材料与方法
1.1 材料与仪器
聚球藻(Synechococcus)原种由中国海洋大学微藻种质库(MACC)提供,经进一步分离纯化后由烟台大学海洋生化工程研究所保存。
实验仪器:RE52CS-2旋转蒸发器,上海亚荣生化仪器厂;6980GC-5973MS气质联用仪,安捷伦公司;SW-CJ-IFD型单人单面净化工作台,苏州净化设备有限公司;Agilent 1100型高效液相色谱仪,美国安捷伦科技有限公司;LabTeach UV-1100型紫外分析仪,美国莱伯泰科公司;Bruker AVANCE 400 Digital NMR型核磁共振仪,德国Bruker公司。
1.2 聚球藻有机溶剂粗提物的制备
通过冷冻干燥收集获得藻粉83.2 g,对藻粉用95%的乙醇浸提3次,浸提液浓缩后悬浮于水中,分别用等体积的石油醚、乙酸乙酯、正丁醇各萃取3次,合并各相萃取相并浓缩,获得三种有机溶剂粗提物。
1.3 各相粗提物的抑菌活性检测
采用牛津杯法[6],受试菌株为枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌和普通变形杆菌四种细菌,配制LB培养基,灭菌后在超净工作台中倒平板,将四种细菌接种(1~2接种环)到10 mL无菌水中,制成菌悬液。取0.05 mL菌悬液加入平板中,涂布均匀,在平板上放置牛津杯,并在牛津杯中加入0.15 mL 15 mg/mL的样品乙醇溶液,以无水乙醇为空白对照,每个菌种做3组平行对照。将培养皿在37℃下恒温培养24 h,观察抑菌圈的大小及有无,从而判断有无抑菌效果及抑菌能力的大小。
1.4 各相粗提物的抗氧化活性检测
采用Binsan等的方法[7]稍加改进。测定方法:1.5 mL的DPPH溶液(0.2 mmol/L无水乙醇配制)加入到1.5 mL的各种样品的无水乙醇溶液中,剧烈震荡后,室温避光反应30 min后,以无水乙醇为空白,于517 nm处测定吸光值。平行测定3次。测定结果以清除率(E)表示,计算公式:
E(%)=[1-(A样品-A样品对照)/A对照]×100%
其中,A样品:1.5 mL DPPH溶液 +1.5 mL样品溶液的吸光值;A样品对照:1.5 mL无水乙醇溶液+1.5 mL样品溶液的吸光值;A对照:1.5 mL DPPH溶液+1.5 mL无水乙醇溶液的吸光值。
1.5 各相粗提物组成成分分析
三种有机相粗提物组成成分采用GC-MS色谱技术进行分析。
样品进行甲酯化:取出各相粗提物用水悬浮,盐酸调pH至3,用正己烷萃取,萃取的有机相萃取液除去有机溶剂后做甲酯化。所得样品置于150 mL量筒中用乙醚/正己烷(2∶1)15 mL溶解,然后加入甲醇15 mL、0.8 mol/L氢氧化钾溶液15 mL,摇匀后静置5 min,加蒸馏水至刻度,吸取上层脂肪酸甲酯做GC-MS分析。
GC条件:DB-WAX柱:30 m×0.25 mm×0.25 μm;进样口温度:230℃ ;进样方式:分流进样;分流比:20∶1;柱流量:0.88 mL/min;柱温(程序升温):150℃(保留2 min)→230℃(保留60 min)。
MS条件:离子源温度:200℃;Interface Temp:230℃;扫描质量范围:40~450 amu。
1.6 聚球藻石油醚相的分离纯化
硅胶柱层析分离:以200~300目的硅胶装填玻璃柱,以石油醚/丙酮(6∶1至100%丙酮)进行梯度洗脱,收集馏分Ⅰ~Ⅲ。
凝胶柱进一步分离纯化:将组分Ⅰ用Sephadex LH-20凝胶柱分离,以氯仿/甲醇1∶1进行洗脱,收集馏分,在254 nm下检测馏分的紫外吸收。
制备型薄层层析:经凝胶柱分离后收集的馏分,再经薄层层析纯化收集,以石油醚/丙酮5∶1为展开剂,获得单体化合物2.15 mg。
1.7 化合物纯度检测及结构鉴定
经薄层层析获得的化合物采用高效液相进行纯度检测。HPLC色谱条件:C18柱;检测波长:205 nm;流速1.0 mL/min,检测时间30 min;流动相:甲醇∶水 =98∶2。
结构鉴定:样品用CDCl3溶解后,室温条件下,在BrukerAVANCE400 DigitalNMR型核磁共振仪上做碳谱和氢谱检测,与化合物标准库进比对,确定化合物的结构。
2 结果与讨论
2.1 各相粗提物的抗菌活性
各有机相粗提物的抑菌活性从表1可以看出:石油醚相,乙酸乙酯相和正丁醇相对四种细菌均有一定的抑制作用,其中石油醚相抑菌效果较明显,乙酸乙酯相和正丁醇相抑菌作用相当,水相对细菌没有抑菌活性,这与江红霞等的文献报道[8]相符,即微藻中水溶性提取物基本没有抑菌活性。
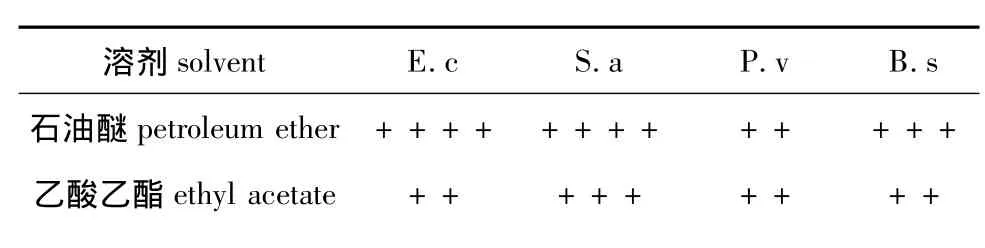
表1 有机相粗提物的抑菌活性Table 1 The antibacterial activity of organic phase crude extracts
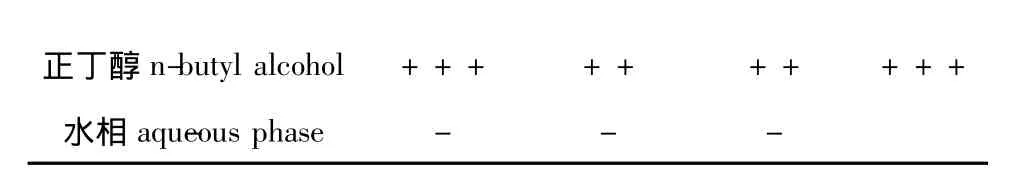
注:1)-无抑菌圈,+7.1-9.0 mm,++9.1-11.0 mm,+++11.1-13.0 mm,++++13.1-15.0 mm;2)B.s枯草芽孢杆菌,S.a金黄色葡萄球菌,E.c大肠杆菌,P.v普通变形杆菌。Note:1)– no bacterial colony grows,+7.1-9.0 mm,++9.1-11.0 mm,+++11.1-13.0 mm,++++13.1-15.0 mm;2)B.s bacillus subtilis,S.a staphylococcus aureus,E.c escherichia coli,P.v Proteus vulgaris.
2.2 各相粗提物的抗氧化活性
由图1可看出,各相自由基清除率大小对浓度有一定依赖关系,浓度越大,清除率越高,石油醚相的自由基清除率较好,在相同样品浓度下,石油醚相的自由基清除率明显高于乙酸乙酯相和正丁醇相,当样品浓度为150 μg/mL时,石油醚相的自由基清除率远大于另外两相,且三相溶剂的极性大小为石油醚<乙酸乙酯<正丁醇,三相相比,发现抗氧化活性物质主要集中在低极性组分。水相没有抗氧化活性,乙酸乙酯相和正丁醇相的自由基清除效果相近,当浓度为200 μg/mL时,乙醇粗提物的自由基清除率大于50%。
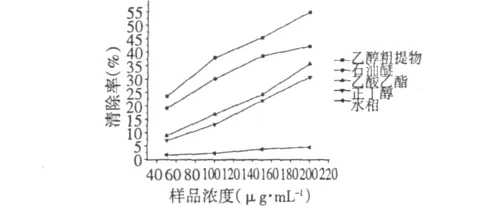
图1 各有机相粗提物的抗氧化活性Fig.1 Antioxidant activity of the organic phase crude extractings
2.3 各有机相粗提物的GC-MS分析
由图2和表2可以看出,石油醚相萃取物用GC-MS联用技术共鉴定出20种成分,包括13种酸类,2种碳烯,2种丁酯,1个烷醇,1个叶绿醇和1个三十四烷。,其中酸类物质含量最多,占69.93%;其次是酯类,占12.86%;碳烯类,占11.3%;醇类占的量较少,为5.91%。其中百分含量较多的成分有软脂酸,占总百分含量的33%;反式9-十六碳烯酸,占总百分含量的12.87%;邻苯二甲酸二丁酯,占总百分含量的12%。可见,石油醚相较好的抗菌和抗氧化活性物质主要为酯类化合物。
由图3和表3可以看出,正丁醇萃取物用GCMS联用技术共鉴定出20种成分,包括酸类、烷烃类、酯类、酮类和醇类,共占总百分含量的98.25%。其中含量最多的是酯类,达到40.5%;其次是醇类,为27.61%;酸类,占15.03%;烷烃类,占8.08%;酮类,占7.03%。百分含量在10%以上的有4种成分,分别为4-羟基-丁酸、甘油、邻苯二甲酸二乙酯和邻苯二甲酸二丁酯。
结果表明,石油醚组分中活性物质含量较多,且活性较好,乙酸乙酯相含量较少,但抗菌抗氧化活性和正丁醇相萃取物相当。由于乙酸乙酯相量较少,且其中组分大部分不可汽化,导致GC-MS分析所得数据较少,有待于进一步的研究。以下主要针对石油醚相进行分离纯化。

图2 石油醚相的GC-MS图谱Fig.2 The GC-MS map of the extracts in the petroleum ether phase

表2 石油醚相的GC-MS分析结果Table 2 The analysis results of The GC-MS map of the extracts in the petroleum ether phase

7 8.333 三十四烷Tetratriacontane 0.89 8 8.609 软脂酸甲酯Hexadecanoic acid,methyl ester 33 9 8.909 反式9-十六碳烯酸甲酯9-Hexadecenoic acid,methyl ester)- 12.84 10 9.631 十七酸甲酯Heptadecanoic acid,methyl ester 1.29 11 9.887 反式9-十八碳烯酸甲酯9-Octadecenoic acid(Z)-,methyl ester 2.38 12 10.65 十八烷酸甲酯Octadecanoic acid,methyl ester 0.49 13 10.905 8-十八碳烯酸甲酯8-Octadecenoic acid,methyl ester 7.19 14 11.459 9,12-亚油酸甲酯 9,12-Octadecadienoic acid(Z,Z)-,methyl ester 5.04 15 11.858 8-壬炔酸8-Nonynoic acid 0.68 16 12.106 邻苯二甲酸二异丁酯1,2-Benzenedicarboxylic acid,bis(2-methylpropyl)ester 0.86 17 12.298 亚麻酸甲酯 9,12,15-Octadecatrienoic acid,methyl ester,(Z,Z,Z)- 1.18 18 12.889 叶绿醇Phytol 5.45 19 14.367 邻苯二甲酸二丁酯Dibutyl phthalate 12 20 16.817 顺式-5,8,11,14,17-二十碳五烯酸甲酯 Methyl eicosa-5,8,11,14,17-pentaenoate 2.01

图3 正丁醇相的GC-MS图谱Fig.3 The GC-MS map of the extracts in the butanol phase

表3 正丁醇相的GC-MS分析结果Table 3 The analysis results of The GC-MS map of the extracts in the butanol phase

13 9.611 异丁基棕榈酸酯Hexadecanoic acid 2-methylpropyl ester 0.84 14 9.718 邻苯二甲酸二乙酯Diethyl Phthalate 13.61 15 11.103 二己烯丁酸酯 Butanoic acid,2-hexenyl ester,(E)- 0.57 16 11.758 1,2-苯二甲酸二(异丁基)酯 1,2-Benzenedicarboxylic acid,bis(2-methylpropyl)ester 9.79 17 11.983 顺式-1-异丙基-1,2-环己烷二醇 1,2-Cyclohexanediol,1-(1-methylethyl)-,cis- 1.75 18 12.234 1-十五烷醇1-Pentadecanol 0.23 19 12.408 环戊烷甲酸癸基酯 Cyclopentanecarboxylic acid,decyl ester 0.34 20 14.096 邻苯二甲酸二丁酯Dibutyl phthalate 12.09
2.4 石油醚相化合物的分离纯化
石油醚相经硅胶柱层析洗脱后在254 nm下测定吸光度得到峰Ⅰ、峰Ⅱ和峰Ⅲ三个组分(图4)。合并1~5管,15~20管,52~55管吹干备用,峰Ⅰ经Sephadex LH-20凝胶柱继续分离。峰Ⅰ经Sephadex LH-20凝胶柱分离后在254 nm下测吸光度得到Ⅰ-Ⅰ和Ⅰ-Ⅱ两个峰(图5),峰Ⅰ-Ⅰ经制备薄层层析石油醚∶丙酮5∶1纯化收集得单体化合物Ⅰ。

2.5 化合物Ⅰ纯度鉴定和结构分析
化合物Ⅰ经高效液相检测后纯度较好,进行结构分析后,其核磁共振结果如下:1H NMR(400 MHz,CDCl3),δ(ppm):5.35(1H,t,J=5.2 Hz,H-6),3.53(1H,m,H-3)。13C NMR(400 MHz,CDCl3),37.22(C-1),31.88(C-2),71.78(C-3),42.27(C-4),140.73(C-5),121.70(C-6),31.87(C-7),31.63(C-8),50.08(C-9),36.48(C-10),21.06(C-11),39.73(C-12),42.27(C-13),56.06(C-14),24.28(C-15),28.23(C-16),56.73(C-17),11.84(C-18),19.38(C-19),35.77(C-20),19.00(C-21),33.90(C-22),28.23(C-23),45.78(C-24),29.09(C-25),19.82(C-26),18.76(C-27),23.02(C-28),11.96(C-29)。无色针状结晶,熔点142~148℃,分子式C29H50O。以上数据经与文献[9,10]对比,确定该化合物为β-谷甾醇。
β-谷甾醇是一种植物固醇,近年来发现β-谷甾醇对肿瘤有防治作用,其可以通过抑制肿瘤细胞和基底膜的粘附及细胞侵入基底膜而阻止肿瘤细胞的转移[11],除此之外,β-谷甾醇还有降低血清胆固醇的作用,对于治疗Ⅱ型高血脂症及预防动脉粥样硬化有较好的效果。
3 结论
3.1 聚球藻石油醚、正丁醇及乙酸乙酯相提取物均有一定的抗菌和抗氧化活性,其中石油醚相和正丁醇相的活性较好,水相没有抗菌和抗氧化活性。
3.2 石油醚组分中活性物质含量较多,且活性较好,乙酸乙酯相含量较少,但抗菌抗氧化活性和正丁醇相萃取物相当,由此可见,聚球藻中的抗菌抗氧化活性物质主要集中在低极性组分,乙酸乙酯相和正丁醇相中的活性物质有待进一步研究。
3.3 从石油醚相中分离获得一单体化合物,经核磁分析确定为β-谷甾醇。
1 Wang CH(王长海),Xu SA(徐世艾),Zheng QS(郑秋生).Research Progress in Marine Biotechnology(海洋生物技术研究进展).Beijing:Chemical Industry Press,2005.78-84.
2 Ma Y(马英),Jiao NZ(焦念志).Research progress in molecular ecology of Synechococcus.Prog Nat Sci(自然科学进展),2004,14:967-972.
3 Hu ZQ(胡智泉),Liu YD(刘永定).The influence of Microcystis toxin on growing and physiological-biochemical characteristic of tenuous Synechococcus.Acta Hydrobio Sin(水生生物学报),2004,28:155-158.
4 Zhou J(周杰),Luo N(罗娜),Ning Y(宁叶).Pilot study onappearance of Mice metallothionein-Ⅰin Synechococcus 7002 by means of homologous recombination.Prog Biochem Biophys(生物化学与生物物理进展),2002,29:149-153.
5 Lu LN(卢丽娜),Sun LQ(孙利芹),Tian HL(田焕玲),et al.Total lipid content and fatty acidcomposition of 32 strains of marine microalgae.China Oil Fat(中国油脂),2009,34(11):68-73.
6 Liu J(刘健),Wang HY(王海雁),Zhao SJ(赵淑江).Measuring of antibacterial activity in vitro of gallnut to large yellow croaker pathogenic arc wormwood by means of Oxfordcup tests.Mar ences(海洋科学),2009,33(11):44-45.
7 Binsan W,Benjakul S,Visessanguan W,et al.Antioxidative activity of Mungoong,an extract paste,from the cephalothorax of white shrimp(Litopenaeus vannamei).Food Chem,2008,106:185-193.
8 Jiang HX(江红霞),Zheng Y(郑怡),Lin XP(林雄平),et al.Antimicrobial activities and chemical compositions of liposoluble compounds in Synechococcus aeruginosu.J Henan Agr Sci(河南农业科学),2010,11:66-69.
9 Cui YL(崔益冷),Mu Q(穆青),Hu CQ(胡昌奇).Studies on the chemical constituents of Caragana rosea.Chinese Pharma J(中国药学杂志),2004,39:172-174.
10 Naoyuki Koizumi,Yoshinori Fujimoto,Toru Takeshita,et al.Carbon-13 nuclear magnetic resonance of 24-substituted stenols.Chem Pharm Bull,1979,27:38-45.
11 Gao H,Wu L,Kuroyanagi M,et al.Antitumor-promoting constituents from Chaenomeles sinensis Koehne and their activities in JB6 mouse epidermal cells.Chem Pharm Bull(Tokyo),2003,51:1318-1321.
