液相色谱-串联质谱法快速测定食品中4种黄色工业染料
2013-10-25林黛琴万承波刘花梅
林黛琴,万承波,邱 萍,刘花梅
(1. 江西省产品质量监督检测院,江西 南昌 330029;2.南昌大学化学系,江西 南昌 330031)
液相色谱-串联质谱法快速测定食品中4种黄色工业染料
林黛琴1,万承波1,邱 萍2,刘花梅1
(1. 江西省产品质量监督检测院,江西 南昌 330029;2.南昌大学化学系,江西 南昌 330031)
为了快速、高效的检测食品中非法添加的工业染料,为食品安全监督检测提供技术依据,建立了高效液相色谱-串联质谱法(HPLC-MS/MS)定性定量分析食品中非法添加的碱性橙Ⅱ、碱性嫩黄O、酸性橙Ⅱ、酸性金黄4种黄色工业染料。样品用乙腈提取、离心后上清液过0.22 μm聚四氟乙烯膜,电喷雾离子源多反应监测(MRM)模式检测,空白基质曲线外标法定量,其中碱性橙Ⅱ、碱性嫩黄O采用正离子扫描模式(ESI+),酸性橙Ⅱ、酸性金黄采用负离子扫描模式(ESI-)进行检测,以超纯水(正离子扫描时水中含有0.1%甲酸)-乙腈为流动相,梯度洗脱,洗脱液流速0.3 mL/min。在优化的实验条件下,得到了较宽的线性范围和较低的定量检出限:碱性橙Ⅱ和碱性嫩黄O的线性范围均为5.0~200.0 μg/L,酸性橙Ⅱ和酸性金黄的线性范围均为5.0~100.0 μg/L,线性相关系数均在0.999以上;食品中碱性橙Ⅱ、碱性嫩黄O、酸性橙Ⅱ、酸性金黄的定量限分别为50、50、75、60 μg/kg。方法的回收率和重现性较好,4种染料的回收率在75.6%~119.0%之间,相对标准偏差(RSD)在3.1%~9.1%之间。该方法操作简单、灵敏度高、结果准确可靠,可应用于食品中4种非法添加工业染料的定量及确证分析。
碱性橙Ⅱ;碱性嫩黄O;酸性橙Ⅱ;酸性金黄;高效液相色谱-串联质谱法(HPLC-MS/MS)
碱性橙Ⅱ(basic orangeⅡ)、碱性嫩黄O(auramine O)、酸性橙Ⅱ(orange acidⅡ)、酸性金黄(metal yellow)都属于偶氮类工业染料,分子结构式示于图1,主要用于腈纶、家具、纸张、纺织品、皮革及化妆品的染色。这些染料具有致癌、致畸变性[1-2],对人体健康具有严重的危害,在我国这些染料被严禁作为食品添加剂使用[3]。卫生部印发的《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第一批)》中明确规定,食品中的碱性橙Ⅱ、碱性嫩黄O、酸性橙Ⅱ及酸性金黄属于违法添加物质。这些染料在中性或偏碱性条件下与蛋白质有较强的吸附作用,比食用色素更易给食品染色,染色后色泽鲜艳且不易褪色,价格又较低廉,因此常被一些不法食品加工商用来对豆制品、蜜饯、辣椒制品及黄鱼等食品进行染色,因此,针对此类工业染料建立简便、快速、高效的检测方法已势在必行。
目前这4种工业染料的检测方法多为高效液相色谱法[4-17]、液相色谱-质谱法[18-22]、气相色谱-质谱法[23-24]和薄层色谱法[25]。其中液相色谱法不能对目标化合物准确定性,会产生一些假阳性。文献报道的液相色谱-质谱法主要是结合固相萃取小柱测定的,这不仅使样品前处理步骤繁琐,也加长了样品检验的周期,并增加了实验成本。本工作采用简单的前处理步骤对各类具有代表性的食品进行同时快速检测,并确证被检食品中是否含有碱性橙Ⅱ、碱性嫩黄O、酸性橙Ⅱ及酸性金黄4种工业染料。
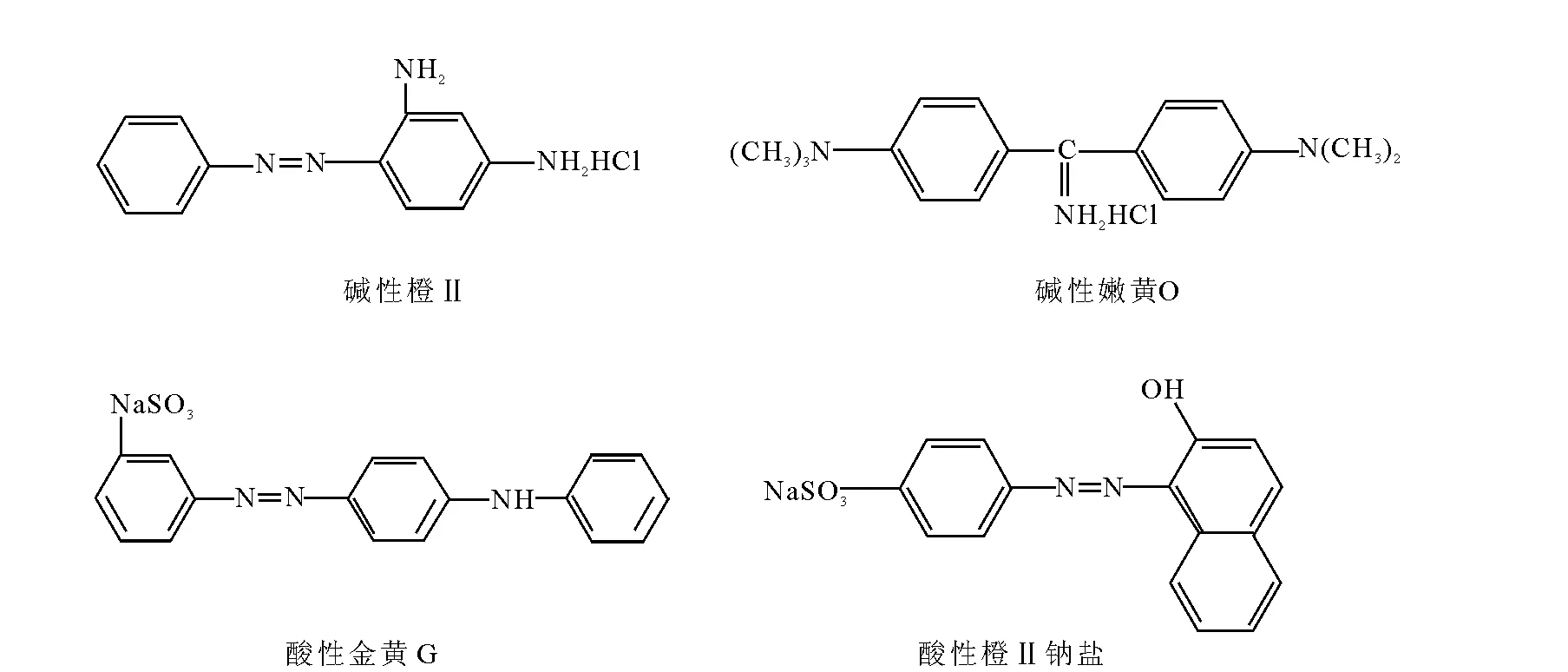
图1 4种染料的化学结构Fig.1 The chemical structures of four dyes
1 实验部分
1.1主要仪器
Agilent 6410A液相色谱-串联质谱联用仪:美国Agilent公司产品,配有Agilent 1200高效液相色谱仪及电喷雾离子源;Milli-Q超纯水器:美国Millipore公司产品;IKA T25均质器:德国IKA公司产品;SI Vortex Genie 2漩涡混合器:美国Scientific Industries公司产品;KQ-600DE型数控超声清洗仪:昆山市超声仪器有限公司产品;Sigma 3-18K低温离心机:德国Sigma公司产品;Eyela MMV-1000W振荡器:日本Eyela公司产品。
1.2主要材料与试剂
碱性橙Ⅱ、碱性嫩黄O(纯度>98%):美国Acros organics公司产品;酸性橙Ⅱ、酸性金黄(纯度>98%):德国Dr.Ehrenstorfer公司产品;乙腈(色谱纯):美国Honeywell有限公司产品;甲酸(色谱纯):美国Tedia公司产品;氯化钠(分析纯):国药集团化学试剂有限公司产品;Milli-Q超纯水;0.1 %甲酸水溶液。
混合标准工作溶液系列中碱性橙Ⅱ、碱性嫩黄O浓度系列为:5.0、20.0、50.0、100.0、200.0 μg/L;酸性橙Ⅱ和酸性金黄浓度系列为:5.0、20.0、50.0、100.0 μg/L。
1.3实验条件
1.3.1色谱条件 色谱柱:ZORBAX Eclipse XDB-C18柱(3.5 μm×2.1 mm×100 mm);进样量:5 μL;柱温:40 ℃;流速:0.3 mL/min;正离子扫描模式中流动相A:乙腈;流动相B:含0.1%甲酸水溶液。梯度洗脱:0~2.0 min,10%A;2.0~10.0 min,10%~100%A;10.0~13.0 min,100%A;13.0~13.1 min,100%~10%A;13.1~20.0 min,10%A。负离子扫描模式中流动相A: 乙腈;流动相B:超纯水。梯度洗脱:0.0~5.0 min,20%~100%A;5.0~8.0 min,100%~100%A;8.0~8.1 min,100%~20%A;8.1~15.0 min,20%A。
1.3.2质谱条件 ESI(+)离子源和ESI(-)离子源两种扫描模式,质谱参数一致。雾化气压力3.1×105Pa,毛细管电压4 000 V,离子源温度100 ℃,脱溶剂气温度350 ℃,脱溶剂气流速8 L/min。4种染料的监测离子对、保留时间、解离电压和碰撞电压等质谱分析优化参数列于表1。
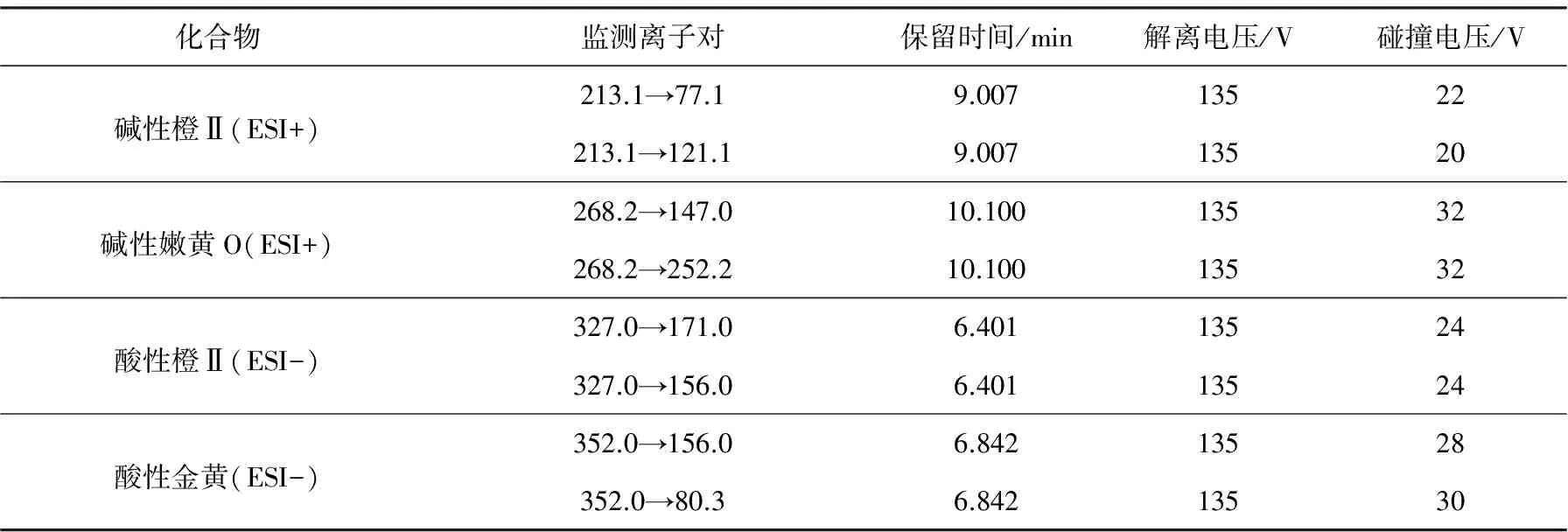
表1 4种染料的质谱分析优化参数
1.4样品制备
1.4.1固体样品 称取200 g调味品、肉制品等粉状、糊状固体样品,破碎均匀,然后称取2 g (精确至0.01g)固体样品置于50 mL离心管中,准确加入10 mL乙腈,涡旋1 min后,振荡5 min,超声提取30 min,于4 ℃冷冻离心机中以15 000 r/min离心10 min;移取乙腈层至另一离心管中,残渣用10 mL乙腈再次提取,合并有机相,定容至20 mL,加2.5 mL水和约0.5 g氯化钠,于-20 ℃冷冻2 h,取出后于0~4 ℃下以10 000 r/min离心5 min;从乙腈层取适量过0.22 μm聚四氟乙烯膜,LC-MS/MS测定。
1.4.2液体样品 称取5 g(精确到0.01 g)果汁或酒精饮料等样品于50 mL塑料离心管中,加入1 g氯化钠,20 mL乙腈,涡旋混匀15 s,震荡20 min,离心分层,收集上层有机相于50 mL塑料离心管内,剩余水相再加入20 mL乙腈提取1次,合并有机相,定容至50 mL,取适量过0.22 μm聚四氟乙烯膜,供LC-MS/MS测定。
1.4.3基质空白外标曲线的配制 分别称取2 g(精确至0.01 g)固体空白基质样品和5 g(精确到0.01 g)液体空白基质样品,每份样品按上述萃取过程进行处理,得到的基质提取液用于稀释标准储备液及高含量样品的溶液。
2 结果与讨论
2.1高效液相色谱条件的优化
分别对资生堂MGⅡ C18柱(5 μm×2.0 mm×150 mm)和ZORBAX Eclipse XDB-C18柱(3.5 μm×2.1 mm×100 mm)这两种不同高效液相色谱柱进行选择,其中资生堂MGⅡ C18柱对各组分分离效果较好,但色谱柱分离时间较长;ZORBAX Eclipse XDB-C18柱也能很好地分离各组分,且分离时间较短,因此本实验选择ZORBAX Eclipse XDB-C18柱作为高效液相色谱柱。考察乙酸铵(含0.1%甲酸)-乙腈、乙酸铵-乙腈、水(含0.1%甲酸)-乙腈、水-乙腈等不同的流动相体系,发现不同流动相体系中各组分的峰面积差别不是很明显,所以选择了简单的体系:水(含0.1%甲酸)-乙腈(正离子模式)和水-乙腈(负离子模式)。
2.2前处理条件优化
文献报道中常用于提取碱性橙和碱性玫瑰精的溶剂有乙醇溶液[4]、酸化甲醇、碱化甲醇溶液[5,21]、乙酸铵水溶液-甲醇-甲酸提取液[18,22]、70%乙醇水溶液[20]、甲醇溶液[19]等。本研究在分析腐竹、番茄酱、橄榄、香脆豆、黄鱼、酱油、果粒爽和辣椒粉等8种不同类型的样品时,分别对乙腈、70%乙醇水溶液、70%甲醇水溶液和乙醇氨溶液的提取效率进行了实验,4种提取溶液的提取率依次为:75.6%~92.3%、50.6%~63.0%、68.6%~87.0%、65.6%~89.0%。结果表明,对于不同种类的食品,乙腈提取效率更高,考虑到实验所用的流动相为乙腈,因此本方法最终选择乙腈作为提取溶剂。对于软饮料试样通过盐析作用使乙腈与水相分层;对于调味品、肉制品试样,采用冷冻和离心处理去除油脂及天然大分子色素。
2.3质谱定量定性
根据碱性橙Ⅱ和碱性嫩黄O分子结构的特征,选用电喷雾正离子(ESI+)电离模式对标准液进行Q1全扫描;而酸性橙Ⅱ钠盐和酸性金黄选用电喷雾负离子(ESI-)电离模式对标准液进行Q1全扫描。分别准确的找出各分子离子峰(见质谱条件1.3.2),继续对其子离子进行Q3全扫描,找出2~3个信号较强的碎片离子与母离子组成监测离子对,以多反应监测模式对待测物进行定性和定量检测,4种染料的定量离子为:m/z121.1(碱性橙Ⅱ)、m/z147.0(碱性嫩黄O)、m/z171.0(酸性橙Ⅱ)、m/z156(酸性金黄),其离子扫描图和解离图示于图2。
4种染料的裂解机理推断如下:碱性橙Ⅱ的氯化物m/z248.7脱氯断裂后得到分子离子m/z213.1,分子离子m/z213.1脱去苯环m/z77.1[C6H5]得到m/z136.1 [M+-C6H5],进一步脱去其中1个氨基得到m/z121.1[M+-C6H5-NH2];碱性嫩黄O的氯化物m/z303.8脱氯断裂后得到分子离子m/z268.2,分子离子m/z268.3脱去芳香胺上的甲基得到m/z252.2 [M+-H-CH3],分子离子m/z268.3脱去其中1个苯胺得到m/z147.1 [M+-C6H5NC2H6],m/z147.1进一步脱去酰胺得到m/z122.3 [M+-C6H4NC2H6-CN]),m/z122.3继续脱掉1个甲基得到m/z107.4;酸性橙Ⅱ的钠盐m/z350.3脱钠断裂后得到分子离子m/z327.2,分子离子m/z327.2在MS2中进行离子扫描,改变诱导碰撞能量,断开化学键得到特征碎片离子m/z155.8[C6H4SO3]和m/z170.9 [C10H7ON2];酸性金黄的钠盐m/z375.4脱钠断裂后得到分子离子m/z351.9,分子离子m/z351.9在MS2中进行离子扫描,改变诱导碰撞能量,断开化学键得到特征碎片离子m/z156和m/z80。
2.4工作曲线与定量检出限
采用液相色谱-串联质谱技术进行样品测定时,由于样品中待测组分痕量、样品基质复杂、提取净化步骤繁琐,通常使用同位素内标法校正操作过程中待测物质的损失。本实验研究的4种染料无法得到同位素内标物,为了考察基质离子抑制对定量结果的影响,在50.0、100.0、200.0μg/kg 3个添加水平下,分别采用空白样品提基质加标标准曲线及用乙腈溶液稀释标准储备液配制的标准曲线对其进行定量。结果发现,二者的回收率差异较大,不同样品的基质效应也不一样,离子化效率在45%~69%之间,可见存在基质减弱效应,严重影响实验的回收率,所以在实验中必须考虑扣除基质干扰,从而提高定量的准确性。本实验选择了基质空白加不同浓度标准溶液绘制工作曲线,进行外标法定量,其中碱性橙Ⅱ和碱性嫩黄O的质量浓度为:5.0、20.0、50.0、100.0、200.0 μg/L;酸性橙Ⅱ和酸性金黄的质量浓度为:5.0、20.0、50.0、100.0 μg/L。以4种染料的质量浓度为横坐标,以峰面积为纵坐标绘制工作曲线,得到线性回归方程及相关系数。根据基质空白工作曲线最低浓度点的响应值进行推算,当信噪比S/N=10时,对应的目标化合物含量为方法的定量检出限;当信噪比S/N=3时,对应的目标化合物含量为方法的定性检出限。4种染料混合标准溶液及辣椒基质和样品的MRM图示于图3。本方法的线性回归方程、线性范围、相关系数、检出限、定量限列于表2。
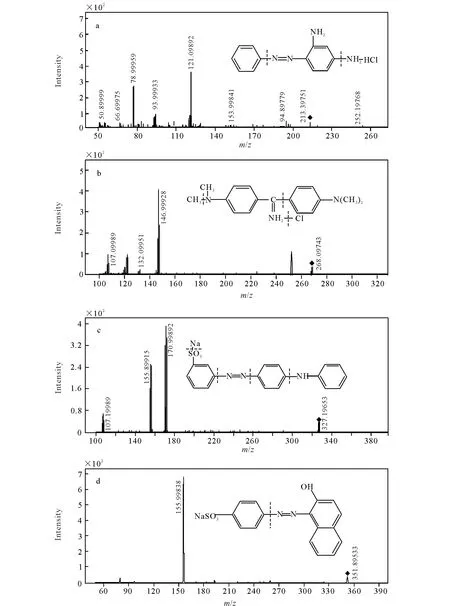
图2 碱性橙Ⅱ(a)、碱性嫩黄O(b)、酸性橙Ⅱ(c)及酸性金黄(d)的离子扫描图和解离图Fig.2 Product ion scans spectra and proposed fragmentation scheme of basic orange Ⅱ(a), auramine O(b), orange acid Ⅱ(c) and metal yellow(d)
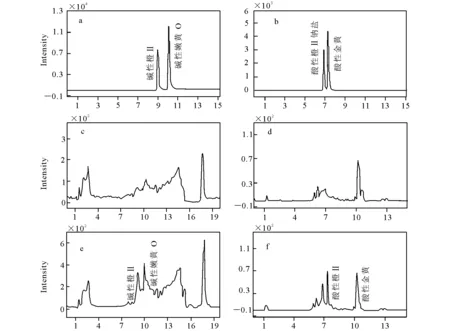
图3 4种染料混合标准溶液(a,b)、辣椒粉基质空白(c,d)、辣椒粉样品在检出限添加水平(e,f)的MRM谱图Fig.3 Multiple reaction monitoring chromatograms of a mixed standard solution of four yellow dyes(a,b), a blank chilipowder sample(c,d) and the blank Chilipowder sample spiked with four yellow dyes(e,f)

表2 4种黄色染料的线性回归方程、线性范围、相关系数、检出限、定量限
2.5回收率、精密度实验及实际样品检测
通过可靠途径,获得没有添加这些染料的腐竹、番茄酱、橄榄、香脆豆、黄鱼、酱油、果粒爽及辣椒粉8种样品,分别添加了3个不同浓度水平的混合标准溶液,每个添加水平重复测定6次,以基质空白工作曲线进行定量,计算回收率及精密度(以相对标准偏差表示),结果列于表3。结果发现,本方法有良好的精密度和准确度,可以满足痕量分析要求。应用上述方法分别检测了市场上的腐竹、番茄酱、橄榄、香脆豆、黄鱼、酱油、果粒爽及辣椒粉各3份样品,结果在某一品牌的辣椒粉中检测出了碱性橙Ⅱ和碱性嫩黄O,含量分别为0.36 mg/kg和3.076 mg/kg,可见仍有不法企业无视国家有关规定,将工业染料用于食品的染色。
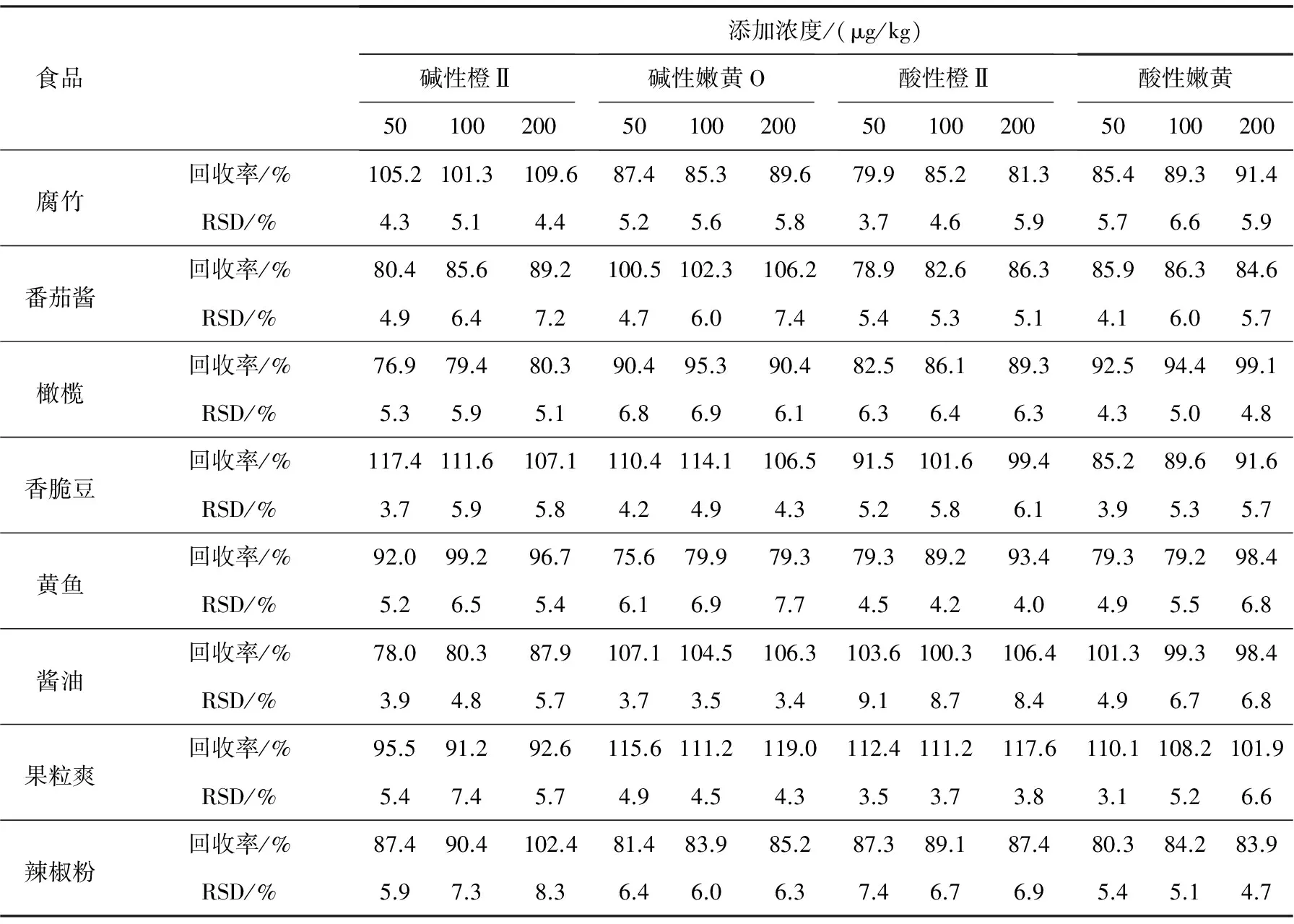
表3 不同食品中4种黄色染料的回收率和精密度
3 结论
本研究建立了高效液相色谱-串联质谱法(HPLC-MS/MS)定性定量分析食品中非法添加的碱性橙Ⅱ、碱性嫩黄O、酸性橙Ⅱ、酸性金黄4种黄色工业染料。本方法准确可靠,灵敏度高,前处理方法简单、快捷,测定结果令人满意,可应用于食品中碱性橙Ⅱ、碱性嫩黄O、酸性橙Ⅱ及酸性金黄的检测,可为食品安全监督检测提供有力的技术依据。
[1] IARC. Monographs on the evaluation of carcinogenic risk to humans, supplement 7:Overall evaluations of carcinogenicity: An Updating of IARC monographs[R]. International Agency for Research on Cancer,Lyon,France,1987:1-42.
[2] KIRSCH P, FLEIG I, FRENTZEL-BEYME R, et al. Auramine. Toxicology and occupational health (Ger.)Arbeitsmed. Sozialmed.Prventivm-ed[J].1978,13:1-28.
[3] GB2760—2011. 食品添加剂使用标准[S].北京:中国标准出版社,2011.
[4] 罗美中,李碧芳,何小青.高效液相色谱二极管阵列法测定豆制品中碱性嫩黄O的含量[J]. 分析检测, 2005,26(8): 166-170.
LUO Meizhong, LI B Fifang, HE Xiaoqing. Determination of auramine O in legume-food by high per-formance liquid chromatography-diode array detector[J]. Science and Technology of Food Industry, 2005, 26(8):166-170(in Chinese).
[5] 林 钦, 郑小严, 何树坤, 等. 高效液相色谱法同时检测食品中的碱性橙、碱性嫩黄O和碱性桃红T染料含量[J]. 食品科学, 2009,30(14):194-196.
LIN Qin, ZHENG Xiaoyan, HE Shukun, et al. Simultaneous high performance liquid chromatographic determination of chrysoidine, auramine O and safranine T in food[J].Food Science, 2009,30(14):194-196(in Chinese).
[6] 赵 宏,图 雅,胡 芬.高效液相色谱法测定辣椒粉中的碱性橙[J]. 中国卫生检验杂志, 2012,22(1):19-20.
ZHAO Hong, TU Ya, HU Fen. HPLC method for the determination of basic orange in paprika[J]. Chinese Journal of Health Laboratory Technology, 2012,22(1):19-20(in Chinese).
[7] 谢维平,欧阳燕玲,黄盈煜,等.超高效液相色谱同时测定食品中4种工业染料[J].中国食品卫生杂志, 2012,24(4):329-332.
XIE Weiping, OUYANG Yanling, HUANG Yingyu, et al. Simultaneous determination of four industrial dyes in foods by ultra high performance liquid chromatography[J].Chinese Journal of Food Hygiene, 2012,24(4):329-332(in Chinese).
[8] 尹 华,陆卫明.高效液相色谱法同时测定食品中酸性橙Ⅱ染料和多种合成色素[J]. 卫生研究, 2012,41(4):646-648.
YUN Hua, LU Weiming. Simultaneous determination of Chrysoidine and colorants in food by high performance liquid chromatography[J]. Journal of Hygiene Research,2012,41(4):646-648(in Chinese).
[9] 卢彩霞,陈 艳,李永波.高效液相色谱法测定豆制品中酸性橙Ⅱ和酸性金黄[J].实用医技杂志,2006, 1(15):2 594-2 595.
LU Caixia, CHEN Yan, LI Yongbo. High performance liquid chromatography determinate of acid orange Ⅱ and orarge bin bean sample[J].Journal of Practical Medical Techniques, 2006, 1(15):2 594-2 595(in Chinese).
[10] 张秀尧,蔡欣欣.反相高效液相色谱法快速测定食品中违规使用的酸性橙Ⅱ染料[J].中国卫生检验杂志, 2004, 14(2):204-204.
ZHANG Xiuyao, CAI Xinxin. Determinate of acid orange Ⅱ in food by reversed-phase liquid chromatography [J]. Chinese Journal of Health Laboratory Technology,2004, 14(2):204(in Chinese).
[11] 江迎鸿, 陈亚波,邱舜钿,等.超声提取-高效液相色谱法测定食品中碱性橙Ⅱ染料[J]. 食品研究与开发, 2009,30(7):153-155.
JIANG Yinghong, CHEN Yabo, QIU Shundian, et al. Determination of basic orangeⅡ in foods by ultrasonic extraction and high performance liquid chromatography[J]. Food Research and Development, 2009,30(7):153-155(in Chinese).
[12] 李亚森,潘 英,陈 艳. 用HPLC法测定食品中酸性橙Ⅱ和酸性金黄的探讨[J]. 职业与健康, 2008,18(2):104-105.
LI Yasen, PAN Ying, CHEN Yan. Application of HPLC method in the determination of acid orange Ⅱ and acid curcumin in food[J]. Occupation and Health, 2008,18(2):104-105(in Chinese).
[13] 谷 岩,崔松林,周 宇,等.高效液相色谱法测定辣椒粉中碱性橙、玫瑰精含量[J]. 分析测试技术与仪器, 2006,12(4):202-204.
GU Yan, CUI Songlin, ZHOU Yu, et al. High-performance liquid chromatography diode array detection method for basic brilliant orange G and rhodamine B in cayenne[J]. Analysis and Testing Technology and Instruments, 2006,12(4):202-204(in Chinese).
[14] 王建伟,钟海娟,梁炽琼.固相萃取-超高效液相色谱串联质谱法测定食品中碱性橙、碱性嫩黄O[J]. 分析测试技术与仪器, 2010,16(2):108-112.
WANG Jianwei, ZHONG Haijun, LIANG Chiqiong. Determimation of chrysoidin and auramine O in food by solid phase extraction-ultra performance liquid chromatography-mass spectrometry[J]. Analysis and Testing Technology and Instruments, 2010,16(2):108-112(in Chinese).
[15] 徐 琴,刘 琳,傅余强,等.高效液相色谱法测定食品中的酸性橙Ⅱ[J]. 食品科学, 2010,31(8):219-222.
XU Qin, LIU Lin, FU Yuqiang, et al. HPLC Determination of acid orange Ⅱ in foods[J]. Food Science, 2010,31(8):219-222(in Chinese).
[16] 刘峥颢,匡林鹤,夏立娅,等.辣椒面中非食用着色剂酸性Ⅱ的定量和定性检测的研究[J]. 食品科技, 2007,(12):178-180.
LIU Zhenghao, KUANG Linhe, XIA Liya. Study of the inspection of non-food color acid orange II in chilly powder[J]. Food Science and Technology, 2007,(12):178-180(in Chinese).
[18] 赵 榕, 赵海燕, 李 兵, 等. 建立同时测定调味品中非法添加的4种工业染料的S PE-UPLC-MS/MS法研究[J]. 中国食品卫生杂志, 2009, 5(21): 410-414.
ZHAO Rong, ZHAO Haiyan, LI Bing, et al. Simultaneous determination of 4 kinds of illegally added industrial dyes by SPE-UPLC-MS/MS[J]. Chinese Journal of Food Hygiene, 2009, 5(21): 410-414(in Chinese).
[19] 张海琪, 梁丽军, 何中央, 等. 水产品中碱性嫩黄O残留量的液相色串联质谱测定[J]. 质谱学报, 2010, 21(1)48-52.
ZHANG Haiqi, LIANG Lijun, HE Zhongyang, et al. Determination of auramine O in fishery products by high-performance liquid chromatography-electrospray tandem mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2010, 21(1):48-52(in Chinese).
[20] 陈春晓, 刘红河, 仲岳桐,等.食品中酸性橙Ⅱ的HPLC-MS/MS测定方法研究[J]. 中国卫生检验杂志, 2008, 11(18): 2 209-2 211.
CHEN Chunxiao, LIU Honghe, ZHONG Yuntong, et al. Application of high performance liquid chromatography combined with tandem mass spectrometry in determining acid orange Ⅱ in food[J]. Chinese Journal of Health Laboratory Technology, 2008, 11(18): 2 209-2 211(in Chinese).
[21] 郑小严. 超高效液相色谱串联质谱法同时测定食品中碱性橙、碱性嫩黄O和碱性桃红T[J]. 分析科学学报, 2009, 25 (4): 409-413.
ZHENG Xiaoyan. Simultaneous determination of chrysoidine,Auramine O and safranine T in foods by ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Science, 2009, 25 (4): 409-413(in Chinese).
[22] 林赛君, 屠海云, 孙 岚, 等. 高效液相色谱串联质谱法同时测定食品中五种黄色化工染料[J]. 色谱, 2011, 29 (1):79-82.
LIN Saijun,TU Haiyun, SUN Lan, et al. Simultaneous determination of five yellow dyes in foods by high performance liquid chromatography coupled with tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2011, 29 (1):79-82(in Chinese).
[23] 王 翔. GC/MS法测定鱼类产品中的碱性橙见[C]. 2008年全国生物医药色谱交流会论文集, 2008:257-258.
WANG Xiang. Determination of acid orange Ⅱ in Fish Foods by using GC/MS[C]. The collection of the theses about the national biomedical chromatography Exchange Conference,2008:257-258(in Chinese).
[24] 高鸣翔,张家树,蔡 颖,等. GC/MS测定腐皮中碱性橙Ⅱ的含量[J].化学世界, 2012,1:30-31.
GAO Mingxiang, ZHANG Jiashu, CAI Ying, et al. Determination of acid orange Ⅱ in bean curd shin by using GC/MS[J].Chemical World, 2012,1:30-31(in Chinese).
[25] 夏立娅, 韩媛媛, 匡林鹤,等.薄层色谱扫描法同时检测豆制品中碱性橙、皂黄、柠檬黄和日落黄以及辣椒粉中酸性橙II、丽春红2R和罗丹明B[J].分析试验室, 2010, 29(6):15-18.
XIA Liya, HAN Yuanyuan, KUANG Linhe, et al. Simultaneous determination of basic orange2, metanil yellow, tartrazine, sunset yellow in bean-product and acid orange Ⅱ,ponceau 2R, rhodanmine B in chili powder by thin-layer chromatographic scanning[J].Chinese Journal of Analysis Laboratory, 2010, 29(6):15-18(in Chinese).
RapidDeterminationofFourHighYellowDyesinFoodsbyHPLC-MS/MS
LIN Dai-qin1, WAN Cheng-bo1, QIU Ping2, LIU Hua-mei1
(1.JiangxiInstituteofSupervision&InspectiononProductQuality,Nanchang330029,China;2.DepartmentofChemistry,NanchangUniversity,Nanchang330031,China)
A method based on high performance liquid chromatography coupled with tandem mass spectrometry (HPLC-MS/MS) was developed for rapid determination of the residues of four yellow industrial dyes(basic orangeⅡ, auramine O, orange acidⅡand metal yellow) in foods. The sample were extracted by acetonitrile, and then analyzed in multiple reaction monitoring (MRM) mode. Sample matrix-matched calibration was used to determine the residue contents by external standard. Basic orangeⅡ and auramine O were detected with positive ion model, while orange acidⅡ, metal yellow were detected with negative ion model. The mobile phase was ultrapure water (containing 0.1% formic acid for positive ion model)-acetonitrile. Under the optimized detection conditions, the linear ranges for basic orangeⅡ and auramine O are 5.0—200.0 μg/L, and for orange acidⅡand metal yellow are 5.0—100.0 μg/L, the linear correlation coefficients are all more than 0.999. The limits of quantification of basic orangeⅡ, auramine O, orange acidⅡand metal yellow are 50, 50, 75, 60 μg/kg, respectively. The recoveries of 4 dyes range from 75.6% to 119.0% with relative standard deviations (RSD) of 3.1%—9.1%.This method is simple, effective, sensitive, which is suitable for the determination and confirmation of four industrial dyes added in the foods illegally.
basic orangeⅡ; auramineO; orange acidⅡ; metal yellow; high performance liquid chromatography coupled with mass spectrometry (HPLC-MS/MS)
O 657.63
A
1004-2997(2013)05-0170-09
10.7538/zpxb.2013.34.03.0170
2012-12-20;
2013-02-05
江西省质量技术监督局科技项目(GZJK201004)资助
林黛琴(1979~),女(汉族),江西东乡人,分析化学专业。E-mail: zzl0711@126.com
