盐皮质激素受体在博来霉素诱导的实验性肺纤维化中的作用*
2013-10-24胡道川姬文婕陈雪芬马永强魏路清
胡道川, 姬文婕, 陈雪芬, 马永强, 周 欣, 魏路清△
(武装警察部队后勤学院附属医院 1呼吸与重症医学科, 2心脏中心,武警部队心血管病研究所, 天津 300162)
▲并列第1作者
盐皮质激素受体在博来霉素诱导的实验性肺纤维化中的作用*
胡道川1▲, 姬文婕1▲, 陈雪芬1, 马永强1, 周 欣2, 魏路清1△
(武装警察部队后勤学院附属医院1呼吸与重症医学科,2心脏中心,武警部队心血管病研究所, 天津 300162)
目的研究盐皮质激素受体(MR)在博来霉素诱导的实验性肺纤维化进展过程中的作用及机制。方法将126只6~8周龄雄性C57BL/6小鼠随机分为对照组、博来霉素组和MR阻断剂螺内酯干预组,气管内一次性滴注博来霉素(2.5 mg/kg)溶液建立实验性小鼠肺纤维化模型,螺内酯干预组每天按螺内酯20 mg/kg经灌胃给药。于术后12 h、1 d、2 d、3 d、7 d、14 d和28 d处死小鼠,采用HE染色和Masson染色观察肺组织病理学变化及纤维化程度,采用real-time PCR检测各组肺组织中胶原1(Col1)、Col3、转化生长因子β(TGF-β)、单核细胞趋化蛋白1(MCP-1)及MR mRNA的表达水平。结果(1)与对照组小鼠相比,博来霉素组及螺内酯干预组小鼠在滴注博来霉素后经历了典型的急性炎症期(12 h~3 d)、纤维化进展期(14 d)和纤维化晚期(28 d)。阻断MR下调早期炎症反应并减轻了纤维化程度。(2)螺内酯干预可以有效降低MR mRNA表达水平;阻断MR在急性炎症期显著下调MCP-1 mRNA的表达,在14 d显著下调TGF-β、Col1和Col3 mRNA表达水平。结论(1)阻断MR可以明显减轻博来霉素诱导的肺纤维化程度;(2)阻断MR可能通过在急性炎症期调节MCP-1和TGF-β的表达,减轻炎症反应,并在纤维化进展期,下调TGF-β的表达,从而抑制肺纤维化的进展。
肺纤维化; 受体,盐皮质激素; 博来霉素; 螺内酯
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是一种原因不明的进展性、致死性的纤维化性间质性肺炎。目前,IPF的发病机制尚不明确,尚无有效治疗手段。IPF患者诊断后的平均存活时间仅为2~5年[1]。盐皮质激素受体(mineralocorticoid receptor, MR)是一种典型的胞核甾体类激素受体,它的经典配体为醛固酮。MR在机体内表达广泛。在肾脏、肺脏、免疫系统、神经组织以及心脏等部位均有表达[2]。MR活化除了调节水盐平衡以外,还参与诱导炎性反应、胶原形成、纤维化、细胞坏死、代谢综合征等病理生理过程[3]。目前,鲜有关于MR与肺纤维化关系的研究。本研究使用博来霉素诱导的小鼠肺纤维化模型,采用MR阻断剂(螺内酯)阻断MR,检测MR、单核细胞趋化蛋白1(monocyte chemoattractant protein 1, MCP-1)、转化生长因子 β(transforming growth factor β, TGF-β)mRNA在纤维化过程中的表达情况,探讨MR在博来霉素诱导的实验性肺纤维化进展过程中的作用及分子机制。
材 料 和 方 法
1动物
健康雄性C57BL/6小鼠,6~8周龄,体重16~20 g,由中国人民解放军军事医学科学院实验动物中心提供,许可证号为SCXK-(军)2007-004。
2主要试剂
注射用盐酸平阳霉素(博来霉素A5,天津太河制药有限公司),螺内酯(Sigma),TRIzol Reagent(Invitrogen),MMLV反转录酶、dNTPs(Promega),SYBR Green实时定量PCR试剂盒(Roche),戊巴比妥钠(Sigma),其余国产试剂均为分析纯。
3主要方法
3.1动物模型的制备、标本的采集与处理 随机将126只C57BL/6小鼠分为对照组(control)、博来霉素组(bleomycin, Bleo)和螺内酯(spironolactone, Spiro)干预组(Bleo+Spiro),每组42只。腹腔内注射戊巴比妥钠(40 mg/kg)对小鼠进行麻醉后,在无菌条件下,于颈部正中纵向剪开皮肤,逐层分离肌肉,暴露气管。博来霉素组按剂量2.5 mg/kg体重,经气管内一次性注入博来霉素生理盐水溶液0.05 mL,按摩胸腔,使药物分布均匀。最后缝合皮肤,常规喂养。对照组气管内注入等体积生理盐水。螺内酯干预组螺内酯按20 mg/kg,每天1次,经灌胃给药。各组小鼠分别于模型制备完毕后第12 h、1 d、2 d、3 d、7 d、14 d和28 d,麻醉后摘眼球放血致死,每组各取6只,开胸将肺脏连同气管取出,分离左肺,4%多聚甲醛溶液固定,经石蜡包埋切片,行HE染色和Masson染色;右肺冻存于液氮中,用于肺组织RNA的提取与分析。
3.2病理学分析 肺组织经4%多聚甲醛固定后常规石蜡包埋,切片(5 μm),按常规方法进行HE染色和Masson染色,在光学显微镜下观察肺组织的炎症反应和纤维化程度。
3.3实时定量PCR检测肺组织中目的基因的表达 按照试剂说明书标准操作步骤,采用TRIzol Reagent提取各组组织的总RNA,Nanodrop 2000c紫外/可见分光光度仪对其定量。RNA甲醛变性电泳法验证其完整性后将其反转录成cDNA,然后以SYBR Green法进行PCR扩增,每个样本设置2个复孔,实验结果重复3次。根据GenBank数据库中目的基因cDNA序列,使用Primer Premier 6.0软件设计特异性引物,由北京三博远志生物技术有限公司合成,序列见表1。

表1 目的基因引物序列
F: forward primer; R: reverse primer.
4统计学处理
采用SPSS 19.0软件分析,计量资料以均数±标准差(mean±SD)表示。组间比较采用t检验和方差分析。以P<0.05为差异有统计学意义。
结 果
1各组小鼠肺组织的病理学变化
光镜下可见,对照组小鼠肺组织结构基本正常,未见明显炎症细胞浸润,肺间质未见胶原沉积。博来霉素组小鼠在滴注博来霉素后第3天表现为明显的急性炎症反应,肺泡壁水肿,肺间质内可见炎症细胞浸润;第7天肺泡间隔增厚,可见大量炎症细胞浸润,Masson染色示肺间质少量胶原沉积;第14天炎症细胞浸润明显减少,肺泡间隔明显增厚,胶原沉积明显增多,肺泡结构破坏、塌陷;第28天肺泡结构明显破坏,肺泡腔融合,肺间质胶原沉积较第14天有所减少。与对照组小鼠相比,博来霉素组小鼠在滴注博来霉素后经历了典型的急性炎症期(12 h~3 d)、纤维化进展期(14 d)和纤维化晚期(28 d),见图1。

Figure 1. Histologic evaluation of control and bleomycin-treated (3, 7, 14 and 28 d) mouse lung tissues (×200).
图1对照组和实验组小鼠在滴注博来霉素后第3天、7天、14天和28天肺组织HE染色和Masson染色
与博来霉素组相比,螺内酯干预后的小鼠肺脏炎症反应明显减轻,炎症细胞浸润减少,见图2;在纤维化进展期(14 d),螺内酯干预组纤维化程度显著减轻,胶原沉积面积统计存在显著差异,见图3。
2肺组织中胶原1(collagen1,Col1)和Col3mRNA的表达
与博来霉素组相比,螺内酯干预组在第14天Col1 mRNA表达水平显著降低(P<0.05),见图4A;Col3 mRNA表达量在第7天和第14天均显著下降(P<0.05和P<0.01),见图4B。
3肺组织中MR、MCP-1和TGF-βmRNA的表达
在急性炎症期和纤维化进展期,螺内酯干预组肺组织中MR mRNA表达水平较博来霉素组显著降低,见图5A。
博来霉素组小鼠肺组织中MCP-1 mRNA表达水平在急性炎症期明显高于对照组及螺内酯干预组,此外还显著高于其第7天和第14天的表达水平(P<0.05);螺内酯干预组MCP-1 mRNA的表达水平显著下调,见图5B。
在第3天,与博来霉素组相比,螺内酯干预组小鼠肺组织中TGF-β mRNA的表达显著增高(P<0.05),第14天,螺内酯干预组TGF-β mRNA的表达水平明显下降(P<0.01),见图5C。
讨 论
博来霉素诱导的小鼠肺纤维化模型是目前应用最广泛的IPF模型[4]。给予博来霉素后首先引起小鼠肺上皮细胞损伤,继而导致以中性粒细胞和淋巴细胞为主的炎症反应,最终导致肺纤维化。在炎症反应期,多种炎症趋化因子、细胞因子和生长因子的表达升高[5]。这些介质通过募集、活化和促进成纤维细胞、巨噬细胞、中性粒细胞和肌成纤维细胞增殖来发挥其促纤维化作用。炎症反应对于肺纤维化的发生、发展起到至关重要的作用。
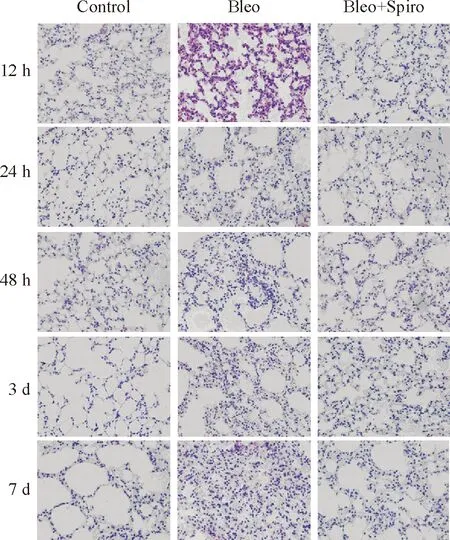
Figure 2. Histologic changes of lung tissues from each group 12 h, 24 h, 48 h, 3 d and 7 d after intratracheal instillation of bleomycin(HE staining,×200).
图2各组小鼠在第12h、24h、48h、3d和7d肺组织HE染色
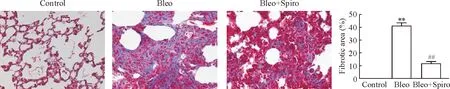
Figure 3. Masson trichrome staining (×200) revealed that pulmonary fibrosis was attenuated in Bleo+Spiro-treated mice on the 14th day after intratracheal instillation of Bleo.Mean±SD.n=6.**P<0.01vscontrol;##P<0.01vsBleo.
图3各组小鼠在第14天肺组织Masson染色
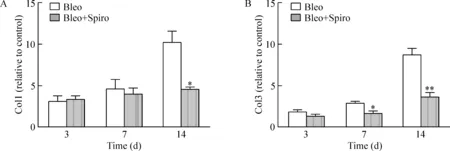
Figure 4. Expression of collagen 1 (Col1) mRNA (A) and Col3 mRNA (B) in Bleo and Bleo+Spiro groups.Mean±SD.n=6.*P<0.05,**P<0.01vsBleo.
图4螺内酯干预后小鼠肺脏中Col1和Col3mRNA表达水平显著下降

Figure 5. Expression of MR (A), MCP-1 (B) and TGF-β (C) mRNA in Bleo and Bleo+Spiro groups.*P<0.05,**P<0.01vsBleo+Spiro;#P<0.05vsBleo at 7 d.
图5螺内酯干预后小鼠肺脏中MR、MCP-1和TGF-βmRNA表达水平
MR是一种典型的胞核甾体类激素受体,它的经典配体为醛固酮。MR在机体内分布广泛,并发挥着多种生物学功能。MR参与调节水盐平衡、诱导炎性反应、纤维化、细胞凋亡、代谢综合征等病理生理过程,MR的活化可以增强NAPDH氧化酶的活性,产生大量氧自由基[6]。Habibi等[7]阐明氧化应激水平的上调是MR介导纤维化的关键机制之一。MR在免疫细胞如单核细胞、B淋巴细胞和T淋巴细胞均有表达。MR的活化状态与免疫状态密切相关。MR活化可以诱导免疫细胞从血管渗出,增加促炎因子的产生与释放,促进炎症状态[2]。Bergmann等[8]发现激活的MR可以通过激活NF-κB,诱导炎症细胞分泌MCP-1、IL-1、TNF-α等大量的促炎因子,从而诱导免疫系统处于激发状态。这些炎症因子在纤维化的起始环节发挥了非常重要的作用[9]。MR的激活可以上调如TGF-β的合成与分泌[10]。转化生长因子是肺纤维化发病过程中最重要的细胞活性物质。转化生长因子可以促进EMT,激活成纤维细胞转变成肌成纤维细胞,并直接刺激成纤维细胞合成、分泌大量细胞外基质,促进肺纤维化的发展[11]。Rickard等[12]研究发现通过基因敲除巨噬细胞的MR可以抑制去氧皮质酮/盐诱导的心肌纤维化,许明等[13]也发现使用安体舒通抑制MR可以改善自发性高血压大鼠的心肌纤维化。
目前,鲜有关于MR与肺纤维化关系的研究。本研究发现,MCP-1 mRNA表达趋势与MR相一致。在急性炎症期博来霉素组小鼠MCP-1 mRNA表达量明显高于对照组。阻断MR可能通过调控MCP-1的表达,进而减轻炎症反应。此外,本研究还发现,在给予博来霉素后第3天,阻断MR还可能通过上调TGF-β的表达,发挥抗炎作用;而在第14天,博来霉素组小鼠肺脏中TGF-β的合成与分泌显著升高,促进肺纤维化。
综上所述,MR参与了肺纤维化的发生与进展过程,阻断MR可能主要通过影响MCP-1和TGF-β的表达,减轻早期炎症反应,并在纤维化进展期抑制TGF-β的合成,从而发挥抑制肺纤维化的作用。下一步研究拟通过阻断或者激活MR的体内外实验,探讨MR在肺纤维化中发挥促纤维化作用的具体分子机制及其作为肺纤维化预防和治疗靶点的可能性。
[1] Raghu G, Collard HR, Egan JJ, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management [J]. Am J Respir Crit Care Med, 2011, 183(6):788-824.
[2] Herrada AA, Campino C, Amador CA, et al. Aldosterone as a modulator of immunity: implications in the organ damage [J]. J Hypertens, 2011, 29(9):1684-1692.
[3] Parthasarathy HK, MacDonald TM. Mineralocorticoid receptor antagonists [J]. Curr Hypertens Rep, 2007, 9(1):45-52.
[4] Moore BB,Hogaboam CM. Murine models of pulmonary fibrosis [J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(2):L152-L160.
[5] Wilson MS, Wynn TA. Pulmonary fibrosis: pathogenesis, etiology and regulation [J]. Mucosal Immunol, 2009, 2(2):103-121.
[6] Dharmashankar K, Widlansky ME. Vascular endothelial function and hypertension: insights and directions [J]. Curr Hypertens Rep, 2010, 12(6):448-455.
[7] Habibi J, DeMarco VG, Ma L, et al. Mineralocorticoid receptor blockade improves diastolic function independent of blood pressure reduction in a transgenic model of RAAS overexpression [J]. Am J Physiol Heart Circ Physiol, 2011, 300(4):H1484-H1491.
[8] Bergmann A, Eulenberg C, Wellner M, et al. Aldosterone abrogates nuclear factor κB-mediated tumor necrosis factor alpha production in human neutrophils via the mineralocorticoid receptor [J]. Hypertension, 2010, 55(2):370-379.
[9] King TE Jr, Pardo A, Selman M. Idiopathic pulmonary fibrosis [J]. Lancet, 2011, 378(9807):1949-1961.
[10] Hisaki R, Fujita H, Saito F, et al. Tempol attenuates the development of hypertensive renal injury in Dahl salt-sensitive rats [J]. Am J Hypertens, 2005, 18(5 Pt 1):707-713.
[11] Strieter RM, Mehrad B. New mechanisms of pulmonary fibrosis [J]. Chest, 2009, 136(5):1364-1370.
[12] Rickard AJ, Morgan J, Tesch G, et al. Deletion of mineralocorticoid receptors from macrophages protects against deoxycorticosterone/salt-induced cardiac fibrosis and increased blood pressure [J]. Hypertension, 2009, 54(3):537-543.
[13] 许 明, 杨汉东, 闵新文, 等. 安体舒通改善自发性高血压大鼠心肌纤维化[J]. 中国病理生理杂志, 2008, 24( 7): 1281-1285.
Roleofmineralocorticoidreceptorinbleomycin-inducedpulmonaryfibrosis
HU Dao-chuan1, JI Wen-jie1, CHEN Xue-fen1, MA Yong-qiang1, ZHOU Xin2, WEI Lu-qing1
(1DepartmentofRespiratoryMedicineandIntensiveCareUnit,2CardiacCenter,InstituteofCardiovascularDiseases,HospitalAlliliatedtoLogisticsUniversityofChinesePeople’sArmedPoliceForces,Tianjin300162,China.E-mail:luqing-wei@163.com)
AIM: To investigate the role of mineralocorticoid receptor (MR) in the lungs of experimental fibrotic mice.METHODSC57BL/6 male mice (6~8 weeks old) were randomly divided into control group, bleomycin treatment group (Bleo) and bleomycin+spironolactone treatment group (Bleo+Spiro). For induction of pulmonary fibrosis, the mice were administered bleomycin at dose of 2.5 mg/kg dissolved in 50 μL saline by the intratracheal route or given 50 μL sterile saline as control. The mice in Bleo+Spiro group were treated with spironolactone (20 mg/kg) daily by oral gavage throughout the experiment. The mice were sacrificed at 12 h, 1 d, 2 d, 3 d, 7 d, 14 d and 28 d after administration of bleomycin. HE staining and Masson’s trichrome staining were used to conduct histopathologic examination. The mRNA expression levels of collagen 1 (Col1), collagen 3 (Col3), transforming growth factor beta (TGF-β), monocyte chemoattractant protein 1 (MCP-1), and MR were examined by real-time PCR.RESULTSThe results of histological analysis revealed the classical pathological stages of bleomycin-induced lung fibrosis, including acute inflammation phase (from 12 h to 3 d), progressive fibrosis phase (14 d) and late fibrosis phase (28 d). Compared with Bleo group, the inflammatory responses of the lungs in Bleo+Spiro group were attenuated in the acute inflammation phase and the degree of fibrosis was significantly reduced at 14 d after administration of bleomycin. Treatment with spironolactone effectively down-regulated the mRNA expression of MR. The levels of MCP-1 (in the acute inflammation phase), TGF-β (at 14 d), Col1 and Col3 (at 14 d) were also significantly reduced.CONCLUSIONBlockage of MR significantly attenuates the degree of bleomycin-induced pulmonary fibrosis by regulating the production and secretion of MCP-1 and TGF-β, thus reducing the degree of inflammation and inhibiting the expression of TGF-β in the progressive fibrotic phase.
Pulmonary fibrosis; Receptors, mineralocorticoid; Bleomycin; Spironolactone
R329.21
A
10.3969/j.issn.1000- 4718.2013.11.022
1000- 4718(2013)11- 2039- 05
2013- 06- 19
2013- 09- 27
国家自然科学基金资助项目(No.81102088);天津市应用基础研究面上项目(No.11JCYBJC11800;No.12JCYBJC16600);武警医学院博士启动基金资助项目(No.WYB201108)
△通讯作者 Tel: 022-60577559; E-mail: luqing-wei@163.com
