磷酸化MEK2(Thr394)在结直肠癌中的表达及其临床意义*
2013-12-01王道海黄美近刘焕亮汪建平
彭 慧, 王道海, 胡 英, 王 磊, 黄美近, 刘焕亮, 汪建平△
(1中山大学附属第六医院结直肠外科,2中山大学胃肠病研究所,广东广州510655;
3河南省肿瘤医院普外科,河南郑州450008;4中山大学附属第一医院特诊中心,广东广州510080)
结直肠癌(colorectal cancer,CRC)的形成和发展是一个多因素多阶段的复杂病理过程,其涉及到肠上皮细胞的增殖、分化、凋亡、逃避反应机制,而这些机制均由细胞内外的信号转导途径所调控。信号转导途径的异常往往导致细胞增殖和凋亡失控,与结直肠癌的发生密切相关[1-2]。丝裂原活化蛋白激酶(mitogen-activaited protein kinase,MAPK)通路是细胞信号转导的重要途径,可以将多种细胞外信号通过磷酸化活化逐级传递至细胞内,参与细胞生长、分裂、分化及凋亡等多种生理过程,并在细胞恶性转化中起重要作用[3-6]。MAPK信号转导途径中的关键调节因子——丝裂原细胞外激酶1/2(mitogen extracellular kinase 1/2,MEK1/2)可被多种炎症因子、生长因子和环境应激反应等通过磷酸化而激活,从而产生不同的生物学效应。研究发现MEK1/2的多个磷酸化位点的生物学效应与结直肠癌的发生相关[5-6],但MEK2蛋白第394位点苏氨酸(Thr394)的磷酸化及其在人结直肠癌发生发展中的影响却鲜有报道。
本研究旨在通过组织芯片-免疫组织化学的方法检测Thr394磷酸化的MEK2[p-MEK2(Thr394)]蛋白在结直肠癌、结直肠腺瘤和结直肠旁正常上皮组织中的表达情况,并进一步分析其与结直肠腺癌临床病理参数及预后的关系,初步探讨 p-MEK2(Thr394)在结直肠腺癌发生发展中的作用及临床意义。
材料和方法
1 材料
本研究共收集2组样本。第1组:随机收集2007年5月~2010年12月间中山大学附属第六医院结直肠癌病例组织石蜡包埋标本144例,其中结直肠腺癌组织96例,结直肠腺瘤组织24例,癌旁正常组织(距离肿瘤边缘5 cm以上)24例,所有病例切片均获病理诊断确认。第2组:随机收集2000年1月~2005年12月间中山大学附属第一医院收治的结直肠癌病例417例,均具备完整临床病理参数和预后资料。成功取样并有染色结果的病例为337例,均经病理组织学证实。患者预后随访方式:查阅病历资料;定期电话询问或通信;家庭访视。随访日期为自首次手术日期开始起,每3个月随访1次。生存时间自首次手术之日起计算,随访终点为患者死亡日期或末次随访日期,随访截止时间为2010年8月31日,生存期以月为单位计算。剔除失访患者后剩余341例纳入生存分析。本研究获中山大学伦理委员会同意,所有参加人员均知情同意。兔抗人p-MEK2(Thr394)单克隆抗体购自Santa Cruz,抗体编号bs5427R。
2 方法
2.1 组织芯片制备 使用切片石蜡制备27 mm×22 mm×10 mm的受体蜡块,并于蜡块构建12×8共96点组织阵列,2个相邻样本间距为1 mm。由资深病理科医生在40倍显微镜像下确认并定位标记供体组织蜡块,用组织芯片制作仪(Alphelys)穿取直径1.0 mm供体组织放入受体蜡块中,每一标本选取2个位点。用石蜡切片机对组织芯片蜡块进行连续切片,厚度为4μm。
2.2 免疫组织化学法检测 采用EnVision染色法检测p-MEK2(Thr394)在各组织中的表达部位及强度。主要步骤如下:常规脱蜡入水,玻片置3%H2O2中10 min,磷酸盐缓冲液(phosphate buffered solution,PBS)冲洗3次,置柠檬酸钠抗原修复液(pH=6.0)高温20 min,PBS冲洗3次,加I抗并4℃恒温过夜;PBS冲洗4次,加II抗HRP液37℃避光孵育1 h,PBS冲洗4次,DAB显色,苏木素复染,二甲苯透明,中性树胶封片,镜检。PBS代替I抗作为阴性对照,结直肠癌组织阳性切片作为阳性对照。
2.3 结果判读及评分标准 p-MEK2(Thr394)阳性表达信号为细胞浆或细胞核中出现黄色物且其染色强度高于背景非特异染色者,或棕黄色颗粒沉淀。采用双盲法阅片,根据阳性细胞百分数和着色强度综合记分。阳性细胞着色强度评分:0分为阴性(不显色),1分为弱(浅灰黄色),2分为中(淡黄色),3分为稍强(黄色),4分为强(棕黄色)。阳性细胞百分率:0分为无阳性细胞,1分为阳性细胞 1% ~25%,2分为阳性细胞26% ~50%,3分为阳性细胞51% ~75%,4分为阳性细胞76% ~100%。结果判读采用半定量积分分级:积分=染色强度×染色细胞比例。当同一标本的2个组织芯片评分结果不一致时,取两者的平均值。
3 统计学处理
采用SPSS18.0统计软件处理。应用χ2检验分析p-MEK2(Thr394)在不同组织中的阳性表达差异及其与各项临床参数的相关性。采用Kaplan-Meier方法分析p-MEK2(Thr394)表达与结直肠癌患者生存的相关性。以P<0.05为差异有统计学意义。
结 果
1 p-MEK2(Thr394)蛋白的表达情况
p-MEK2(Thr394)蛋白在癌旁正常黏膜和腺瘤组织中表达均位于胞浆,未见明显胞核染色。在腺癌组织中有4例表达位于胞核和胞浆,剩余阳性表达者均位于胞核,见图1。根据评分标准,在本组144例标本中,p-MEK2表达的平均值为7.36,以≥7分定义为高表达、<7分为低表达分为2组。24例癌旁正常黏膜标本均为高表达(100%),未见低表达(0%),平均值 15.41;24例腺瘤标本中,平均值7.66,16 例高表达(66.7%),8 例低表达(33.3%)。96例腺癌标本中,表达平均值3.83,19例高表达(19.8%),77例低表达(80.2%)。经过统计学分析:三者总体比较有显著差异(χ2=58.93,P <0.01)。p-MEK2在癌旁正常组织中的表达明显高于结直肠腺瘤组织(χ2=9.60,P <0.05),也明显高于结直肠癌组织(χ2=53.72,P <0.01),在结直肠腺瘤组织中表达明显高于癌组织(χ2=20.42,P <0.01),见表1。96例CRC中的p-MEK2(Thr394)的异常表达与各临床病例参数之间均无相关性,见表2。
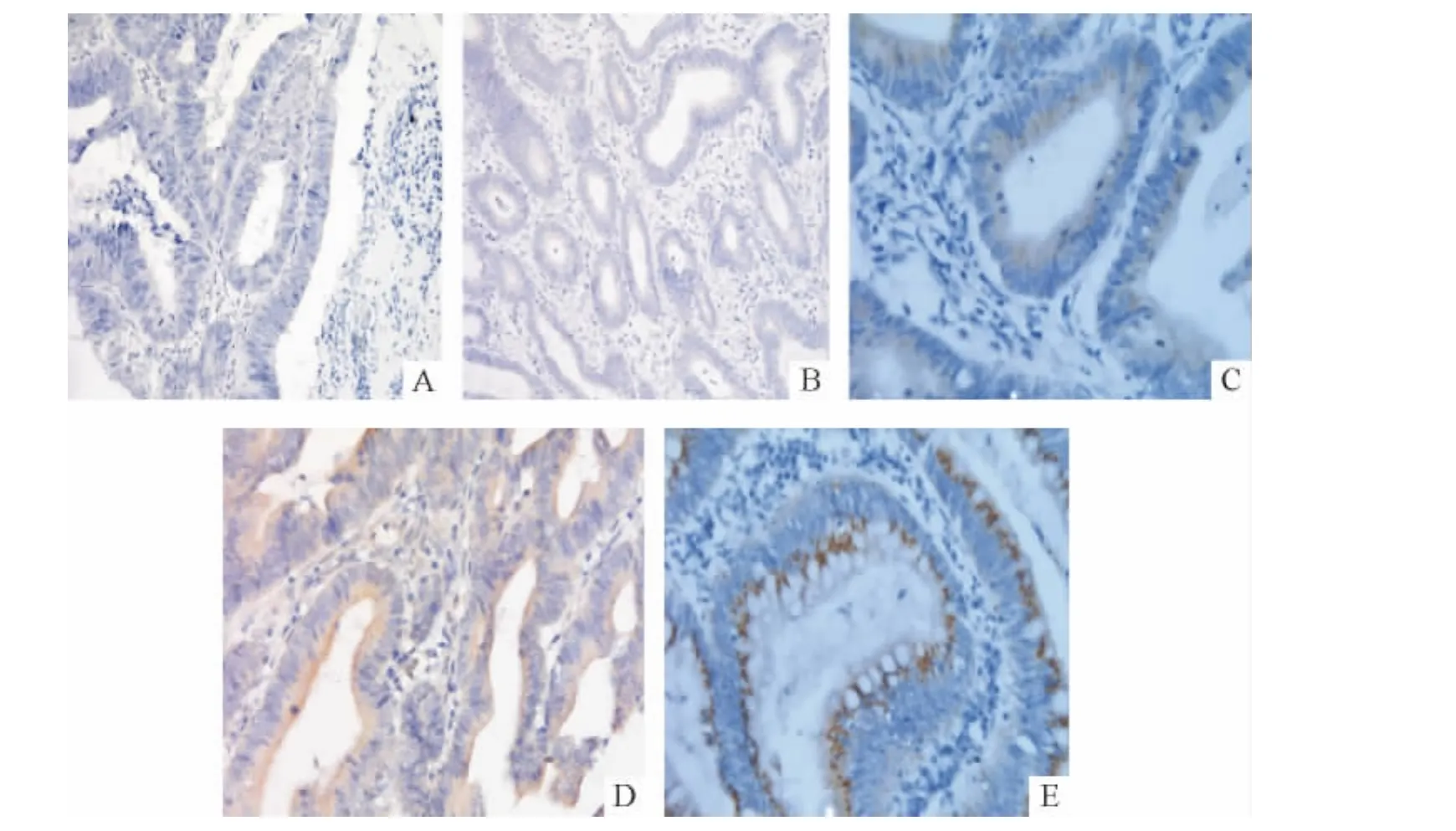
Figure 1.Immunohistochemical staining of colorsctal cancer tissues for p-MEK2(×400).A:negative(0 score);B:positive(1score,yellowish gray);C:positive(2 score,pale yellow);D:positive(3 score,yellow);E:positive(4 score,brown).图1 p-MEK2在结直肠癌组织中的表达
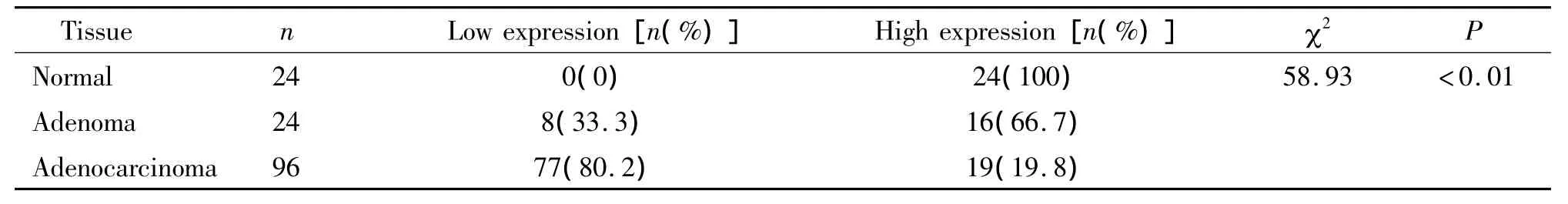
表1 p-MEK2(Thr394)在结直肠正常黏膜、腺瘤和腺癌中的表达Table 1.p-MEK2(Thr394)expression in normal mucosa,adenoma,adenocarcinoma of colorectum
2 第2组样本中p-MEK2(Thr394)蛋白的表达情况
第2组结直肠癌标本组中,成功取样并且有染色结果的共337例,表达的平均值为4.36。以>4分定义为高表达,≤4分为低表达,共分为2组,其中203 例低表达(60.2%),134 例高表达(39.8%)。p-MEK2与性别、年龄、大体分型、组织分型、分化程度、TNM分期等参数均无明显相关性(P>0.05),见表3。
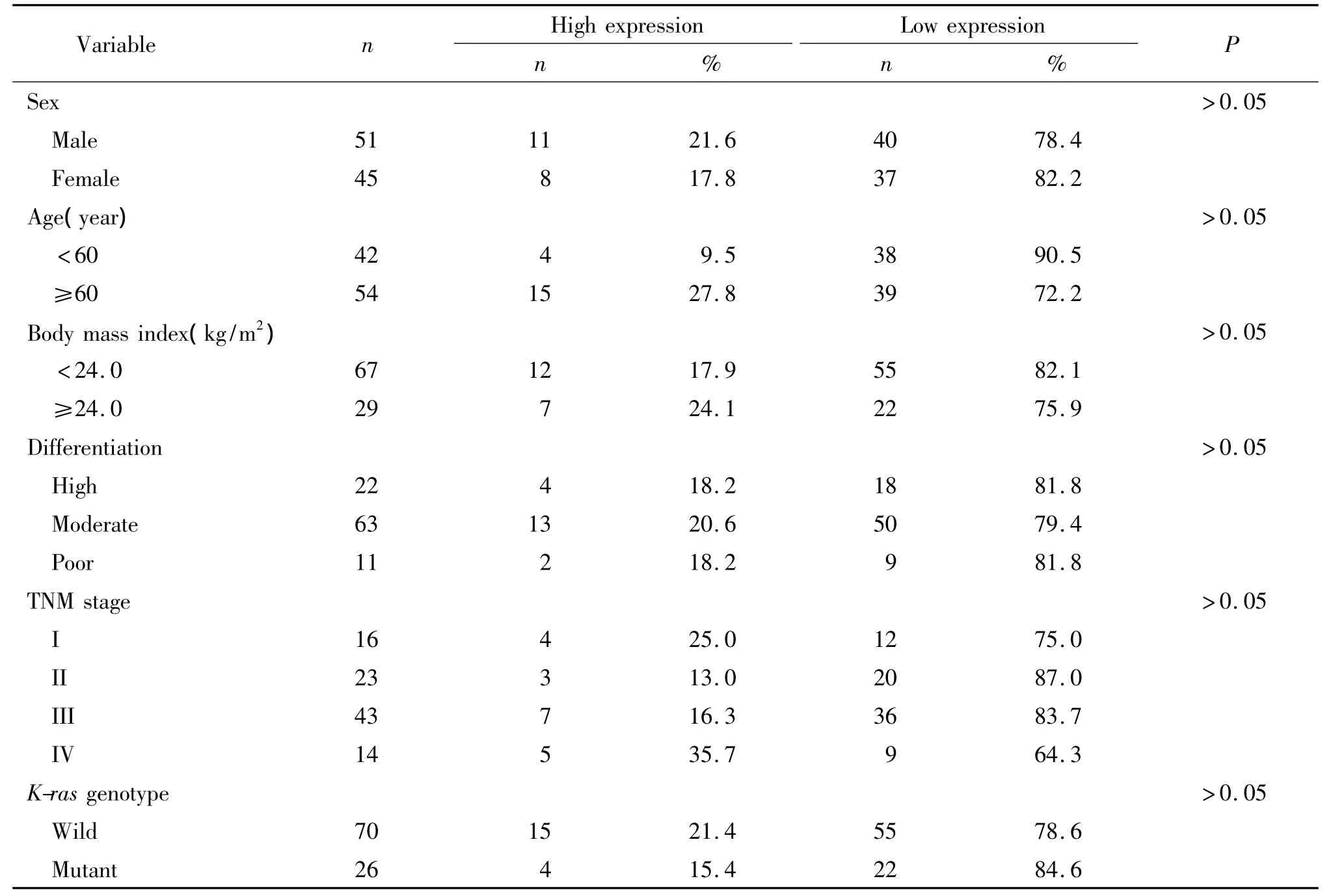
表2 第1组病例中p-MEK2(Thr394)表达与结直肠癌临床病理参数的关系Table 2.The relationships between the expression of p-MEK2(Thr394)and the clinicopathological characteristics in the first group
3 p-MEK2的表达同结直肠癌预后的相关性
Kaplan-Meier分析表明,p-MEK2的表达同结直肠癌患者5年生存率无明显相关性,log-rank检验P >0.05,见图2。
4 p-MEK2在胞浆及胞核中的表达
在第2组结直肠癌标本中,p-MEK2也存在胞浆及胞核中同时表达的现象。合并2组结直肠癌标本数据,共有24例(5.6%)标本存在浆核阳性。比较胞浆表达与胞浆胞核同时表达,2组的临床病理参数及预后均无显著差异(P>0.05),见表4。
讨 论
作为MAPK信号通路的最下游,ERK1/2蛋白的活性范围及持续时间,是细胞对外来刺激反应的重要决定因素。在细胞内存在着多种关键调节机制,来维持ERK1/2蛋白的激活与失活之间的平衡。这种平衡对于维持细胞正常的增殖、分化及凋亡,起着重要的作用。ERK1/2蛋白激酶的失活主要靠去磷酸化已被磷酸化的苏氨酸和(或)丝氨酸来完成。生物学和基因学的研究表明,有活性的ERK1/2蛋白可以在体内被特异性的酪氨酸磷酸酶和双特异性MAPK磷酸酶失活,从而起到负性调节ERK1/2和其它MAPK蛋白激酶的活性[7-9]。但是,关于 ERK MAPK通路本身各级激酶对ERK1/2活性影响的却大多数集中在正性调节上。
MEK1/2作为ERK MAPK通路的中心组成部分,同时也是目前已知仅有的2个ERK1/2蛋白激活酶,是我们目前研究肿瘤靶向治疗的又一热门潜在靶点。抑制MEK1/2可以通过阻断异常的信号转导,抑制肿瘤细胞的分化、增殖。这种抑制同时还有不受上游异常癌基因(K-ras和BRAF突变)影响的优点。现在已有多种 MEK抑制剂进入临床试验[10-11]。目前关于MEK1/2蛋白与肿瘤的发病机制的研究只集中于激酶领域,存在于MEK2蛋白C末端第394位的苏氨酸残基却从未被报道过。本实验通过免疫组化的实验方法将p-MEK2蛋白的表达状况与结直肠癌发生、发展的不同阶段联系起来,研究Thr394位点磷酸化在结直肠癌发生发展中的作用。
近年来的研究表明,MAPK信号通路在结直肠癌的形成中大都处于异常激活状态[12]。Deng等[13]通过对123例结直肠癌的免疫组化研究发现,激活状态的MEK1/2在76%(93例)结直肠癌中高表达,而在正常肠上皮组织中只有很弱的表达,或者不表达。这恰恰与p-MEK2(Thr394)的表达呈相反趋势。本研究检测p-MEK2(Thr394)在结直肠正常上皮组织、腺瘤和腺癌组织中的表达情况,其表达呈明显的递减趋势,高表达率分别为100%、66.7%和19.8%。统计学结果显示三者总体比较具有显著差异(P<0.01);三者的两两比较也具有显著差异。二者这种截然不同的表达结果提示我们:在结直肠癌的发展过程中,MEK2第394位点苏氨酸残基的磷酸化,在某种意义上可以作为一种保护因素,抑制癌症的发生。正是这种抑癌因素与促癌因素(MEK1/2异常激活)之间的平衡被打破,正常的肠上皮细胞开始向肿瘤转化。
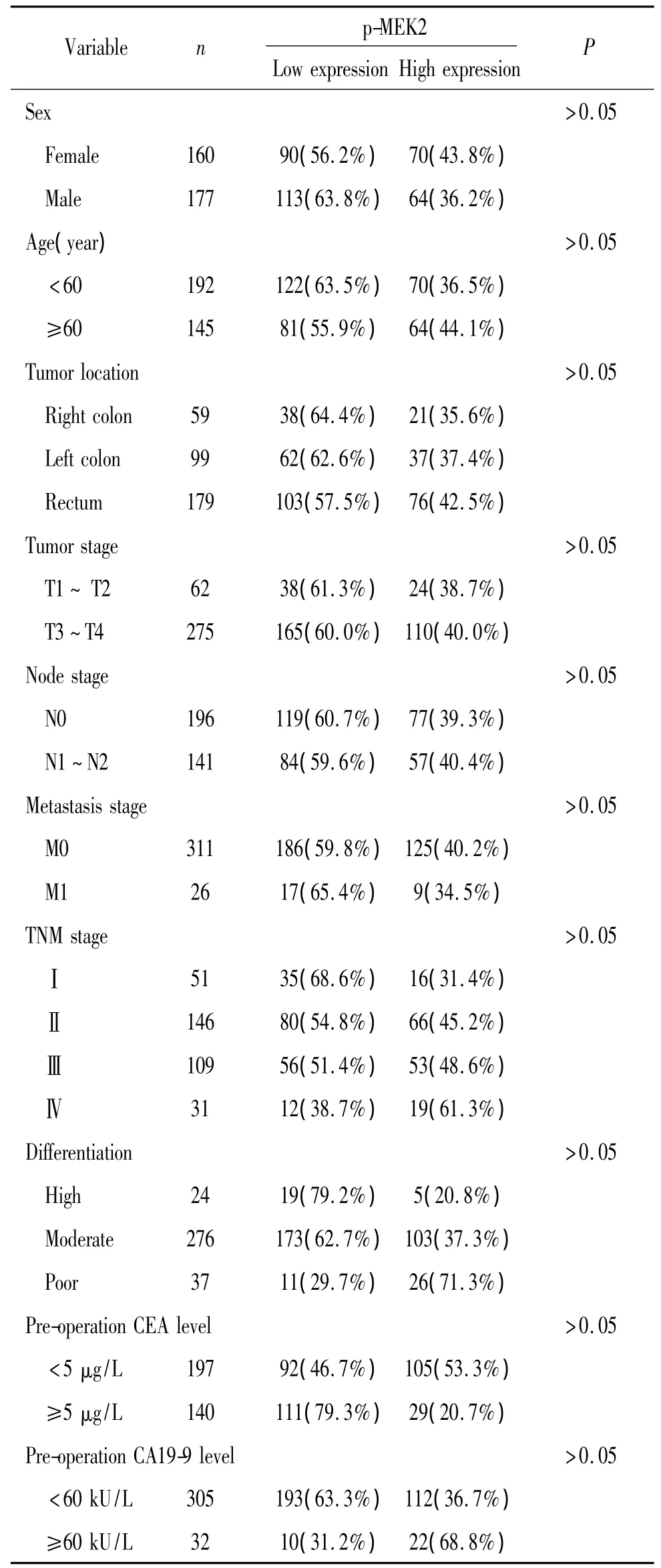
表3 p-MEK2的表达与结直肠癌临床病理特征的关系Table 3.The relationships between the expression of p-MEK2(Thr394)and the clinicopathological characteristic in colorectal carcinoma
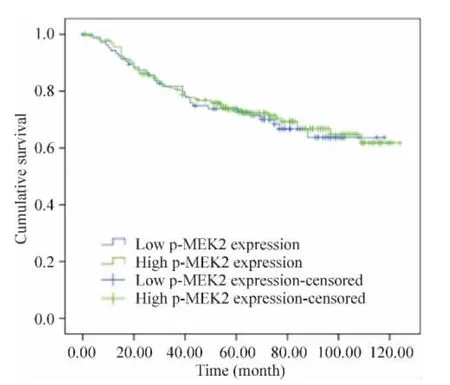
Figure 2.Kaplan-Meier analysis of association between p-MEK2 expression and survival rate of colorectal cancer patients.图2 p-MEK2的表达水平与结直肠癌患者5年生存率的关系
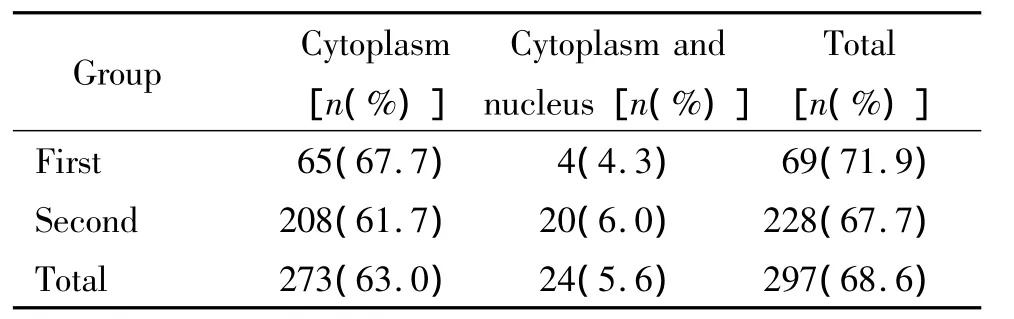
表4 p-MEK2在2组腺癌标本胞浆、胞核中的阳性表达Table 4.The positive expression of p-MEK2(Thr394)in the cytoplasm and nucleus of adenocarcinoma samples
本研究另外一个目的是研究p-MEK2(Thr394)蛋白表达与结直肠癌患者的各种临床参数及预后的相关性。通过不同的统计学分析,我们发现,p-MEK2(Thr394)蛋白的表达与结直肠癌的各种临床参数(如年龄、性别、分化程度、分期)以及预后均无明显相关性,这个结果提示我们,p-MEK2(Thr394)的失表达可能对肿瘤的发生阶段起着重要的调控作用,但在肿瘤的进展过程中,其下游其它因子的作用更大。
本研究同时还发现,在 2组的 p-MEK2(Thr394)阳性表达的结直肠癌标本(共300例)中,44例同时存在于胞浆及胞核中。激活状态的MEK1/2可以在胞浆及胞核中表达,这种现象已经在Deng等[13]的实验中得到证实。Georgieva 等[14]则对其机制和作用进行了研究。他们的研究表明,激活状态的MEK1/2可以自由地进出于胞浆及胞核之间。MEK1/2进入胞核主要靠被动扩散机制,它由胞核进入到胞浆则是靠其位于蛋白N端的一个短的富含亮氨酸的信号肽。这条肽链又称核转出信号肽(nuclear export signal,NES),它位于 MEK1/2 蛋白的第31号氨基酸残基到第51号残基之间。NES信号肽的存在使得MEK1/2可以以主动转运的形式回到胞浆,正是这种主动转运使得与MEK1/2结合的ERK1/2可以在胞浆重新定位,这也是目前我们已知的唯一一个转运 ERK1/2出胞核的途径[15]。p-MEK2(Thr394)蛋白也存在N端的NES肽段,它在细胞核中的表达提示,Thr394的磷酸化也可能存在对ERK1/2重新定位的调节。
尽管目前我们对于Thr394这个位于MEK2 C端的氨基酸残基知之甚少,但在本实验中它在结直肠癌的发生过程中的明显失表达的现象告诉我们,它可能是结直肠癌发生过程中的一个潜在保护因素。MEK2在Thr394的磷酸化值得我们进一步深入研究。
