DKK1基因沉默的人多发性骨髓瘤细胞培养上清对小鼠前成骨细胞成骨分化的影响*
2013-10-24章瑜,俞康
章 瑜, 俞 康
(温州医学院附属第一医院血液科,浙江 温州 325000)
DKK1基因沉默的人多发性骨髓瘤细胞培养上清对小鼠前成骨细胞成骨分化的影响*
章 瑜, 俞 康△
(温州医学院附属第一医院血液科,浙江 温州 325000)
目的初步探讨一种与胚胎发生及肿瘤发展密切相关的糖蛋白Dickkopf-1(DKK1)在骨髓瘤骨病(myeloma bone disease,MBD)发病中的作用。方法前期实验构建的质粒pLenti6/V5-GW/DKK-1-miR,与慢病毒包装质粒一起包装成慢病毒,感染人骨髓瘤U266细胞,建立DKK1沉默的U266细胞。小鼠前成骨细胞MC3T3-E1体外成骨诱导实验分组:空白对照组、诱导分化组、30% U266上清干预组、30%DKK1 RNAi U266上清干预组和30%无关序列RNAi U266上清干预组;诱导培养12 d后,通过茜素红染色检测钙结节数目;real-time PCR检测骨钙素(osteocalcin,OC)mRNA的表达变化。结果成骨诱导体系中,与空白组比较,诱导组OC mRNA有明显升高,差异有统计学意义(P<0.01)。与诱导组比较,30% U266上清干预组OC mRNA表达明显减少(P<0.01)。与30% U266上清干预组比较,30%DKK1 RNAi U266上清干预组OC mRNA表达明显增多(P<0.05),30%无关序列RNAi U266上清干预组OC mRNA差异无统计学意义。与诱导组比较,30% U266上清干预组钙结节计数明显减少(P<0.01)。与30% U266上清干预组比较,30%DKK1 RNAi U266上清干预组钙结节计数明显增多(P<0.05),30%无关序列RNAi U266上清干预组钙结节计数差异无统计学意义(P>0.05)。结论U266细胞中DKK1基因沉默后,其培养上清抑制小鼠前成骨细胞MC3T3-E1成骨分化的能力减弱。
Dickkopf-1蛋白; 骨髓瘤骨病; 骨钙素
多发性骨髓瘤(multiple myeloma,MM)是一种恶性浆细胞疾病。而80%左右的患者伴有严重骨痛及病理性骨折的表现,即骨髓瘤骨病(myeloma bone disease,MBD)[1]。发生MBD的MM患者因骨痛﹑病理性骨折和高钙血症等,生活质量受到严重影响[2]。更重要的是,与没有病理性骨折的患者比较,病理性骨折的MM患者死亡风险增加20%以上[3-4]。因此,加强对MBD的研究和寻找有效的治疗方法迫在眉睫。
既往研究中多专注于对破骨细胞的研究[5-6],但同时有研究发现,通过对破骨细胞抑制来减少骨的重吸收,并不能改善骨质损害的修复[7]。成骨细胞功能的受损在MM病人骨损害的发展中起亦着重要作用。 许多研究表明经典的 Wnt 信号转导途径对正常的骨发育和肿瘤相关骨病的发生是非常重要的[8],Wnt途径及它的抑制物Dickkopf-1 (DKK1)参与了骨转移过程。Gunn等[9]发现, 具有溶骨性病变的MM患者的骨髓瘤细胞能分泌高水平的DKK1, 通过抑制Wnt途径,阻止间充质干细胞向成骨细胞分化。许多研究机构把DKK1的中和抗体应用于小鼠和人体的骨质疏松研究中,都取得了预期的良好效果[10-11]。但是中和抗体不能从根本上解决问题,本实验就尝试基因沉默的效果。
材 料 和 方 法
1材料
人多发性骨髓瘤细胞株U266购于中国科学院肿瘤研究所(ATCC编号:TIB-196),小鼠前成骨细胞MC3T3-E1为温州医学院附属第一人民医院医科所保存。
2主要试剂
高糖DMEM液、RPMI-1640液、低糖DMEM液和胎牛血清(fetal bovine serum,FBS)均购于Gibco;Trizol购于Invitrogen; 茜素红粉剂购于国药集团;重组人骨形态发生蛋白2(bone morphogenetic protein 2,BMP-2)购于R&D;PCR 引物由上海赛百盛生物工程公司生产。
3主要方法
3.1DKK1沉默的人多发性骨髓瘤细胞系U266的建立 本实验室前期研究已完成[12]。
3.2体外前成骨细胞诱导体系实验分组 (1)空白对照组:予总体积3 mL 10%FBS-DMEM完全培养液;(2)诱导分化组:予总体积3 mL含50 μg/L BMP-2的完全培养液;(3) 30% U266上清干预组:予总体积3 mL 含30% U266细胞上清和50 μg/L BMP-2的完全培养液; (4)30%DKK1 RNAi U266上清干预组:予总体积3 mL含DKK1 RNAi的U266细胞培养上清液和50 μg/L BMP-2的完全培养液; (5)30%无关序列RNAi U266上清干预组:予总体积3 mL含无关序列RNAi的U266细胞培养上清液和50 μg/L BMP-2的完全培养液。取MC3T3-E1细胞2.0×104个于6孔培养板上,每组加入上述培养液,37 ℃、5% CO2培养箱培养。每3 d换液1次,每孔加入相同的培养液,12 d后收获细胞。
3.3茜素红染色及钙结节计数 按实验分组培养MC3T3-E1细胞,12 d后收获细胞。去除各孔培养液,以PBS清洗,以95%乙醇室温固定10 min,流水冲洗,晾干。将配置好的0.2%茜素红染液加入到固定好的细胞上, 置37 ℃水浴箱中染色10 min。去除染液,流水冲洗,100倍倒置显微镜下双盲法染色结节计数。
3.4Real-time PCR测定 按照总RNA抽提试剂盒说明书的使用步骤对各实验组细胞进行总RNA的抽提;按照逆转录酶使用说明将样本mRNA逆转录为cDNA。小鼠骨钙素(osteocalcin,OC)上游引物5’-AGGAGGGCAATAAGGTAGTGAA-3’,下游引物5’-TACCGTAGATGCGTCTGTAGGC-3’,目的长度165 bp;小鼠GAPDH上游引物5’-CAAGTTCAACGGCACAGTCAA-3’,下游引物5’-TGGTGAAGACGCCAGTAGACTC-3’,目的长度148 bp。Real-time PCR反应体系为25 μL,含cDNA 2 μL,上、下游引物各0.5 μL,2× PCR Mix 12.5 μL,无核酸酶水9.5 μL。在ABI 7500 PCR仪上进行real-time PCR检测, 每个样本做3个复孔, 扩增条件为50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环。进行3次组内重复后, 以公式2-ΔΔCt[ΔCt(待测样本)=待测基因Ct-内参照基因Ct,ΔΔCt=ΔCt(待测样本)-ΔCt(对照样本)]计算待测基因的相对表达量[13]。
4统计学处理
SPSS 17.0 软件进行分析,计量资料用均数±标准差(mean±SD)表示,多组样本均数比较采用单因数方差分析(One-way ANOVA),组间比较采用LSD法(方差齐性)或 Dunnet-T3 法(方差不齐),以P<0.05为差异有统计学意义。
结 果
1各实验组中钙结节计数
空白对照组细胞基本无结节染色,诱导组可见细胞外沉积的钙被染成红色钙结节,呈阳性反应;30% U266上清干预组和30%无关序列RNAi U266上清干预组与BMP-2诱导组比较,钙结节计数明显减少,差异有统计学意义(P<0.01)。30%DKK1 RNAi U266上清干预组与30% U266上清干预组比较,钙结节计数增多,差异有统计学意义(P<0.05),而30%无关序列RNAi U266上清干预组与30% U266上清干预组比较,钙结节计数差异无统计学意义(P>0.05),见图1、表1。
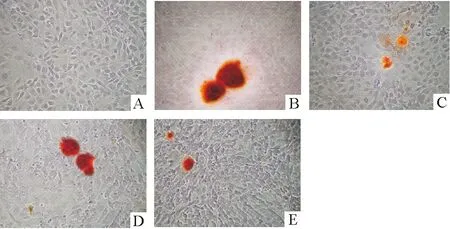
Figure 1. Calcium nodules in different groups in aninvitropreosteoblast induction system (alizarin red staining,×100).A:blank control group;B:BMP-2 induction group;C:U266 supernatant group;D:DKK1 RNAi U266 supernatant group;E:negative RNAi U266 supernatant group.
图1体外前成骨细胞诱导体系实验各组钙结节染色结果
表1各组钙结节计数结果
Table 1. Calcium nodule count results in different groups (Mean±SD.n=3)

GroupCalciumnodulecountBlankcontrol0.750±0.250BMP-2induction13.250±1.493▲▲U266supernatant4.500±1.041DKK1RNAiU266supernatant9.000±1.472*NegativeRNAiU266supernatant5.000±0.408
▲▲P<0.01vsblank control group;*P<0.05vsU266 supernatant group.
2各实验组中OCmRNA的表达
SYBR real-time PCR结果显示:与空白组比较,BMP-2诱导组OC mRNA有明显升高,差异有统计学意义(P<0.01)。与诱导组比较,30% U266上清干预组OC mRNA表达减少,差异有统计学意义(P<0.01);与30% U266上清干预组比较,30%DKK1 RNAi U266上清干预组OC mRNA表达减少,差异有统计学意义(P<0.05),而30%无关序列RNAi U266上清干预组OC mRNA表达差异无统计学意义,见表2。
表2各组OCmRNA的相对表达量
Table 2. The expression of OC mRNA in different groups detected by real-time PCR (Mean±SD.n=3)

GroupΔCt 2-ΔΔCtBlankcontrol7.485±1.0211BMP-2induction4.368±0.988▲▲8.586U266supernatant6.662±0.473##1.760DKK1RNAiU266superna-tant5.103±0.249*5.195NegativeRNAiU266superna-tant7.271±1.140##1.156
▲▲P<0.01vsblank control group;##P<0.01vsBMP-2 induction group;*P<0.05vsU266 supernatant group.
讨 论
骨髓瘤相关的骨病一直是MM治疗的一个难题。其治疗方法不外乎双膦酸盐药物、放化疗和手术治疗,这些治疗方法的目的在于预防骨相关事件的发生,延缓溶骨性病损的进展和骨痛,只能控制症状。MBD的形成是破骨细胞活性增强与成骨细胞抑制的结果。而且越来越多的研究表明单方面抑制破骨细胞的活性并不能有效改善骨质破坏,成骨细胞的作用不容忽视。DKK1可以抑制成骨细胞,从而促成MBD的发生,而且有研究发现封闭DKK1可以直接影响肿瘤内环境从而延缓肿瘤的生长[10],所以DKK1不论在MBD方面还是在肿瘤本身都是一个关键的因素。在本实验在体外成骨诱导体系中评估DKK1沉默后骨髓瘤细胞培养上清对前成骨细胞分化的影响,结果发现代表成骨的相关基因表达水平明显高于沉默前的水平,说明成骨抑制情况明显改善。无关序列RNAi与沉默前的成骨基因表达水平的差异没有统计学意义,进一步说明了DKK1 siRNA能较特异地与目的基因结合,具有特异性。
本实验为接下来更深入地探讨多发性骨髓瘤细胞的成骨抑制分子机理奠定基础,为临床上靶向治疗多发性骨髓瘤骨病提供了体外研究的理论依据。
[1] Roodman GD. New potential targets for treating myeloma bone disease[J]. Clin Cancer Res, 2006, 12(20 Pt2):6270s-6273s.
[2] Sezer O. Myeloma bone disease:recent advances in biology, diagnosis,and treatment[J]. Oncologist, 2009, 14(3):276-283.
[3] Saad F, Lipton A, Cook R, et al. Pathologic fractures correlate with reduced survival in patients with malignant bone disease[J]. Cancer, 2007,110(8):1860-1867.
[4] Sonmez M, Akagun T, Topbas M, et al. Effect of pathologic fractures on survival in multiple myeloma patients: a case control study[J]. J Exp Clin Cancer Res, 2008,27:11.
[5] Pearse RN, Sordillo EM, Yaccoby S, et al. Multiple myeloma disrupts the TRANCE/osteoprotegerin cytokine axis to trigger bone destruction and promote tumor progression[J]. Proc Natl Acad Sci U S A, 2001,98(20):11581-11586.
[6] 汤丽苑,徐 钰,陈 瑾,等. 人多发性骨髓瘤 RPMI 8226 细胞条件培养液诱导破骨前体细胞的分化成熟[J].中国病理生理杂志,2012,28(4): 649-654.
[7] Berenson JR. Zoledronic acid in cancer patients with bone metastases: results of Phase I and II trials[J].Semin Oncol, 2001, 28(2 Suppl 6):25-34.
[8] Pinzone JJ,Hall BM, Thudi NK,et al. The role of Dickkopf-1 in bone development, homeostasis, and disease[J]. Blood, 2009,113(3):517-525.
[9] Gunn WG, Conley A, Deininger L,et al. A crosstalk between myeloma cells and marrow stromal cells stimulates production of DKK1 and interleukin-6: a potential role in the development of lytic bone disease and tumor progression in multiple myeloma[J]. Stem Cells,2006,24(4):986-991.
[10] Fulciniti M, Tassone P, Hideshima T, et al. Anti-DKK1 mAb (BHQ880) as a potential therapeutic agent for multiple myeloma[J]. Blood, 2009,114(2):371-379.
[11] Yaccoby S, Ling W, Zhan F, et al. Antibody-based inhibition of DKK1 suppresses tumor-induced bone resorption and multiple myeloma growthinvivo[J]. Blood, 2007, 109(5):2106-2111.
[12] 章 瑜,俞 康.慢病毒介导的RNAi对人多发性骨髓瘤DKK1基因表达的抑制作用[J].医学研究杂志,2010, 39(6):85-87.
[13] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods, 2001,25(4):402-408.
EffectofculturesupernatantofhumanmultiplemyelomacellswithDKK1genesilencingonosteogenicdifferentiationofmousepreosteoblasts
ZHANG Yu, YU Kang
(DepartmentofHematology,TheFirstAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:yukang62@126.com)
AIM: To investigate the effect of Dickkopt-1 (DKK1) gene on myeloma bone disease.METHODSLentivirus was packed with pLenti6/V5-GW/DKK-1-miR plasmids and lentivirus packaging plasmids, and then transfected into human multiple myeloma cell line U266. Aninvitroosteogenic experiment was performed and the mouse MC3T3-E1 preosteoblasts were divided into blank control group, bone morphogenetic protein 2 (BMP-2) induction group, U266 supernatant group,DKK1 RNAi U266 supernatant group and negative RNAi U266 supernatant group. All supernatants added to the cells were at the concentration of 30%. After culture for 12 d, the effects of different U266 cell supernatants on osteogenic differentiation of MC3T3-E1 cells were investigated by alizarin red staining. The mRNA expression of osteocalcin (OC) was detected by real-time PCR.RESULTSCompared with blank control group, the mRNA expression of OC in BMP-2 induction group increased significantly. Compared with BMP-2 induction group, the mRNA expression of OC and the number of calcium nodule in U266 supernatant group were decreased. Compared with U266 supernatant group, the mRNA expression of OC and the number of calcium nodule inDKK1 RNAi supernatant group were significantly eleva-ted. In negative RNAi U266 supernatant group, OC mRNA and the calcium nodule did not change significantly.CONCLUSIONAfterDKK1 gene silencing in U266 cells by RNAi, the inhibition of osteogenic differentiation of mouse preosteoblasts significantly decreases.
Dickkopf-1 protein; Myeloma bone disease; Osteocalcin
R363
A
10.3969/j.issn.1000- 4718.2013.06.029
1000- 4718(2013)06- 1129- 04
2013- 01- 17
2013- 05- 08
温州医学院 5010 重大项目子课题(No.XNK05005)
△通讯作者 Tel: 0577-55579489; E-mail: yukang62@126.com
