口虾蛄提取物对人鼻咽癌细胞迁移和体外血管生成拟态的抑制作用*
2013-10-24尚九龙吴孟晏别延红顾帝水
孔 霞, 尚九龙, 李 丽, 吴孟晏, 别延红, 顾帝水△
(广东医学院 1病理生理学教研室, 2生理学教研室, 3病理学教研室, 广东 东莞 523808)
口虾蛄提取物对人鼻咽癌细胞迁移和体外血管生成拟态的抑制作用*
孔 霞1, 尚九龙2, 李 丽3, 吴孟晏3, 别延红3, 顾帝水1△
(广东医学院1病理生理学教研室,2生理学教研室,3病理学教研室, 广东 东莞 523808)
目的研究口虾蛄提取物(extract ofOratosquilla,EOS)对人低分化鼻咽癌细胞株CNE-2的迁移及体外血管生成拟态的影响。方法用不同浓度(0 mg/L 、125 mg/L、250 mg/L、500 mg/L)EOS处理CNE-2细胞24 h后,创伤修复实验检测细胞迁移能力;通过Matrigel三维细胞培养观察CNE-2细胞形成类血管网状结构的能力及其特点;体外管道形成抑制实验检测不同浓度EOS对CNE-2细胞管道形成能力的影响;Western blotting法检测不同浓度EOS对CNE-2细胞fascin 1和血管内皮生长因子(VEGF)蛋白表达的影响。结果EOS可以显著降低CNE-2细胞的迁移能力,与对照组比较差异有统计学意义(P<0.01);CNE-2细胞在Matrigel上培养能形成类似血管的网状样结构;EOS能以剂量依赖方式抑制CNE-2细胞体外管道形成的数量(P<0.01);EOS能抑制CNE-2细胞中fascin 1和VEGF蛋白的表达(P<0.01),且其管状结构数量与2种蛋白变化趋势呈正相关(P<0.05)。结论CNE-2细胞具有血管生成拟态的能力;EOS能够抑制CNE-2细胞的迁移和体外血管生成拟态的能力,其机制可能与下调fascin 1和VEGF蛋白的表达有关。
口虾蛄; 鼻咽肿瘤; 血管生成拟态
血管生成拟态(vasculogenic mimicry, VM)是指一些高度恶性和侵袭性的肿瘤细胞具有模拟内皮细胞形成血管样网状结构的特异性能力[1]。VM 与人们所熟悉的内皮依赖性血管生成不同,它的管道内没有血管内皮细胞的覆盖,取而代之的是一层肿瘤细胞,故它的弹性和通透性等特性与正常血管不同[2],更有利于肿瘤细胞的快速生长和转移。我们前期研究表明口虾蛄提取物(extract ofOratosquilla,EOS)可能具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抗肿瘤侵袭和转移及抑制肿瘤新生血管形成等作用[3-5]。本研究旨在进一步探索口虾蛄提取物对人低分化鼻咽癌CNE-2细胞体外迁移和肿瘤血管生成拟态的影响,以深入探讨口虾蛄提取物的抗肿瘤作用。
材 料 和 方 法
1材料
口虾蛄提取物及人低分化鼻咽癌细胞系(CNE-2)均由广东医学院肿瘤研究所提供;人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)由香港中文大学医学院提供;二甲基亚砜(DMSO, Sigma);Matrigel购自威格拉斯(Vigorous)生物技术(北京)有限公司;鼠抗fascin 1和血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体 (Santa Cruz)。
2方法
2.1细胞培养 CNE-2及HUVECs均采用含 10%胎牛血清的RPMI-1640培养液,于37 ℃、5% CO2培养箱中培养,取对数生长期细胞进行实验。
2.2EOS的配制及实验分组 EOS以DMSO溶解,实验分4组:实验前将溶解后的EOS加入各组细胞培养液中,使其终浓度分别为0 mg/L(对照组)、125 mg/L(低浓度组)、250 mg/L(中浓度组)和500 mg/L(高浓度组),并使各组DMSO终浓度均为0.1%。
2.3创伤修复实验检测细胞迁移能力 用记号笔在6孔板背面划上间隔0.5 cm的均匀横划线。将5×105个CNE-2细胞接种于6孔板,约90%融合生长后,用10 μL 移液器枪头在孔的底部垂直于背面的横线进行划痕,然后用PBS溶液洗去损伤脱落细胞3次。每孔加含EOS 0 mg/L、125 mg/L、250 mg/L和500 mg/L的RPMI-1640培养液2 mL,每组设3个平行孔,即刻摄像记录。37 ℃、5% CO2培养箱中培养24 h后,按标记再次同视野分别摄像记录。应用Scion Image 图像处理软件处理结果。按下式计算创口愈合面积百分比:创口愈合面积百分比=(0 h创口面积-24 h创口面积)/0 h创口面积×100%。以创口愈合面积百分比代表细胞平行迁移率。实验重复3 次。
2.4体外管道形成实验 将预冷过夜的Matrigel 胶加入96孔板(50 μL/well),平整铺于孔底,4 ℃冰箱放置15 min,37 ℃、5% CO2培养箱凝固1 h;取对数生长期的HUVECs和CNE-2单细胞悬液,分别接种到已包被Matrigel胶的96孔板上(1×104cells/well) ,继续培养24 h;观察细胞管状排列情况及完整程度,终止管道形成后,弃上清液、PBS清洗、4%多聚甲醛固定20 min,显微镜下(×100)在事先标记好的上、下、左、右、中心5个视野拍照,并计数5个视野的管状结构总个数。实验重复3次。
2.5体外管道形成抑制实验 在已包被Matrigel胶(方法同上)的96孔板中,每孔分别加入100 μL含1×104个CNE-2细胞悬液,分别加入100 μL含不同浓度EOS(0 mg/L、125 mg/L、250 mg/L和500 mg/L)含10%胎牛血清的RPMI-1640培养液,每组设3个平行孔。细胞管状结构培养、观察、拍照、计数方法与2.4相同。实验重复3次。
2.6Western blotting检测fascin 1和VEGF的表达 将对数生长期的CNE-2细胞接种于6孔培养板,细胞浓度为5×104cells/well,每孔1.8 mL。置37 ℃、5%CO2培养箱中培养12 h后加入200 μL含EOS的生长液,使各组EOS终浓度分别为0 mg/L、125 mg/L、250 mg/L和500 mg/L,继续培养24 h后,取 1×106个细胞以细胞裂解液裂解,沸水变性3~5 min,超声波粉碎30 s,13 000 r/min 4 ℃离心10 min,取上清,BCA试剂盒测定蛋白浓度。取等量蛋白样品进行12% SDS-聚丙烯酰胺凝胶电泳,湿法电转移至PVDF膜,膜与鼠抗fascin 1和VEGF单克隆抗体4 ℃孵育过夜,再与羊抗鼠IgG 室温孵育2 h,ECL检测,β-actin作为内参照。图像经Scion Image软件进行吸光度分析,并与内参照β-actin比较,以相对吸光度值代表蛋白表达量。
3统计学处理
数据以均数±标准差(mean±SD)表示。采用SPSS 11.5统计软件进行单因素方差分析,处理组与对照组间比较采用LSD法,相关性分析采用Spearman 等价相关,以P<0.05为差异有统计学意义。
结 果
1EOS对CNE-2细胞迁移能力的影响
图1显示,对照组24 h后的创口愈合面积约较24 h 前缩小89.3%。EOS在浓度0~500 mg/L范围内能够呈剂量依赖性抑制鼻咽癌CNE-2细胞的平行迁移能力,组间差异有统计学意义(P<0.01),当EOS为500 mg/L时24 h后的创口愈合面积仅为30%左右,且各组CNE-2细胞平均迁移速度与EOS浓度呈负相关(P<0.01)。
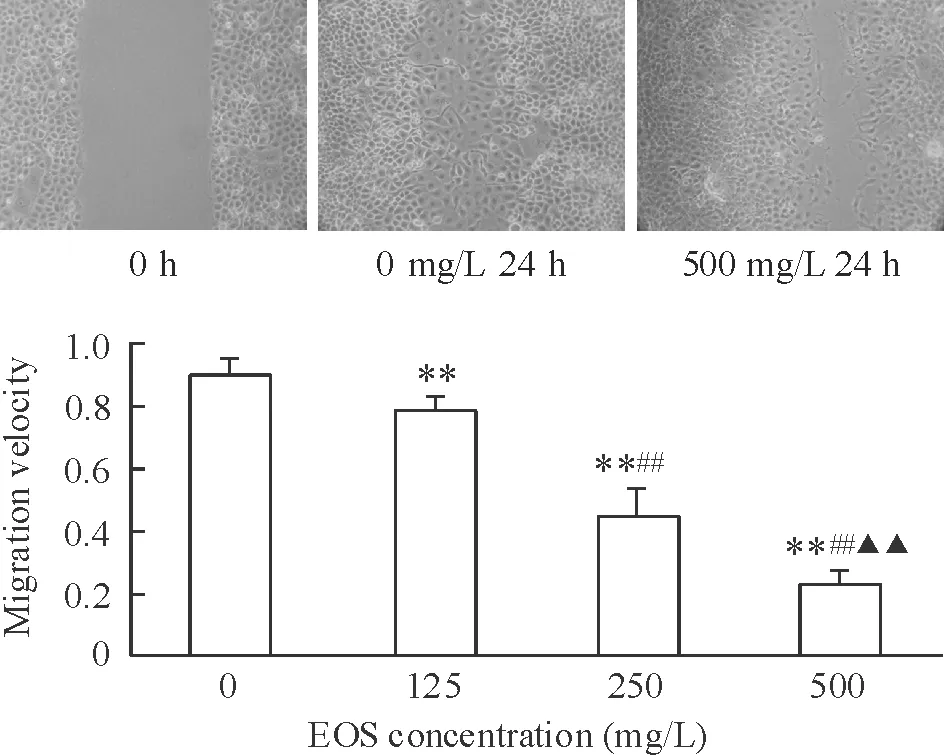
Figure 1. Effect of EOS on the migration ability of CNE-2 cells (×100).Mean±SD.n=3.**P<0.01vs0 mg/L;##P<0.01vs125 mg/L;▲▲P<0.01vs250 mg/L.
图1EOS对CNE-2细胞迁移能力的影响
2EOS对CNE-2细胞体外管道形成能力的影响
HUVECs细胞能够在人工基底膜胶上形成小管样结构,相互交织成网,见图2A。而CNE-2细胞也能够模拟血管内皮细胞的特性,呈现长梭样的细胞形态,细胞之间互相连接,6 h后形成血管网状样结构,形成过程与内皮细胞相似,见图2B。对照组所形成的管道结构排列整齐且较多而完整,呈单个环状或多个环相连的网格状,见图2B;经不同浓度EOS处理的CNE-2细胞在Matrigel胶上形成的小管样结构数目较对照组减少,且环状结构断裂,见图2C,组间差异有统计学意义(P<0.01)。CNE-2细胞经不同浓度EOS处理后管道形成的数目与EOS浓度呈负相关(P<0.01)。
3EOS对CNE-2细胞中fascin1和VEGF蛋白表达的影响
图3所示,EOS作用于CNE-2细胞24 h后,随着EOS浓度的增加,fascin 1和VEGF蛋白的表达逐渐下降(P< 0.01),且其变化趋势与EOS对细胞迁移能力和VM的变化趋势均呈正相关(P<0.05)。

Figure 2. Effect of EOS on the vasculogenic mimicry of CNE-2 cells (24 h,×100).Mean±SD.n=3.**P<0.01vs0 mg/L;##P<0.01vs125 mg/L;▲▲P<0.01vs250 mg/L.
图2EOS对CNE-2细胞血管生成拟态的影响

Figure 3. Effects of EOS on the expression of fascin 1 and VEGF in CNE-2 cells.1: 0 mg/L; 2: 125 mg/L; 3: 250 mg/L; 4: 500 mg/L.Mean±SD.n=3.**P<0.01vs1;##P<0.01vs2;▲▲P<0.01vs3.
图3EOS对CNE-2细胞fascin1和VEGF表达的影响
讨 论
实体瘤需要血液供应才能维持生长和发生血行转移。长期以来,人们一直认为肿瘤血管生成是其获得血液供应的唯一途径。直到1999年Maniotis 等[1]在研究葡萄膜黑色素瘤微循环时发现了另一种独特的肿瘤血液供应方式,即恶性黑色素瘤细胞可通过自身变形,形成可输送血液的管道结构——VM。该类管道的特点是管道内没有血管内皮细胞衬覆,肿瘤细胞模仿机体血管生成而形成瘤细胞条索并围成管道。该管道外周是一层厚薄不一的过碘酸-雪夫氏反应(periodic acid-Schiff, PAS)阳性物质构成的基底膜。这种结构更有利于肿瘤细胞的侵袭转移。后来,人们逐渐在卵巢癌、肝癌、胃腺癌、乳腺癌[6-8]中发现了血管生成拟态现象,但是目前关于血管生成拟态在鼻咽癌中的报道还比较少。
本研究发现鼻咽癌CNE-2细胞在Matrigel胶上能够形成小管样结构,说明CNE-2细胞可能具有类似内皮细胞的某些功能和生物学行为,在体外能够模拟血管内皮细胞的特性,具有血管生成拟态的能力。这与文献报告高度恶性、侵袭性的肿瘤细胞能够形成血管生成拟态相一致[9-10]。CNE-2细胞形成的小管样结构经不同浓度的EOS药物干预后,其小管样结构形成能力明显受到抑制,而且环状结构断裂、不完整,高浓度组作用最明显,表明EOS能够抑制CNE-2细胞血管生成拟态的能力,且有明显的剂量依赖性。
恶性肿瘤细胞能够模拟内皮细胞形成血管生成拟态的机制仍处于研究阶段。目前研究认为VM可能与VE-cadherin、EphA2、laminin 5 γ2、MMP-2、PI3K、HIF-1α、Notch、 Mig-7和VEGF-C等[11-12]相关蛋白表达上调有关。Western blotting结果显示EOS能明显抑制CNE-2细胞VEGF蛋白的表达,且其变化趋势与EOS对VM的影响趋势具有相关性(P<0.01),这说明EOS可能通过抑制鼻咽癌CNE-2细胞VEGF的表达影响VM的形成。
本实验中利用创伤修复实验来研究EOS对鼻咽癌CNE-2细胞的体外迁移能力,结果显示,EOS能够显著降低CNE-2细胞的体外迁移能力,并且与EOS对鼻咽癌细胞CNE-2中fascin 1蛋白表达的影响具有相关性。Fascin作为细胞骨架蛋白,在许多上皮来源的(如肺癌、卵巢癌、胃癌、结肠癌及食管癌等)肿瘤细胞系及肿瘤组织中表达明显上调,而在相应的正常上皮低表达或不表达,参与了肿瘤侵袭及转移[13-15],提示EOS可能通过抑制CNE-2细胞中fascin 1蛋白的表达来降低CNE-2细胞的迁移能力,从而降低肿瘤细胞通过血管或淋巴管转移及局部浸润的机会,减少远处转移。
综上所述,EOS能够抑制CNE-2细胞的迁移能力和微血管形成能力,其作用机制可能与EOS能显著抑制CNE-2细胞中fascin 1和VEGF的表达有关。
[1] Maniotis AJ, Folberg R, Hess A, et al. Vascular channel formation by human melanoma cellsinvivoandinvitro: vasculogenic mimicry[J]. Am J Pathol, 1999, 155(3):739-752.
[2] Fidler IJ, Ellis LM. Neoplastic angiogenesis: not all blood vessels are created equal[J]. N Engl J Med, 2004, 351(3):215-216.
[3] 孔 霞,顾帝水,黄培春.口虾蛄提取物对人鼻咽癌细胞P53、COX-2和VEGF表达的影响[J].中国病理生理杂志,2011,27(2):390-393.
[4] 孔 霞,顾帝水,黄培春,等.口虾蛄提取物对人鼻咽癌细胞端粒酶活性的影响[J].中国病理生理杂志, 2010, 26(5):937-940.
[5] 顾帝水,孔 霞,黄培春.等.口虾蛄提取物对体外人鼻咽癌细胞转移潜能的影响[J].时珍国医国药, 2010, 21(2):360-361.
[6] Su M, Feng YJ,Yao LQ,et al.Plasticity of ovarian cancer cell SKOV 3ip and vasculogenic mimicryinvivo[J].Int J Gynecol Cancer, 2008, 18(3):476-486.
[7] Sun B, Qie S,Zhang S,et al.Role and mechanism of vasculogenic mimicry in gastrointestinal stromal tumors[J].Hum Pathol, 2008, 39(3) :444-451.
[8] 赵 静,黄江生,杨爱军,等. 肝细胞癌中血管生成拟态的三维细胞培养及组织学研究[J].癌症, 2007, 26(2):123-126.
[9] Folberg R, Arbieva Z, Moses J, et al. Tumor cell plasticity in uveal elanoma: microenviranment directed dampening of the invasive and metastatic genotype and phenotype accompanies the generation of vasculogenic mimicry patterns[J]. Am J Pathol, 2006,169(4):1376-1389.
[10] Zhao H, Gu XM. Study on vasculogenic mimicry in malignant esophageal stromal tumors[J]. World J Gastroenterol, 2008, 14(15):2430-2433.
[11] Hess AR, Seftor EA, Gruman LM, et al.VE-cadherin regulates EphA2 in aggressive melanoma cells through a novel signaling pathway: implications for vasculogenic mimicry[J]. Cancer Biol Ther, 2006, 5(2):228-233.
[12] 高启龙,陈永强.肿瘤血管生成拟态分子机制及临床意义[J].国际骨科学杂志, 2006, 27(5): 264-267.
[13] Yoder BJ, Tso E, Skacel M,et al. The expression of fascin, an actin-bunding motility protein, correlates with hormone receptor-negative breast cancer and amore aggressive clinical course [J]. Clin Cancer Res, 2005, 11(1): 186-192.
[14] Pelosi G, Pastorino U, Pasini F, et al. Independent prognostic value of fascin immunoreactivity in stage I nonsmall cell lung cancer[J]. Br J Cancer, 2003, 88(4): 537-547.
[15] Xie JJ, Xu LY, Zhang HH, et al. Role of fascin in the proliferation and invasiveness of esophageal carcinoma cells[J]. Biochem Biophys Res Commun,2005, 337 (1): 355-362.
InhibitoryeffectofextractofOratosquillaonmigrationandvasculogenicmimicryinhumannasopharyngealcarcinomacelllineinvitro
KONG Xia1, SHANG Jiu-long2, LI Li3, WU Meng-yan3, BIE Yan-hong3, GU Di-shui1
(1DepartmentofPathophysiology,2DepartmentofPhysiology,3DepartmentofPathology,GuangdongMedicalCollege,Dongguan523808,China.E-mail:gudishui@163.com)
AIM: To study the inhibitory effect of the extract ofOratosquilla(EOS) on the migration and vasculogenic mimicry in human poorly differentiated nasopharyngeal carcinoma cell line CNE-2.METHODSCNE-2 cells were cultured in the medium with different concentrations of EOS (0 mg/L, 125 mg/L, 250 mg/L and 500 mg/L). The migration of CNE-2 cells and the formation of tube-like structures (TLSs) by CNE-2 cells were determined with wound healing assay andinvitroanti-angiogenesis test, respectively. The formation of TLSs by CNE-2 cells and their structural characteristics were observed by anti-angiogenesis test on the Matrigel. The protein expression of fascin 1 and vascular endothelial growth factor (VEGF) was detected by Western blotting.RESULTSCompared with control group, EOS significantly decreased the migration velocity of CNE-2 cells in a dose-dependent manner. CNE-2 cells formed TLSs on the Matrigel, and the formation of TLSs by CNE-2 cells was inhibited by EOS in a dose-dependent manner. The expression of fascin 1 and VEGF in CNE-2 cells was also decreased after treatment with EOS. A positive correlation between the expression of fascin 1/VEGF and the formation of TLSs by CNE-2 cells was observed.CONCLUSIONCNE-2 cells form TLSs on the Matrigel, and EOS inhibits the migration and vasculogenic mimicry of CNE-2 cells, which are related with down-regulating the expression of fascin 1 and VEGF in CNE-2 cells .
Oratosquilla; Nasopharyngeal neoplasms; Vasculogenic mimicry
R739.6
A
10.3969/j.issn.1000- 4718.2013.06.012
1000- 4718(2013)06- 1025- 04
2013- 01- 14
2013- 04- 25
广东省医学科研基金资助项目(No.B2011235);广东省中医药管理局资助课题(No.20122082);东莞市高等院校科研计划(No.200910815267)
△通讯作者 Tel: 0759-22896324; E-mail: gudishui@163.com
