胰岛素与硒合用对糖尿病大鼠心肌重构的影响*
2013-10-24徐天娇曾菊绒胥晓丽
徐天娇, 曾菊绒△, 胥晓丽, 陈 琳, 弥 曼, 魏 明, 李 萍
(1西安医学院药理学教研室,陕西 西安710021; 2陕西省人民医院病理科,陕西 西安 710068)
胰岛素与硒合用对糖尿病大鼠心肌重构的影响*
徐天娇1, 曾菊绒1△, 胥晓丽1, 陈 琳2, 弥 曼1, 魏 明1, 李 萍1
(1西安医学院药理学教研室,陕西 西安710021;2陕西省人民医院病理科,陕西 西安 710068)
目的观察胰岛素与硒合用对糖尿病心肌病大鼠心肌重构的影响并初步探讨其机制。方法SD大鼠经腹腔注射链脲佐菌素(STZ),诱导12周后建成糖尿病大鼠心肌重构动物模型。采用One TouchⅡ血糖仪和血糖试纸测定血糖水平;微柱法测定糖化血红蛋白浓度;酶学法测定甘油三酯和总胆固醇的含量;Mallory三色染色检测心肌组织内胶原纤维含量的变化;双抗体夹心ABC-ELISA法检测血清TNF-α的动态变化,免疫组化检测各组心肌组织TNF-α的表达。结果与对照组比较,模型组大鼠糖脂代谢紊乱,心脏功能明显下降(P<0.01),心肌组织异常胶原纤维大量堆积,血液及心肌组织中TNF-α的表达显著升高(P<0.01)。胰岛素与硒合用比单用胰岛素治疗更能明显改善糖尿病大鼠的糖脂代谢紊乱,减轻心肌胶原网络重构,抑制血液及心肌组织中TNF-α的表达(P<0.01),改善心脏的结构与功能。结论胰岛素与硒合用对糖尿病心肌病大鼠心肌重构有明显的改善作用,其对TNF-α表达的抑制可能是其作用的分子机制之一。
胰岛素; 亚硒酸钠; 糖尿病; 心肌重构; 肿瘤坏死因子
糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病的主要并发症之一,具有极高的病死率和致残率[1],其病理生理特点为左心室舒张功能障碍,晚期也有收缩功能的降低。心肌胶原网络重构和心肌间质纤维化是左心室舒张和收缩功能障碍的主要病理基础[2]。对糖尿病的有效治疗是控制心功能恶化的关键。胰岛素的降糖效果迅速且明显,但长期大量使用疗效降低,并引起低血糖、冠心病等副作用。因此,研制新的组方药物可能会为糖尿病的防治及胰岛素的应用展现崭新的前景。本研究室前期的实验结果已经证明,胰岛素与硒合用能明显降低糖尿病大鼠的血糖及血脂,改善心肌的能量代谢障碍,说明胰岛素与硒合用存在可行性,并摸索出两药的合理配比剂量是1 U·kg-1∶180 μg·kg-1[3]。但胰岛素与硒联合用药对于糖尿病心肌病所致的心肌重构是否具有防治作用尚不明确,本实验旨在阐明两药联合对糖尿病心肌病大鼠心肌重构的作用,并初步探讨其作用机制。
材 料 和 方 法
1主要仪器和试剂
清洁级雄性Sprague-Dawley(SD)大鼠,体重180~200 g,由西安交通大学医学院实验动物中心提供,合格证号为SCXK(陕)2010-0006。分笼饲养,房间温度保持在25 ℃左右,湿度在50%左右。链脲佐菌素(streptozotocin, STZ)和亚硒酸钠购自Sigma,中效胰岛素购自西安交通大学第一附属医院(诺和灵公司)。血糖仪和血糖试纸(强生公司);SABC 免疫组化试剂盒和DAB 显色试剂盒购于博士德公司;肿瘤坏死因子α(tumor necrosis factor α,TNF-α)试剂盒购自上海西唐生物科技有限公司。
2糖尿病心肌病大鼠造模及分组
SD大鼠38只,随机选8只作为正常对照组(control),其余30只为模型组。模型组采用一次性腹腔注射STZ 50 mg·kg-1复制大鼠糖尿病模型,1 周后于大鼠尾尖采血,血糖仪测定血糖,并测尿糖。血糖>16.7 mmol·L-1、尿糖+++~++++者确定为糖尿病模型诱导成功。30只诱导成功的大鼠随机分为3组,每组10只。(1)糖尿病心肌病模型组(DCM):自由饮食和进水;(2)胰岛素(insulin,Ins)干预组(DCM+Ins):皮下注射胰岛素1 U·kg-1·d-1;(3)胰岛素与亚硒酸钠联合干预组(DCM+Ins+Se):皮下注射胰岛素1 U·kg-1·d-1,同时管饲亚硒酸钠180 μg·kg-1·d-1。正常对照组腹腔注射生理盐水,以上各组均以普通饲料持续喂养12周[4]。
3生化指标测定
各组大鼠喂养12周后,处死前腹主动脉采血检测血糖、糖化血红蛋白(hemoglobin A1c,HbA1c)和血脂。采用One TouchⅡ血糖仪和血糖试纸测定血糖水平;微柱法测定HbA1c浓度;酶学法测定甘油三酯 (triglyceride,TG)和总胆固醇(total cholesterol,TC)的含量。
4血清TNF-α表达的动态监测
各组分别于第2、4、6、8、10、12周,空腹12 h后,采用尾部采血2 mL,注入试管中,待凝固后分离血清,低温冷冻离心(3 000 r·min-1,4 ℃) 15 min。双抗体夹心ABC-ELISA法检测TNF-α,严格按照试剂盒说明书进行操作。
5大鼠心脏功能检测
各组大鼠处死之前,先监测血流动力学。动物麻醉后分离右侧颈总动脉,将内径约为1 mm的PE-50聚乙烯导管逆行插入左心室,当血压波变为具有明显舒张期而且峰顶平坦的波形时,表明导管已经进入心室。稳定20 min后,记录左室收缩末压(left ventricular end-systolic pressure,LVESP)、左室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室内压最大上升速率(+dp/dtmax)和左室内压最大下降速率(-dp/dtmax)。
6心肌组织胶原纤维的Mallory染色及定量分析
处死动物后,迅速开胸,摘取心脏,用预冷的生理盐水冲洗心腔中的血块,剪除心脏周围结缔组织和血管,滤纸吸干水分,取左室心肌组织,按Mallory原法固定,处理包埋,切片脱蜡至水,结果使胶原纤维呈蓝色,细胞核深红色,胞浆红色。采用DT2000型图像分析软件2.0进行拍照和分析,测量心肌胶原容积分数(collagen volume fraction,CVF),CVF=心肌胶原面积/所测视野总面积,所有标本随机取8个视野测量,取平均值。
7免疫组化检测心肌组织TNF-α的表达
取心肌组织,4%多聚甲醛固定,常规石蜡包埋,切片;3% H2O2室温孵育10 min,正常山羊血清封闭20 min;滴加1∶500 TNF-α抗体,37 ℃孵育1 h,缓冲液清洗;滴加生物素标记的Ⅱ抗,37 ℃ 孵育20 min;PBS洗3次,滴加SABC 37 ℃ 孵育20 min;DAB显色,PBS清洗;苏木素轻度复染,乙醇脱水,中性树胶封片。
8统计学处理
采用SPSS 13.0 统计软件处理数据,数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1动物一般情况
模型组多食、多饮、多尿,体质量明显减轻,血糖水平升高,符合糖尿病的诊断标准;药物干预各组按实验设计给予药物,各组动物均以普通饲料喂养12周后,模型组死亡2只,药物干预组各死亡1只,尸检结果表明死于感染及糖尿病并发症。对照组为8只。
2胰岛素与硒联合应用对糖尿病大鼠糖脂代谢的影响
与对照组比较,模型组及药物干预组血糖、HbAIc、TC和TG水平明显升高(P<0.01);与模型组比较,胰岛素单用组及胰岛素与硒联合用药组的血糖、HbA1c、TC和TG水平均明显降低(P<0.01);与胰岛素单用组相比,联合用药组各指标下降更为明显(P<0.01)。表明胰岛素与硒联合用药对改善糖尿病大鼠的糖脂代谢更为显著,见表1。
表1胰岛素与硒联合用药对糖尿病大鼠糖脂代谢的影响
Table 1. Effects of combination of insulin(Ins,1 U·kg-1) and selenium(Se,180 μg·kg-1) on blood glucose and blood lipid in DCM rats(Mean±SD)

GroupnBG(mmol·L-1)HbA1c(%)TC(mmol/L)TG(mmol/L)Control85.42±0.705.17±0.641.62±0.140.73±0.08DCM821.46±3.76△△8.98±1.02△△2.98±0.24△△1.83±0.09△△DCM+Ins915.48±1.74△△**7.02±0.45△△**2.90±1.89△△1.51±0.07△△**DCM+Ins+Se99.03±1.08△△**##5.85±0.33**##2.22±0.23△△**##1.10±0.15△△**##
△△P<0.01vscontrol group;**P<0.01vsDCM group;##P<0.01vsDCM+Ins group.
3各组动物心功能参数比较
由表2可见,与对照组比较,模型组及药物干预组+dp/dtmax明显增大(P<0.01),LVSP、LVEDP和-dp/dtmax明显减小(P<0.01)。说明经STZ诱导12周后,心脏收缩及舒张功能均有不同程度的下降,与对照组比较,模型组心功能降低最为明显(P<0.01),从心功能方面提示了动物模型的制备比较成功;与模型组比较,药物干预各组心脏功能明显改善(P<0.01),但与胰岛素给药组比较,胰岛素与硒合用组心功能的改善更为明显(P<0.01)。

表2 各组心功能参数的比较
△△P<0.01vscontrol group;*P<0.05,**P<0.01vsDCM group;##P<0.01vsDCM+Ins group.
4心肌胶原纤维Mallory染色
正常对照组心肌纤维呈束状分布,排列整齐、致密,断裂不明显,胶原纤维堆积少。模型组心肌纤维呈现进行性排列紊乱、增粗,肌纤维间隙明显增宽,并可见大量异常胶原纤维堆积。胰岛素单独给药组及联合用药组心肌纤维排列紊乱、增粗及间隙增宽等现象均明显减轻,异常胶原纤维堆积均显著减少,但联合用药组比单用胰岛素治疗改善更明显,见图1。这说明胰岛素与硒联合应用治疗糖尿病能明显改善心肌胶原网络重构。

Figure 1. Mallory staining of myocardium collagen fiber in rats (×400). A:control; B: DCM; C: DCM+Ins; D: DCM+Ins+Se.
图1心肌胶原纤维Mallory染色
5大鼠心肌胶原纤维定量分析
与对照组比较,模型组及药物干预各组CVF均增高(P<0.05或P<0.01);与模型组比较,药物干预各组CVF均不同程度降低,差异有统计学意义(P<0.01);与胰岛素单独给药组比较,胰岛素与硒联合应用组CVF降低更加明显(P<0.01),提示联合用药能明显减少心肌胶原纤维堆积,见图2。
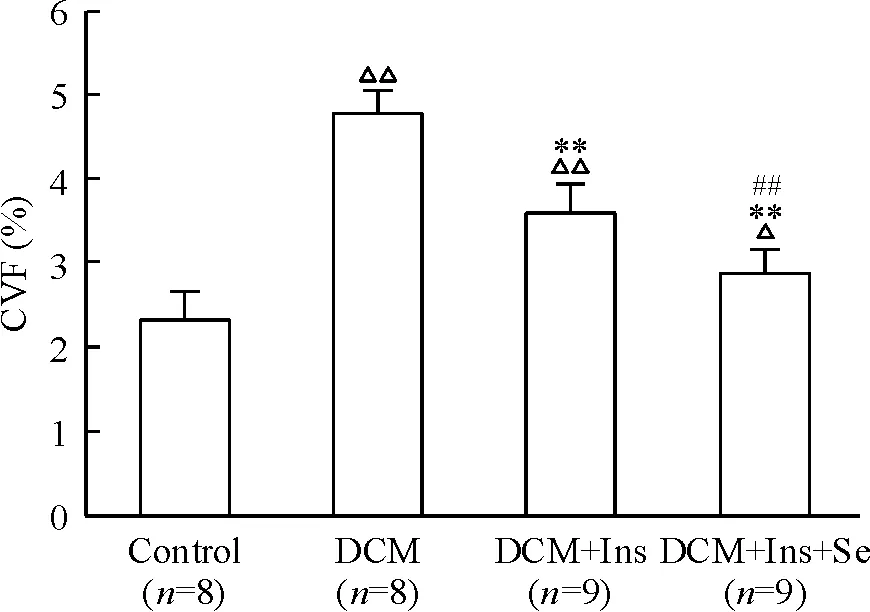
Figure 2. Comparison of collagen volume fraction in myocardium among groups.Mean±SD.△P<0.05,△△P<0.01vscontrol group;**P<0.01vsDCM group;##P<0.01vsDCM+Ins group.
图2各组心肌胶原纤维容积分数的比较
6各组大鼠血清TNF-α的动态变化
由图3可见,模型组大鼠血清TNF-α浓度呈时间依赖性升高,明显高于其它组,提示糖尿病大鼠TNF-α在血清中的浓度随着病变程度的加重而升高。药物干预后TNF-α均有明显下降,但依然高于正常水平。然而胰岛素与硒联合用药TNF-α浓度的下降较单用胰岛素组更为显著。

Figure 3. Dynamic changes of TNF-α in serum of rats in each group. Mean±SD.**P<0.01vscontrol;##P<0.01vsDCM;△△P<0.01vsDCM+Ins.
图3各组大鼠血清TNF-α的动态变化
7心肌组织中TNF-α表达
镜下可见,TNF-α表达部位主要在心肌间质及成纤维细胞胞浆,其胞核内和心肌细胞内较少,阳性结果为胞浆出现不同浓度的棕黄色颗粒。与正常对照组比较,模型组心肌间质及成纤维细胞胞浆TNF-α染色明显增强;药物干预各组染色均比模型组减弱,但胰岛素与硒联合用药TNF-α染色减弱比单用胰岛素组更明显,见图4。
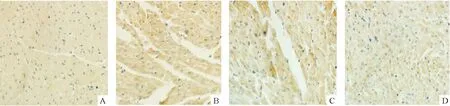
Figure 4. Immunohistochemical staining of TNF-α in the myocardium of rats (×400).A: control; B: DCM; C: DCM+Ins; D: DCM+Ins+Se.
图4免疫组化检测大鼠心肌组织TNF-α表达
讨 论
心肌胶原网络重构和间质纤维化是糖尿病心肌病的特征性病理改变,最终将导致心室收缩及舒张功能障碍,诱发心力衰竭[5]。糖代谢紊乱是加速糖尿病心肌病发生发展的重要原因,高血糖作为独立的危险因素,直接引起心肌损害而导致心脏功能恶化。因此,安全而有效地控制高血糖对治疗糖尿病心肌病具有十分重要的意义。硒是人体必须的微量元素,其缺乏将会导致肿瘤和心血管疾病的产生。将胰岛素与硒联合应用是基于硒的抗氧化作用及类胰岛素样作用[6-7]。硒的类胰岛素样作用已经在糖利用[8]和糖代谢[9]方面得到了证实。Ghosh等[10]的研究也表明,糖尿病大鼠经硒治疗后,胰岛素水平明显升高。因此胰岛素与硒联合应用应该优于单用胰岛素治疗。前期的研究结果已证明,将胰岛素与硒合用治疗糖尿病,明显改善了糖尿病大鼠的糖脂代谢紊乱,为延缓并防治心肌损伤提供了条件[3]。
本实验采用STZ成功诱导糖尿病大鼠心肌重构动物模型,12 周后通过心功能指标检测,模型组有明显的心脏舒缩功能障碍,Mallory染色显示心肌纤维排列紊乱、增粗及间隙增宽,异常胶原纤维堆积增多,表明长期的糖脂代谢异常必将导致心脏结构破坏及功能的恶化。胰岛素与硒联合用药比单独应用胰岛素治疗更能显著改善心脏的结构及功能。
研究表明,炎症在糖尿病心肌重构过程中起着十分重要的作用[11]。TNF-α是一种重要的促炎细胞因子,在正常血清及心肌组织表达较少,但在病理因素的刺激下,TNF-α分泌增加,参与心肌重构[12-13]。本实验结果表明,模型组从第2周开始血清中的TNF-α持续高表达,第12周检测结果显示血清及心肌组织TNF-α的表达均明显高于对照组。胰岛素与硒合用比单独应用胰岛素治疗更能有效抑制血液及心肌组织中TNF-α的表达,减轻心肌重构的程度,改善心功能。
总之,本研究结果表明:胰岛素与硒合用比单独使用胰岛素治疗更能有效改善糖尿病大鼠的糖脂代谢紊乱,减轻心肌胶原网络重构,改善心脏的结构与功能,拮抗单用胰岛素治疗易引起冠心病的风险,其作用机制可能与抑制TNF-α的表达有关。本实验两药合用和单用胰岛素时胰岛素的剂量一致,故合用时减少胰岛素剂量能否达到同样的效果,尚有待进一步研究。此外,胰岛素与硒联合用药对糖尿病大鼠心肌保护作用的详细分子机制及其信号转导亦有待后续实验的进一步阐明。
[1] Battiprolu PK, Cillette TG, Wang ZV, et al. Diabetic cardiomyopathy: mechanisms and therapeutic targets [J]. Drug Discov Today Dis Mech, 2010, 7(2): e135-e143.
[2] 韦金儒,张雅莉. 3-硝基酪氨酸与糖尿病心肌病大鼠心肌细胞凋亡的关系研究[J]. 中国病理生理杂志,2011,27(2):243-248.
[3] 徐天娇,袁秉祥,邹亚敏. 胰岛素与硒对链脲佐菌素诱导的糖尿病大鼠心肌胰岛素信号转导的联合作用[J]. 药学学报,2011,46(3):274-279.
[4] 黄 鑫,李宾公,郑泽琪,等. 神经调节蛋白-1对糖尿病心肌病大鼠心肌重构的影响[J]. 中国药理学通报, 2011,27(11):1532-1536.
[5] Cheng S, Vasan RS. Advances in the epidemiology of heart failure and left ventricular remodeling [J]. Circulation, 2011, 124(20): 516-519.
[6] Stapleton SR. Selenium: an insulin-mimetic [J]. Cell Mol Life Sci, 2000, 57(13-14): 1874-1879.
[7] Berger EA, Reul B, Ozcelikay AT, et al. Insulin-like effects of vanadate and selenate on the expression of glucose-6-phosphate dehydrogenase and fatty acid synthase in diabetic rats[J]. Biochimie, 1995, 77(12): 919-924.
[8] 张 雷,陈立梅,倪红霞,等.葛根素影响链脲佐菌素诱导糖尿病大鼠脂肪细胞葡萄糖转运蛋白4的表达[J].中国临床康复,2006,10(39): 135-138.
[9] Ersoz G, Yakaryilmaz A, Turan B. Effects of sodium selenite treatment on platelet aggregation of streptozatocin-induced diabetic rats [J]. Thromb Res, 2003, 111(6): 363-367.
[10] Ghosh R, Mukherjee B, Chatterjee M. A novel effect of selenium on streptozatocin-induced diabetic mice [J]. Diabetes Res, 1994, 25(4):165-171.
[11] Mohanraj R, Partha M, Sandor B, et al. Cannabidiol attenuates cardiac dysfunction, oxidative stress, fibrosis, and inflammatory and cell death signaling pathways in diabetic cardiomyopathy [J]. J Am Coll Cardiol, 2010, 56(25):2115-2125.
[12] 郭艳琳,张华屏,郭建红,等. 曲古抑菌素A对心衰大鼠心脏促炎细胞因子及心功能的影响[J]. 中国病理生理杂志,2011,27(3):425- 429.
[13] Voloshenyuk TG,Hart AD,Khoutorova E, et al. TNF-α increases cardiac fibroblast lysyl oxidase expression through TGF-β and PI3Kinase signaling pathways[J]. Biochem Biophys Res Commun, 2011, 413(2):370- 375.
Effectofinsulincombinedwithseleniumonmyocardialremodelingindiabeticrats
XU Tian-jiao1, ZENG Ju-rong1, XU Xiao-li1, CHEN Lin2, MI Man1, WEI Ming1, LI Ping1
(1DepartmentofPharmacology,Xi’anMedicalUniversity,Xi’an710021,China;2DepartmentofPathology,ShaanxiProvincialPeople’sHospital,Xi’an710068,China.E-mail:jrzeng988@163.com)
AIM: To investigate the effects of insulin combined with selenium on myocardial remodeling in streptozotocin (STZ)-induced diabetic rats.METHODSThe animal model of diabetic cardiomyopathy was induced by intraperitoneal injection of STZ (50 mg/kg) in rats. The level of blood glucose was estimated using One Touch SureStep blood glucose meter. Hemoglobin A1c level was detected by microcolumn assay. Triglyceride and total cholesterol were measured by enzymatic method. Collagen content in the myocardium was determined by Mallory staining. The expression of tumor necrosis factor α (TNF-α) in the serum and myocardium was observed by the methods of ELISA and immunohistochemistry, respectively.RESULTSCompared with control group, the animals in model group showed metabolic disorders of glucose and lipid, and the cardiac function declined significantly (P<0.01).The myocardial cells showed disorder of distribution, filament breakage and collagen hyperplasia,and serum and myocardial TNF-α levels were significantly elevated.Insulin in combination with selenium significantly decreased the levels of blood glucose and lipid, and markedly inhibited the expression of TNF-α in the serum and myocardium than those in the rats administered with insulin alone (P<0.01).CONCLUSIONCombination of insulin and selenium significantly improves the structure and function of the heart by down-regulation of TNF-α.
Insulin; Sodium selenite; Diabetes mellitus; Myocardial remodeling; Tumor necrosis factor
R963
A
10.3969/j.issn.1000- 4718.2013.06.006
1000- 4718(2013)06- 0993- 05
2012- 12- 10
2013- 04- 10
陕西省教育厅自然科学研究计划(No. 12JK0710)
△通讯作者 Tel: 029-86177562; E-mail: jrzeng988@163.com
