基于DPPH法对紫茎泽兰提取物抗氧化活性的研究
2013-10-24胡楚娇王崇云和兆荣黄罗冬
胡楚娇, 王崇云, 和兆荣, 朱 薇, 黄罗冬
(云南大学生命科学学院,云南昆明 650091)
基于DPPH法对紫茎泽兰提取物抗氧化活性的研究
胡楚娇, 王崇云, 和兆荣, 朱 薇, 黄罗冬
(云南大学生命科学学院,云南昆明 650091)
以维生素C为对照,采用DPPH法研究紫茎泽兰叶和茎醇提物的抗氧化活性,并计算它们的IC50。结果表明:1.6 mg/mL紫茎泽兰叶和茎的醇提物有很好的清除能力,清除率均达到80%以上,相当于0.10 mg/mL维生素C的清除率;紫茎泽兰叶和茎的IC50为0.3、0.7 mg/mL,维生素C为0.04 mg/mL。说明紫茎泽兰叶的清除能力强于茎,紫茎泽兰清除自由基的能力为维生素C的1/10。总之,紫茎泽兰具有较强的抗氧化活性。
紫茎泽兰;提取物;抗氧化活性;维生素C
紫茎泽兰(Ageratinaadenophora)别称破坏草、败马草、解放草、飞机草、黑头草、大毒草、革命草、飞花草等,属菊科(Compositae)假藿香蓟属(AgeratinaL.)多年生草本或亚灌木,也有人将它归入泽兰属(EupatoriumL. )。紫茎泽兰原产于中美洲墨西哥至哥斯达黎加一带[1],大约在1865年作为观赏植物被引入美国、澳大利亚,随后在新西兰、南非、印度、菲律宾、马来西亚、新加坡、印度、泰国和缅甸等地迅速蔓延[2-3]。在1940年左右从缅甸边境入侵我国云南,之后迅速向西南传播扩散。紫茎泽兰的种子很小,且在顶端具有冠状毛,可借冠毛随风传播,此外还可依靠带根的茎快速扩展蔓延,进行无性繁殖[4]。紫茎泽兰有很强的适应能力和抗逆能力,无论在干旱、瘠薄的荒坡隙地,还是在石缝和楼顶都能存活生长,已广泛分布于热带、亚热带的30 多个国家和地区[5]。有研究表明,入侵我国的紫茎泽兰种群具有丰富的遗传多样性,并能产生一定程度的适应性进化,已在形态结构上出现一些适应性的性状[6]。目前,紫茎泽兰已在云南、四川、重庆、贵州、广西等地区蔓延成灾[7-8],而且正以约 60 km/年的速度向北扩张,还有向长江以南大部分地区和西部大部分地区入侵的可能性[9],是我国危害最严重的外来入侵物种之一,已被我国有关部门列为首批入侵国内16种外来物种之首[10]。
天然药物对人体疾病具有显著的预防和治疗作用,主要归因于其含有能清除人体过量自由基的抗氧化成分,抗氧化成分可归纳为黄酮类、苯酚类、皂苷类、鞣质类、生物碱类和其他类等六大类[11]。从紫茎泽兰中分离出100多种化学成分,这些化学成分种类有单萜类、倍半萜类、三萜类、甾体类、黄酮类、苯丙素类及各类衍生物[12],其化学成分的生物活性主要表现为杀虫、抑菌和对其他植物的化感作用等[13-17],但对其抗氧化活性和抗氧化成分的研究还未见报道。所以,本研究利用70%乙醇提取紫茎泽兰叶和茎的有效成分,通过DPPH(1,1-二苯基-2-苦肼基)自由基清除能力初步分析紫茎泽兰的抗氧化能力,以期为进一步开发利用紫茎泽兰提供理论依据,从而更好地防治紫茎泽兰,为这一世界性恶性杂草的利用开辟途径。
1 材料与方法
1.1 材料
试验材料采自云南大学校园,采样时间为2012年11月,凭证标本保存于云南大学植物标本馆。取新鲜的紫茎泽兰洗净阴干,将茎和叶分开,粉碎过40目筛,分别得到叶和茎的粉末,保存备用。
1.2 仪器和试剂
RE-52A型旋转蒸发仪,SHB-BA95型循环水式多用真空泵,7520型分光光度计,Spectrumlab 53 型紫外可见分光光度计,DHG-9141A型电热恒温干燥箱,恒温水浴锅。无水乙醇,70%乙醇,DPPH自由基,维生素C。
1.3 提取物的制备
分别称取紫茎泽兰叶和茎粉末5 g,按固液比 1 g ∶10 mL 加入70%乙醇,冷浸24 h,超声2次,每次 20 min,70~85 ℃下回流提取2次,每次1 h,合并溶剂,旋转蒸发,回收溶剂,制得浸膏,再溶解定容至 50 mL,得原液浓度为100 mg/mL的紫茎泽兰叶和茎醇提物备用。精确称取0.1 g 维生素C,用无水乙醇溶解至100 mL,于4 ℃备用。
1.4 DPPH自由基清除能力的测定
DPPH 法是20世纪50年代提出的,最初用于发现食物中的供氢体,后来被广泛用于定量评价生物制品、酚类和食品的抗氧化能力[18]。DPPH·在有机溶剂中是一种性质很稳定的自由基,醇溶液为紫色,具有单一的未配对电子,能接受1个电子,在517 nm 处有最大的稳定的吸光度。当有自由基清除物质存在时,会结合抗氧化剂而得到电子,使其颜色变浅。在紫外光照射下表现为最大吸收波长处的吸光度下降,且下降程度呈线性关系,从而可以利用这一性质来判断提取物的抗氧化能力[19]。
1.4.1 DPPH·溶液配制 精确称取0.020 2 g DPPH·,加入无水乙醇溶解,定容到100 mL,摇匀,作为储备液,于-20 ℃保存备用。精确吸取上述储备液10 mL,定容到100 mL,得浓度为 0.020 2 mg/mL的工作液,于4 ℃保存备用。
1.4.2 清除DPPH·活性的测定 在试管中加入 2 mL DPPH·溶液和2 mL无水乙醇,混匀,反应 30 min,在517 nm处测定吸光度,计作D0;取紫茎泽兰叶(茎)提取液1 mL,稀释50倍,得2 mg/mL提取液,分别吸取1、2、3、4、5、6、7、8 mL于试管中,定容至10 mL。在试管中加入2 mL DPPH·溶液和2 mL提取液,混匀,反应30 min,在517 nm处测定吸光度,记作Di;取2 mL提取液和2 mL无水乙醇,混匀,反应30 min,在517 nm处测定吸光度,计为Dj;按照公式计算清除率:清除率 = 1-(Di-Dj)/D0×100%,以此评价自由基清除能力,以提取液质量浓度为横坐标,清除率为纵坐标,绘制清除曲线。以维生素C作为阳性对照,将维生素C溶液配成0.02、0.04、0.06、0.08、0.1、0.12、0.14、0.16 mg/mL等8种不同的浓度,按照上述方法测定其517 nm的吸光度并计算清除率。以维生素C质量浓度为横坐标,清除率为纵坐标,绘制维生素C标准曲线,重复3次,求抑制率的平均值。
当抗氧化剂浓度较高时,其浓度与DPPH·清除率不能形成线性关系。因此,清除率往往不能很好地表示自由基的清除能力,也不便于对抗氧化能力进行比较。一般在评价抗氧化剂的抗氧化性能和自由基清除能力时,常选择计算清除率为50%时抗氧化剂对应的质量浓度(半抑制浓度,IC50)作为评价指标[20-21]。IC50越低,抗氧化剂的自由基清除能力越强;IC50越高,清除活性越弱。根据清除率与质量浓度之间的线性关系,计算出紫茎泽兰叶和茎以及维生素C的IC50,通过比较IC50判断紫茎泽兰DPPH自由基的清除能力。
2 结果与分析
2.1 维生素C对DPPH·的清除作用
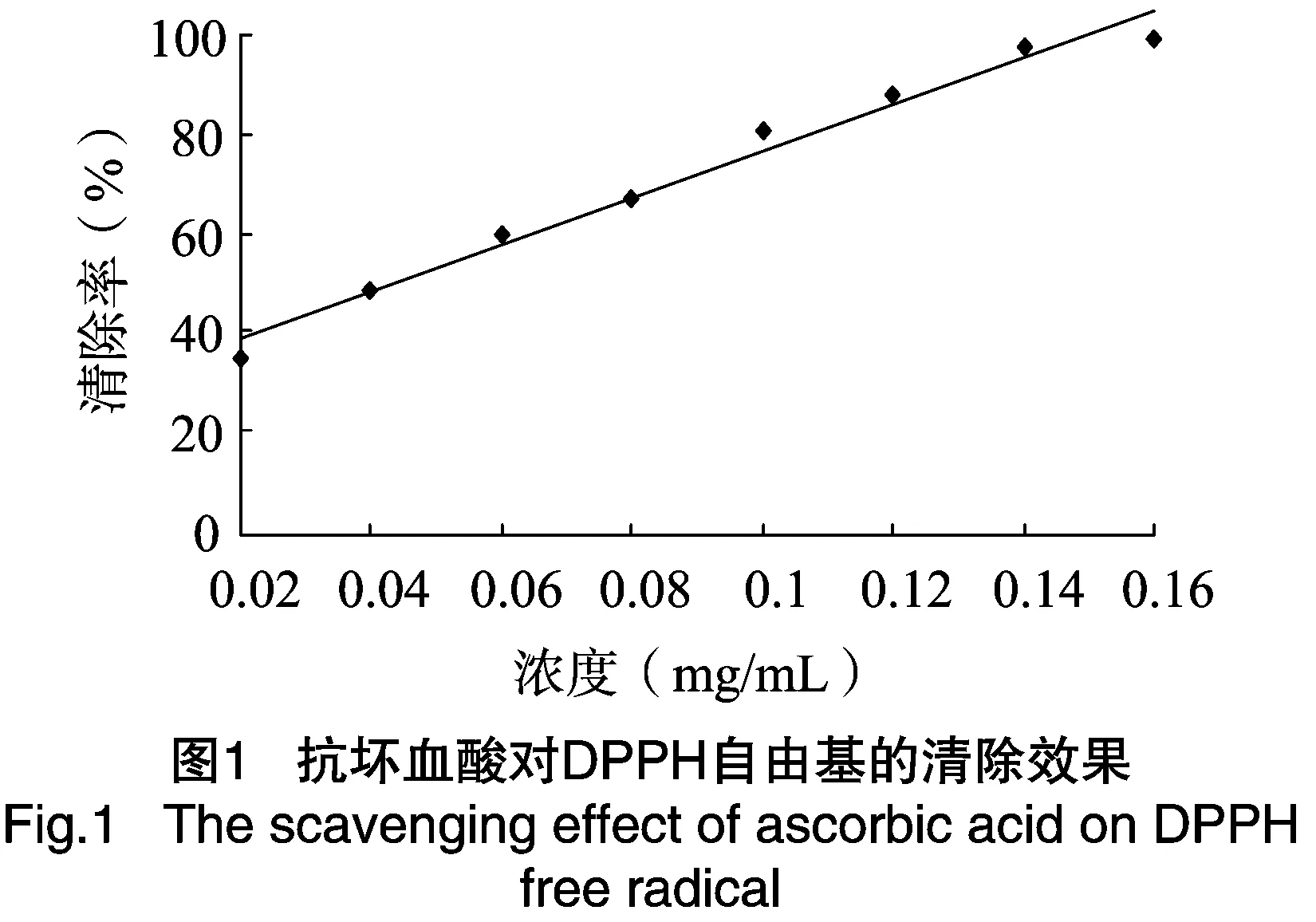
由图1可以看出,维生素C对DPPH·的清除率非常高,回归方程为y=5.142 9x+0.28(r2=0.995 8),随着维生素C浓度的增加,清除率不断变大,当维生素C浓度为0.14 mg/mL时,对DPPH自由基的清除率为99%。
2.2 紫茎泽兰对DPPH·的清除作用

由图2可知,紫茎泽兰叶和茎的醇提液浓度与DPPH·的清除率基本呈线性关系,DPPH·的清除能力随着醇提液浓度的增加而增强。在相同浓度下,紫茎泽兰叶的清除能力明显高于茎的清除能力。当醇提液浓度为1.6 mg/mL时,紫茎泽兰叶和茎的清除率最高分别为87%、80%,均有很好的清除能力,分别相当于0.12、0.10 mg/mL 维生素C的清除能力。
2.3 紫茎泽兰抗氧化活性IC50的测定
经测定,茎泽兰叶、茎和维生素C的IC50分别为0.30、0.70、0.04 mg/mL,紫茎泽兰叶的清除能力强于茎,约为维生素C的1/10。
3 结论与讨论
作为我国危害最严重的外来入侵物种之一,紫茎泽兰具有异株克生现象和惊人的繁殖能力,排斥其他植物的生长,逐渐形成密集成片的单种优势群落,导致原有的植物群落衰退和消失[5,11]。极强的繁殖力、适应力和生命力使紫茎泽兰分布广泛,不断蔓延成灾,很容易就能获得大量的材料。因此,开展紫茎泽兰的活性研究、挖掘其利用价值,不仅可以减少危害,保护生态环境,还能带来较高的生态效益和经济效益,从而使之变害为宝。在本试验条件下,紫茎泽兰叶和茎均有很好的DPPH·清除能力。在相同浓度下,叶的清除能力明显强于茎,说明紫茎泽兰抗氧化活性物质多集中在叶中。
抗氧化物质是指能够清除氧自由基,抑制、消除或减缓氧化反应的一类物质。有关抗氧化物质的来源,目前许多报道认为几乎所有植物都具有抗氧化功能,研究较多的是中草药类、香料类、蔬菜类、水果类、植物饮品和谷物类[20],对分布广泛且廉价的杂草资源研究较少,因此,对紫茎泽兰这一恶性杂草进行抗氧化研究,并从中分离纯化具有高抗氧化活性的物质,具有广泛的原料来源和广阔的运用前景。
本研究首次对紫茎泽兰抗氧化活性进行测定,结果表明紫茎泽兰具有显著的抗氧化能力,为紫茎泽兰抗氧化活性的研究打下了基础,也为开发利用紫茎泽兰资源,为其变害为宝指明了新方向,同时为紫茎泽兰的控制和进一步开发利用提供了理论基础,在紫茎泽兰控制、化学成分研究和抗氧化物质的开发等方面具有重要意义。但其抗氧化的主要活性物质和在体内抗氧化活性,仍需要进一步研究。下一步工作将考虑对紫茎泽兰抗氧化活性成分进行分离纯化,对其结构进行分析鉴定,弄清具有抗氧化活性的化学物质,并开展紫茎泽兰体内抗氧化能力的研究,提出开发利用的参考,最终为紫茎泽兰这一世界性恶性杂草的利用开辟途径。
[1]刘伦辉,谢寿昌,张建华. 紫茎泽兰在我国的分布、危害及防除策略的探讨[J]. 生态学报,1985,5(1):1-6.
[2]罗 强,张 薇,李立娜. 紫茎泽兰的生物入侵及利用现状[J]. 西昌农业高等专科学报,2004,18(2):9-11.
[3]强 胜. 世界性恶性杂草——紫茎泽兰研究的历史及现状[J]. 武汉植物学研究,1998,16(4):366-372.
[4]刘伦辉,刘文耀,郑 征,等. 紫茎泽兰个体生物及生态学特性研究[J]. 生态学报,1989,9(1):66-70.
[5]万方浩,郭建英,王德辉. 中国外来入侵生物的危害与管理对策[J]. 生物多样性,2002,10(1):119-125.
[6]万方浩,刘万学,郭建英,等. 外来植物紫茎泽兰的入侵机理与控制策略研究进展[J]. 中国科学:生命科学,2011,41(1):13-21.
[7]Lu Z J,Ma K P. Spread of the exotic crofton weed (Eupatoriumadenophorum) across southwest China along roads and streams[J]. Weed Science,2006,54:1068-1072.
[8]Shen Y,Liu W,Baskin J M,et a1. Persistent soil seed banks of the globally significant invasive species,Eupatoriurnadenophorumin Yunnan Province,Southwestern China[J]. Seed science research,2006,16(2):157-161.
[9]Papes M,Peteron A T. 紫茎泽兰EupatoriumadenophorumSpreng.在中国入侵分布预测[J]. 武汉植物学研究,2003,21(2):137-142.
[10]徐林波,刘爱萍,王 慧. 外来恶性杂草——紫茎泽兰研究进展及展望[C]//科技创新与绿色植保——中国植物保护学会2006年学术年会论文集.昆明:中国植物保护学会,2006:38-43.
[11]阳志云,刘 峥. 天然药物中的抗氧化成分及评价方法的研究进展[J]. 华夏医学,2005,18(3):492-494.
[12]李永明,李正跃,叶 敏. 紫茎泽兰不同部位的化学成分及其生物活性[J]. 云南农业大学学报,2008,23(1):42-46,72.
[13]丁智慧,郭玉彬,丁靖垲. 紫茎泽兰花的化学成分[J]. 云南植物研究,1999,21(4):505-511.
[14]李蓉涛,丁智慧,丁靖垲. 紫茎泽兰的化学成分[J]. 云南植物研究,1997,19(2):196-200.
[15]任 杰,刘洪位,郭 莉. 紫茎泽兰化学成分初步研究[J]. 广州化工,2011,15(39):123-124.
[16]许云龙,单欣宙,王宗玉,等. 紫茎泽兰的化学成分初报[J]. 云南植物研究,1988,10(2):238-240.
[17]朱正方,杨光忠,栗国强. 紫茎泽兰化学成分的研究(Ⅰ)[J]. 天然产物研究与开发,1997,9(3):35-39.
[18]Blois M S. Antioxidant determinations by the use of a stable free radical[J]. Nature,1958,181:1199-1200.
[19]Bondet V,Brand-Williams W,Berset C. Kinetics and mechanisms of antioxidant activity using the DPPH· free radical method[J]. LWT-Food Science and Technology,1997, 30(6):609-615.
[20]朴香兰. 常见天然抗氧化物质研究[M]. 北京:中央民族大学出版社,2008.
[21]Yang G Q,Wan F H,Liu W X,et al. Physiological effects of allelochemicals from leachates ofAgeratinaadenophora(Spreng.) on rice seedlings[J]. Allelopathy Journal,2006,18(2):237-246.
StudyonAntioxidantActivityofExtractsfromAgeratinaadenophorabasedonDPPHMethod
HU Chu-jiao,WANG Chong-yun,HE Zhao-rong,ZHU Wei,HUANG Luo-dong
(School of Life Science,Yunnan University,Kunming650091,China)
With vitamin C as a reference,the antioxidant activity of ethanol extracts from the leaves and stems ofAgeratinaadenophora(Spreng.) R. M. King & H. Rob. were studied by the DPPH method and their IC50values were calculated. Extracts of both leaves and stems were good scavengers. At 1.6 mg/mL,extracts exhibited the best scavenging activity at above 80%. Their capacities equaled 0.10 mg/mL vitamin C. While the IC50values of leaves and stems were 0.3 and 0.7 mg/mL,that of vitamin C was 0.04 mg/mL. This indicated that the scavenging capacities of leaf extracts were better than stem extracts,and that the scavenging capacities ofA.adenophoraextracts was about 1/10 of vitamin C. ThusA.adenophorahad stronger antioxidant activity than vitamin C.
AgeratinaadenophoraSpreng.;extracts;antioxidant;vitamin C
Q946
A
1003-935X(2013)04-0009-04
胡楚娇,王崇云,和兆荣,等. 基于DPPH法对紫茎泽兰提取物抗氧化活性的研究[J]. 杂草科学,2013,31(4):9-12.
2013-11-26
国家自然科学基金(编号:31160080、31260078)。
胡楚娇(1989—),女,云南昭通人,硕士研究生,主要从事植物分类和植物化学成分研究。E-mail:371129989@qq.com。
和兆荣,副教授,博士,主要从事植物系统分类研究。E-mail:zhrhe@ynu.edu.cn。
