核桃(Juglans regia L.)维生素E代谢相关基因jrVTE3 的克隆与分析
2013-10-22王灿灿杨克强郭先锋安海山
王灿灿,杨克强,孙 翠,郭先锋,安海山,刘 霞
(1.山东农业大学林学院,山东泰安 271018; 2.山东农业大学作物生物学国家重点实验室,山东泰安 271018)
维生素E 是人体必需的脂溶性维生素,又称为“生育酚”,在人体内通过抗氧化作用,增强机体免疫力,具有抗癌、预防心血管疾病和神经紊乱等功效[1-3];在植物体内,维生素E 可清除体内的自由基,保护膜的完整性等作用[4-5]。利用基因组学和遗传学原理,采用分子生物学技术,研究包括维生素E 在内的微营养素(Micronutrients)的合成、代谢和生物功能,提高作物产量,改善作物品质是当今作物育种的一个重要目标[6-7]。2-甲基-6-叶绿基-1,4-苯醌甲基转移酶(MPBQMTase:2-methyl-6-phytyl-1,4-benzoquinol methyltransferase)属于甲基转移酶家族,在维生素E 合成代谢中催化2-甲基-6-植基-1,4-苯醌(MPBQ)向2,3-二甲基-5-植基-1,4-苯醌(DMPBQ)的合成,是γ-生育酚和α-生育酚生物合成过程中的关键酶。编码该酶的基因VTE3 在蓝藻聚球藻(Synechocystis sp PCC6803)和拟南芥(Arabidopsis thaliana)中已被克隆[8-9]。将拟南芥VTE3和γ-生育酚甲基转移酶(VTE4:γ-tocopherol methyltransferase)基因共同转入大豆(Glycine max),可使大豆种子中的α-生育酚含量增加约85%[10]。徐妙云等[11]将大豆Gm VTE3 基因在烟草(Nicotiana tabacum)中过量表达,虽然转基因烟草种子中总生育酚水平与野生型烟草种子相比变化不大,但烟草种子中γ-生育酚与δ-生育酚的比值明显增高,最高可达2 倍。核桃(Juglans regia L.)是我国重要的木本粮油战略树种,被认为是“21世纪的超级食品”,维生素E 是核桃营养构成的重要组分,总生育酚含量在5.57~34.74 mg/100 g 之间[12-15]。本研究利用RTPCR,通过RACE(rapid-amplification of cDNA ends)方法,克隆得到了核桃jrVTE3 基因,并对其序列特征进行了生物信息学分析,以期为研究核桃维生素E代谢,为核桃维生素E 含量和组分改良的分子设计育种奠定基础。
1 材料与方法
1.1 植物材料、载体、菌株及试剂
供试植物材料为9年生早实核桃‘香玲’开花后90 d 时的核桃胚组织。
The SMARTTMRACE cDNA Amplification Kit、Reverse Transcription and cDNA Synthesis Kit 购自BD Bioscience Clontech 公司;Agarose Gel DNA Purification Kit、pMD18-T Kit、大肠杆菌DH5α 菌株、M-MLV 反转录酶、Taq 酶及Advantage Polymerase 购自TaKaRa 公司;DNA 胶回收Kit、小量质粒抽提Kit 购自上海生工;dNTP、引物由上海生工合成。其它试剂均为进口或国产分析纯。cDNA 测序由博尚生物技术有限公司完成。
1.2 核桃jrVTE3 基因克隆的方法
1.2.1 RNA 提取和cDNA 第一链合成 采用改良CTAB 法[16]提取供试材料总RNA。cDNA 第一链的合成按Reverse Transcription and cDNA Synthesis Kit 试剂盒说明操作。
1.2.2 jrVTE3 中间片段的克隆 根据植物MPBQ 基因的保守序列,设计扩增jrVTE3 基因中间片段的简并引物:jrVTE3-F:GAG GGM GAY GCH GAG GAY CT;jrVTE3-R:CG VAC RCC DCK RTA CCA CTT。采用50μL 反应体系:1μL cDNA 模板(100 ng·μL-1),1μL jrVTE3-F (10μmol·μL-1),1μL jrVTE3-R(10μmol·μL-1),5μL 10×Advantage Buffer (Mg2+plus),1μL 50×dNTP mix (2.5 mmol·μL-1),0.5μL Advantage Polymerase(5U),40.5μL ddH2O。PCR 循环参数:95℃3 min,1cycle;94℃20 s,54℃20 s,72℃30 s,40 cycles;72℃5 min。
扩增产物经1.5%琼脂糖凝胶电泳,按照Agarose Gel DNA Purification Kit 说明的操作步骤,回收目的片段。将目的片段连接到pMD18-T 载体,转化DH5α 感受态细胞,将菌体均匀涂在含有X-gal/IPTG[20μL X-Gal(50 mg·mL-1),10μL IPTG(240 mg·mL-1)]的Amp(100 mg·mL-1)抗生素平板上,37℃培养过夜。挑取阳性菌株接种于含Amp 的液体培养基中,37℃过夜,再进行单克隆菌液PCR 鉴定。PCR 体系为3μL 10×rTaq Buffer,0.5μL 50×dNTP mix (2.5 mmol·μL-1),引物M13 F/R 各0.5μL(10μmol·μL-1),0.25μL Advantage Polymerase(5U),1μL 菌液,加ddH2O 至30μL。PCR 循环参数:95℃3 min;94℃20 s,57℃20 s,72℃30 s,35 cycles;72℃10 min。鉴定的菌株由博尚生物技术有限公司测序。
1.2.3 jrVTE3 的3'-RACE和5'-RACE 及全长克隆 根据jrVTE3 中间片段的扩增结果,分别设计3'-RACE 及5'-RACE 特异引物:GSPF:5'ATGCCGAGGATCTTCCATTCCCAAC3';GSPR:5'TTGGGAAGAGCATCCACATGTCAGC3'。按照试剂盒说明制备3'-RACE 及5'-RACE-Ready cDNA。然后分别进行3'-RACE和5'-RACE 的PCR 扩增。PCR 反应体系为5μL 10×Adevantage Buffer(Mg2+plus),1μL 50×dNTP mix (2.5 mmol·μL-1),1μL 10×UPM (通用引物)(10μmol·μL-1),1μL GSPF/R(10μmol·μL-1),0.5μL Adevantage Polymerase(5U),1μL 3'-RACE-Ready cDNA/5-RACE-Ready cDNA(100 ng·μL-1),加ddH2O 至50μL。PCR 循环参数为94℃30 s,72℃3 min,5 cycle;94℃30 s,70℃30 s,72℃3 min,5cycle;94℃30 s,68℃30 s,72℃3 min,25 cycle。参照1.2.2 的方法分别回收3'-RACE和5'-RACE 的PCR 扩增产物,并克隆、鉴定、测序。
用DNAman(6.0)软件拼接中间片段、3'-RACE和5'-RACE 的测序结果,根据拼接结果,设计jrVTE3基因全长克隆特异引物:MFL-F:5’ATCCTTCACGAAACTCTATCAG3’;MFL-R:5’TAGTTGATTGGCTGGGAAAG3’。参照1.2.2 的方法,PCR 扩增jrVTE3 基因全长。
1.2.4 jrVTE3 编码的多肽序列分析 用ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.htmL)寻找jrVTE3 的开放阅读框(open reading frame,ORF);用BioEdit(7.0.5.3)软件对jrVTE3 基因编码的多肽特点进行分析;用PBIL LYON-GERLAND 数据库(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)对多肽序列的进行二级结构预测。用SMART(http://smart.embl-heidelberg.de/smart)分析氨基酸序列的跨膜区域;在NCBI(http://blast.ncbi.nlm.nih.gov/Blast.cgi)搜寻jrVTE3 保守域。
1.2.5 jrVTE3 的同源性分析利用 ClustalX(http://molecularevolution.org/software/alignment/clustal)软件进行同源性序列的多重排定。用MEGA 5.0.3(http://www.megasoftware.net/mega.php)软件基于Kimura 双参数模型构建Neighbor-Joining 系统发育树,经Bootstrap 1000 次循环检验系统树的可靠性[17]。用DANman(6.0)软件比较jrVTE3 基因编码的氨基酸序列与其他植物的MPBQ 基因编码的氨基酸序列的同源性。
2 结果与分析
2.1 jrVTE3 中间片段的扩增结果
采用改良CTAB 法从开花后90 d 核桃胚组织中提取总RNA,反转录获得cDNA。以cDNA为模版,用兼并引物jrVTE3-F/R 进行PCR 扩增,在近300 bp 处获得与预期大小相符的条带(图1)。测序结果表明,该片段长度为302 bp(图2)。在GenBank 中比较发现,该序列与其它植物已知的jrVTE3 基因同源性高达85%以上,表明扩增的片段为核桃jrVTE3 基因的中间片段。
2.2 jrVTE3 的RACE 扩增及全长克隆结果
在中间片段的内侧,设计基因特异引物GSPF和GSPR。分别进行3'-RACE 及5'-RACE 扩增,3'-RACE 扩增产物长918 bp,5'-RACE 扩增产物长1027 bp(图2 A,图2B)。对3'端片段、5'端片段测序结果进行拼接,在5'-RACE 序列与3'-RACE 序列重叠区域内,部分片段与中间片段完全重叠,说明3'-RACE 及5'-RACE 扩增的结果是可信的。
用全长引物jrVTE3-F和jrVTE3-R 扩增cDNA 全长,获得长约1300 bp 的片段(图2C)。测序结果显示,该片段序列长为1280 bp,在第687-958 碱基间有272 bp 的碱基序列和jrVTE3 中间片段序列完全重叠,说明这一序列为核桃jrVTE3 基因序列全长(图2C,图3)。
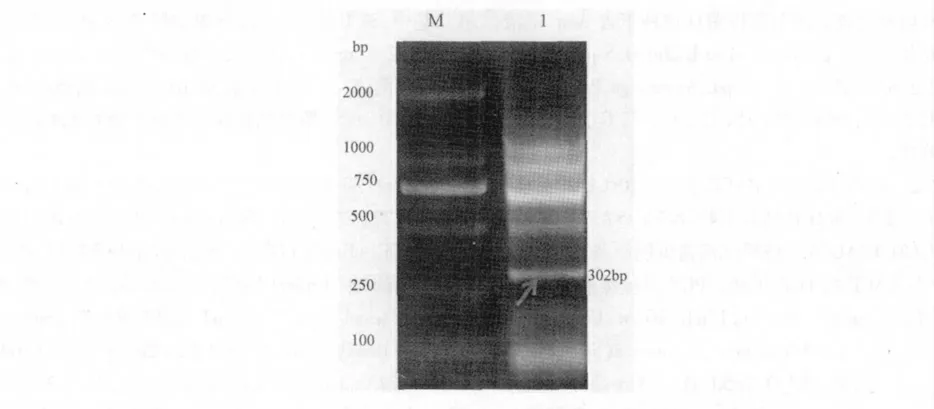
图1 jrVTE3 基因中间片段的扩增Fig.1 The diagram shows intermediate fragments of jrVTE3 amplified by PCR M:Marker DL2000;泳道1:中间片段的扩增结果(目标片段如箭头所示)
中间片段的测序结果为:
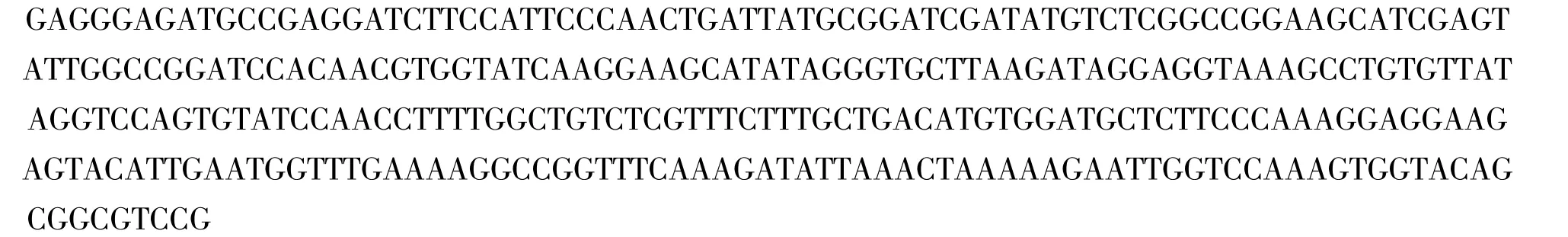
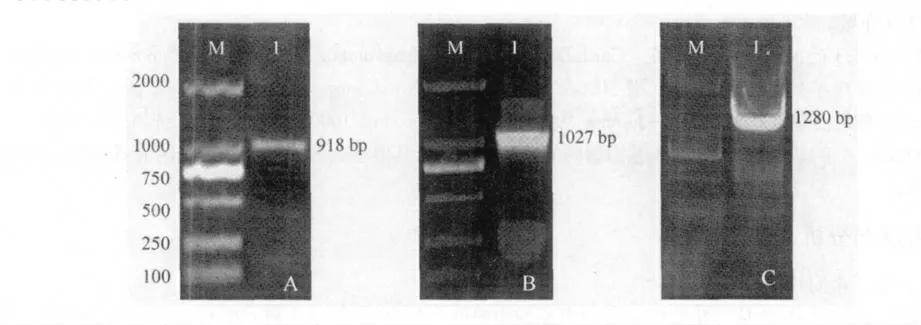
图2 jrVTE3 基因的克隆Fig.2 Clone of jrVTE3
2.3 jrVTE3 编码的多肽序列特点
在jrVTE3 序列在第181-1200 碱基处有长1020 bp 的开放阅读框,编码340 氨基酸(图3),其中强碱性氨基酸(K、R,H)有50个,强酸性氨基酸(D,E)有37个,疏水氨基酸(A、I、L、F、W、V、P,M)有160个,不带电荷的极性氨基酸(N、C、Q、S、T、Y,G)有91个。磷酸化位点分析表明,有10个丝氨酸(Ser),1个苏氨酸(Thr)和4个色氨酸(Tyr)位点,可能成为蛋白激酶磷酸化位点。jrVTE3 基因编码的氨基酸疏水性最小值为-2.378,最大值达到2.556。多肽序列二级结构中延伸链(Extended strand)占45.00%,α–螺旋(Alpha helix)占39.41%,无规则卷曲(Random coil)占15.59%。
在多肽序列第121-130 氨基酸间有一个低成分复杂性(low compositional complexity,LCC)区域,在第307-329 氨基酸间有一个跨膜区段(Transmembrane segments,TS)(图3)。在第117-214 氨基酸间包含一个S-甲基转移酶(AdoMet-MTases)保守域(图4)。
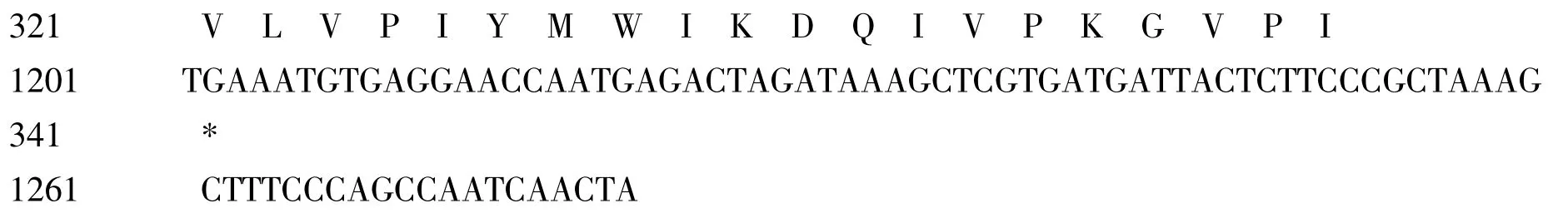
图3 jrVTE3 序列全长和最大开放阅读框架编码的氨基酸序列Fig.3 Full length gene of jrVTE3 and amino acid sequence of the largest open reading frame
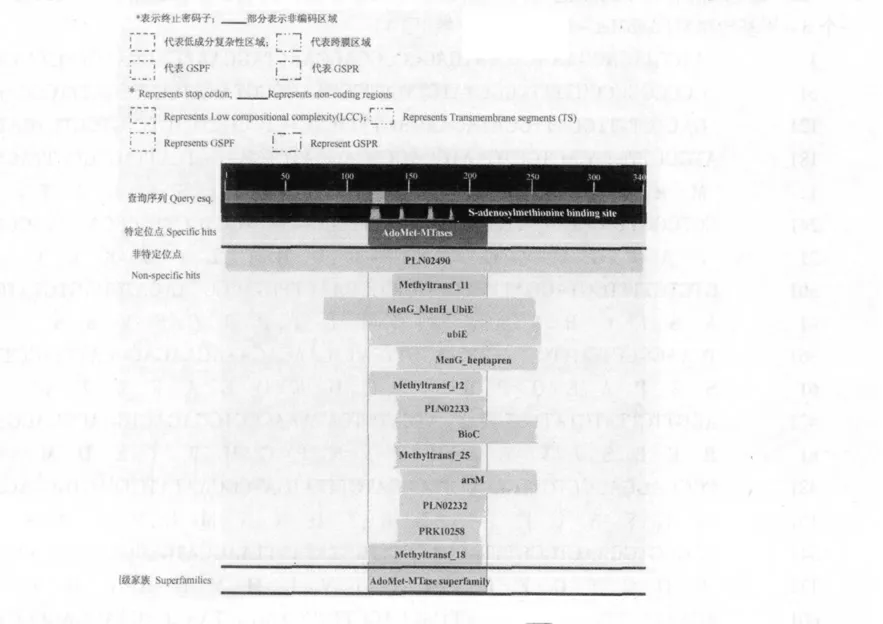
图4 jrVTE3 多肽序列的保守域结构Fig.4 Conserved domains of amino acid sequences of jrVTE3
2.3 jrVTE3 序列的同源性分析
对jrVTE3 的cDNA 序列进行BLAST 同源性分析,挑选了11 条同源性较高的其他植物cDNA 序列,进行系统发育研究。结果发现,jrVTE3 基因与毛果杨(Populus trichocarpa)MPBQ/MSBQ 甲基转移酶基因POPTRDRAFT_832825、蓖麻(Ricinus communis)叶绿体内膜包装蛋白(chloroplast inner envelope protein)基因RCOM_0910770、葡萄(Vitis vinifera)37 kDa 内膜包装蛋白基因LOC100266496、大豆(Glycine max)37 kDa 内膜包装蛋白基因LOC100814346和LOC100788766 的同源性较高,可聚为一类(图5 A)。其他如菠菜(Spinacia oleracea)叶绿体37 kDa 内膜包装膜蛋白mRNA 序列X56963、葡萄37 kDa 内膜包装蛋白基因LOC100240861、大豆37 kDa 内膜包装蛋白基因LOC100806615、毛果杨MPBQ/MSBQ 甲基转移酶基因POPTRDRAFT_643239、橡胶(Hevea brasiliensis)mpbqmt(2-methyl-6-phytylbenzoquinone methyltranferase)基因AB376092和mggbqmt(2-methyl-6-geranylgeranylbenzoquinone methyltranferase)基因AB376094 聚为一类(图5 B)。
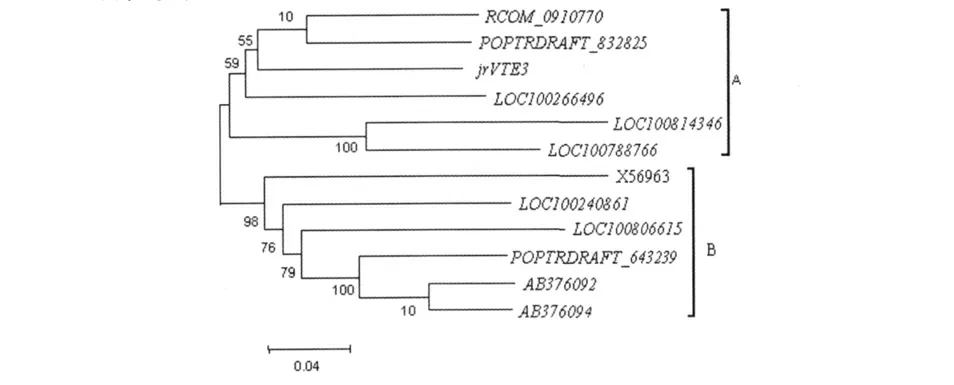
图5 jrVTE3 基因与其它植物同源基因的进化树Fig.5 Phylogenetic tree of jrVTE3 and other homologue genes
对jrVTE3 编码的氨基酸序列BLAST 比较,选择橡胶AB376092(mpbqmt)基因编码的蛋白序列BAH10641,葡萄LOC100240861 基因编码的XP_002281313 蛋白序列及LOC100266496 基因编码的XP_002283783 蛋白序列,莴苣(Lactuca sativa)MPBQ/MSBQ 转移酶基因FJ376654 编码的ACP43457 蛋白序列,毛果杨POPTRDRAFT_643239 基因编码的XP_002300813 蛋白序列、POPTRDRAFT_832825 基因编码的XP_002312559 蛋白序列、POPTRDRAFT_559613 基因编码的蛋白XP_002307615 序列,蓖麻内膜包装蛋白RCOM_0910770、RCOM_0990980 基因编码的XP_002517053和XP_002520956 蛋白序列,共9 条蛋白质多肽序列。DANman 软件对蛋白序列的同源性比较发现,这些多肽序列的一致性高达86.95%(图7)。
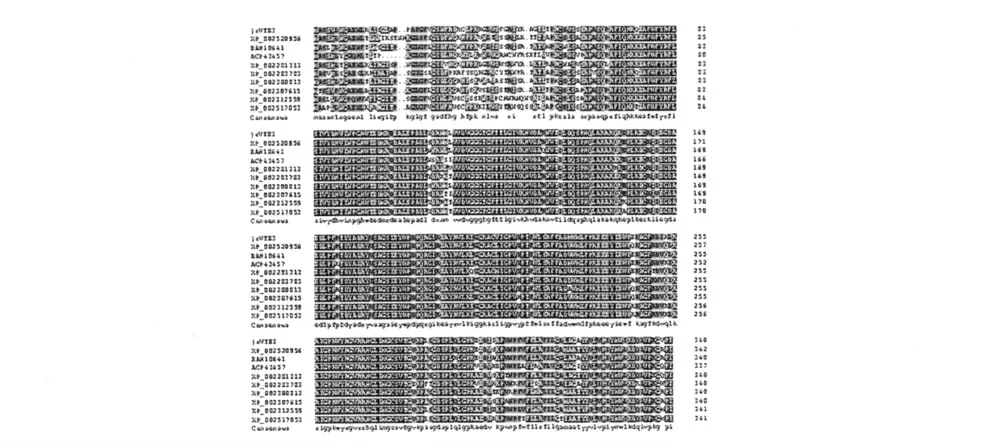
图6 jrVTE3 与选择的其它植物的组蛋白同源性的比较Fig.6 Multiple sequence alignment of jrVTE3 with other plant homologue genes
3 讨论
‘香玲’核桃坚果仁生育酚总含量在7.81~11.18 mg·100g-1,是重要的天然维生素E 源[12]。核桃胚在开花后90 d 处于营养合成代谢的旺盛时期,脂肪等营养物质的含量增加最快[18]。在油菜(Brassica napus)种子脂肪合成快速增加的时期,生育酚的生物合成也快速启动[19]。因此本研究以‘香玲’核桃开花后90 d 的胚组织为材料,利用RACE 技术克隆了核桃2-甲基-6-叶绿基-1,4-苯醌甲基转移酶基因。
jrVTE3 多肽序列中,除有一个低成分复杂性区域和一个跨膜区段外,还有一个第一类S-腺苷甲硫氨酸甲基转移酶(AdoMet-MTases,Class I)的保守域(图4,图5)。AdoMet-MTases(Class I)以AdoMet(SAdenosyl-L-methionine)为底物,催化其上甲基向蛋白质、核酸、脂质等分子的N 或者O 原子等核受体(nucleophilic acceptor)转移[20-21]。jrVTE3 编码多肽序列的这些结构特点和其作为甲基转移酶的功能是统一的。现已证实,除羟基苯丙酮酸双加氧酶(p-hydroxyphenylpyruvate dioxygenase,HPPD)外,所有与生育酚生物合成相关的酶类均定位于叶绿体内膜(inner chloroplast envelope)[22]。经KEGG (Kyoto Encyclopedia of Genes and Genomes)(http://www.genome.jp/kegg/)查询,上述基因(或蛋白质)在功能上均参与泛醌(Ubiquinone)和其他萜类化合物(Terpenoid-quinone)的生物合成,主要的催化2-甲基-6-植基-1,4-苯醌(MPBQ)向2,3-二甲基-5-植基-1,4-苯醌(DMPBQ)的合成,和其他植物VTE3 基因的功能一致[8,23]
在已克隆的调控植物生育酚生物合成的5个基因中,经遗传转化表明,生育酚环化酶基因(VTE1:tocopherol cyclase)、尿黑酸叶绿基转移酶基因(VTE2:homogentisic acid phytyltransferase)、VTE4、植醇激酶基因(VTE5:phytol kinase)在功能上均能提高生育酚总含量,改变生育酚组成成分[8,18,24]。VTE3 的表达及活性对植物生育酚总含量的影响不大,但可以改变植生育酚的组成[10,11]。在胁迫条件下,低温对VTE3 的表达没有变化,高盐和无光条件条件均使VTE3 的表达显著降低[25]。核桃jrVTE3 基因的克隆成功,对于进一步研究核桃坚果仁中维生素E 的合成的调控机制和核桃品质的遗传改良具有重要意义,相关研究正在进行当中。
[1]Lee HJ,Ju J,Paul S,et al.Mixed Tocopherols Prevent Mammary Tumorigenesis by Inhibiting Estrogen Action and Activating PPAR-γ[J].Clinical Cancer Research,2009,15:4242-4249
[2]Yu W,Park SK,Jia L,et al.RRR-γ-tocopherol induces human breast cancer cells to undergo apoptosis via death receptor 5 (DR5)-mediated apoptotic signaling[J].Cancer Letters,2008,259(2):165-176
[3]Shintani D,DellaPenna D.Elevating the vitamin E content of plants through metabolic engineering[J].Science,1998,282 (5396):2098-2100
[4]Li Z,Keasling JD,Niyogi KK.Overlapping photoprotective function of vitamin E and carotenoids in Chlamydomonas[J].Plant Physiology,2012,158(1):313-323
[5]Fryer MJ.The antioxidant effects of thylakoid vitamin E (a-tocopherol)[J].Plant Cell Environ,1992,15(4):381-392
[6]Fitzpatrick TB,Basset GJ,Borel P,et al.Fernie AR.Vitamin Deficiencies in Humans:Can Plant Science Help[J].Plant Cell,2012,24:395-414
[7]Gilliland LU,Magallanes-Lundback M,Hemming C,et al.Genetic basis for natural variation in seed vitamin E levels in Arabidopsis thaliana[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(49):18834-18841
[8]Cheng Z,Sattler S,Maeda H,et al.Highly divergent methyltransferases catalyze a conserved reaction in tocopherol and plastoquinone synthesis in cyanobacteria and photosynthetic eukaryotes[J].Plant Cell,2003,15:2343-2356
[9]Shintani DK,Cheng Z,DellaPenna D.The role of 2-methyl-6-phytylbenzoquinone methyltransferase in determining tocopherol composition in Synechocystis sp.PCC6803[J].FEBS,2002,511:1-5
[10]Van Eenennaam A L,Lincoln K,Durrett T P,et al.Enginerring vitamin E content:From Arabidopsis mutant to soy oil[J].The Plant Cell,2003,15:3007-3019
[11]徐妙云,周 建,张 兰,等.大豆2-甲基-6-植基-1,4-苯醌甲基转移酶基因(Gm VTE3)的克隆及对转基因烟草种子中生育酚组成的影响[J].中国农业科学,2010,43(10):1994-1999
[12]孙 翠,李永涛,王明林,等.核桃(Juglans)仁维生素E 含量分析研究[J].中国粮油学报,2011,26(6):45-51
