短链氯化石蜡急性暴露对SD雄性大鼠的组织病理学影响
2013-10-22刘钰晨陈敏杰
李 勋,刘钰晨,陈敏杰,李 佳,梁 勇,3*
(1.江汉大学 化学与环境工程学院,湖北 武汉 430056; 2.江汉大学 医学院,湖北 武汉 430056;3.江汉大学 光电化学材料与器件省部共建教育部重点实验室,湖北 武汉 430056)
正构烷烃氯化衍生物氯化石蜡(Chlorinated paraffins,CPs)从1930年开始生产。由于其具有的稳定性强、黏性高、耐火性好和低蒸气压的特点,被广泛地应用于金属切割添加剂和润滑剂、油漆和密封剂的塑化剂、胶黏剂配方、塑料增塑剂和阻燃剂等中。目前我国已成为世界第一大CPs生产国,从2004年100千t/年到2007年600千t/年[1]。在中国CPs生产量和使用量逐年增加,在其使用过程中CPs可通过各种途径挥发、扩散、迁移到大气、水体、土壤和生物体内,造成环境污染。
由于正构烷烃的碳链上有许多氯原子可能取代的位点,氯化比例也不固定,正构烷烃在氯化过程中会产生无数种同系物、异构体、对映及非对映异构体[2]。按碳链长度不同可以分为短链氯化石蜡(碳链长度为10~13,SCCPs)、中链氯化石蜡(碳链长度为14~17,MCCPs)和长链氯化石蜡(碳链长度为 18~30,LCCPs)[3]。
CPs化学性质相对稳定、不易降解,对哺乳动物具有较低的急性毒性[4]。但是,CPs慢性暴露可以使大鼠和小鼠致癌风险增大[5]。MCCPs(平均含氯量为52%)亚急性暴露大鼠后,其肝脏重量增加[4,6-7],肝细胞滑面内质网扩张[4],肝微粒体细胞色素P450含量和混合功能氧化酶活性发生改变[6-7],甲状腺素浓度降低[8],并且 UDP-葡萄糖醛酸转移酶(UDPGT)的生成被诱导[9]。Poon等[10]用MCCPs对SD大鼠暴露13周后,肝重增加,肝细胞核大小不均一、核中出现空泡,肝细胞质不均一。就肝脏病变的程度而言,MCCPs产生的病变程度比LCCPs低。LCCPs可造成肝脏肉芽肿性炎症及肝细胞坏死[4,11]。另外,Cooley等[12]用6种CPs分别对虹鳟幼鱼暴露21 d后,发现其肝脏的组织结构均发生了明显病理变化,其中C10H15.3Cl6.7和C11H18.4Cl5.6对肝脏的损伤最为严重,出现了大面积组织纤维化病变。CPs对肝脏造成的损伤程度可能与其碳链长度和含氯量有关[5,11],其具体作用机制有待进一步研究。
CPs成分复杂,其中的SCCPs在近年来引起了世界环境保护工作者和世界卫生组织的特别关注。在2006年《关于持久性有机污染物的斯德哥尔摩公约》将CPs混合物中的重要成分SCCPs写入新增候选化学品,作为该公约增列持久性有机污染物(Persistent organic pollutants,POPs)中的一类化合物,联合国环境规划署POPs审查委员会在2008年对关于SCCPs的危害评估进行了审核。因此有必要对这种化合物进行进一步研究,以揭示这类化学品的环境健康影响。
在英国,1997年空气中SCCPs含量为5.4~1085 pg/m3(平均浓度为 320±320 pg/m3)[13],而2003年空气中SCCPs含量为<185~3430 pg/m3(平均浓度:1130 pg/m3)[14]。在加拿大圣劳伦斯河水、英格兰河水与威尔士河水、日本河水中SCCPs含量分别为15.74~59.57 ng/L、<0.1~1.7 μg/L、7.6~220 ng/L[15-18]。在安大略湖沉积物中农药DDT的平均浓度低于SCCPs[19]。这表明,SCCPs是类似于传统的持久性有机污染物。在1987年至1991年,白鲸体内SCCPs含量范围为6.62~85.6 μg/g脂重(lipid weight,lw),其中肝脏中为 0.544~38.5 μg/g ww[20]。在挪威,贻贝中SCCPs含量介于14~130 ng/g ww,苔藓样品中检测到了SCCPs(3~100 ng/g ww),揭示了SCCPs潜在的大气环境迁移行为[21]。
SCCPs的毒性效应正受到国际上的密切关注。但在国内还没有对SCCPs毒性做系统性研究。笔者选择了SCCPs含量不同的两种商品化CPs(CPsⅠ和CPsⅡ)作为模式化合物,比较研究它们对SD大鼠的毒性效应,借以初步评估SCCPs的毒性大小。
1 材料与方法
1.1 试剂
两种商品化CPs(CPsⅠ和CPsⅡ),由中国科学院生态环境研究中心提供,二者的SCCPs含量分别为38.22%和0.08%,含氯量分别为52%和42%,纯度≥95%。CPsⅠ以浓度1、5和10 mg/mL溶于玉米油中,CPsⅡ以浓度10 mg/mL溶于玉米油中,避光4℃保存。实验中所用的化学试剂均为分析纯。
1.2 实验材料和暴露方法
4周龄清洁级SD大鼠,购自华中科技大学同济医学院,体重160~180 g,雄性。饲养于江汉大学实验动物中心动物房(温度:(20±2)℃,湿度:40%~60%,昼夜循环12 h/12 h)。经适应性饲养一周,确认正常后纳入实验。按体重随机分为5组,每组4只,即对照组(玉米油)、10 mg/kg·d(CPsⅠ)、50 mg/kg·d(CPsⅠ)、100 mg/kg·d(CPsⅠ)和100 mg/kg·d(CPsⅡ)。每天定时灌胃1次,按照10 mL/kg体重的标准计算灌胃量,连续染毒14 d。
1.3 组织病理学观察
对照组和暴露组大鼠在染毒14 d后,以颈椎错位法处死,解剖后取出肝脏、肾脏、肺脏和心脏,用生理盐水清洗干净,侵入10倍体积的10%甲醛溶液中固定,常规石蜡包埋,做5 μm薄片,HE染色。在光学镜显微镜下观察。
2 结果
2.1 CPs对大鼠体重及摄食量的影响
实验期间,各组动物活动正常,生长发育良好,未出现明显不良反应和中毒症状,暴露组大鼠的重量、总进食量和食物利用率(大鼠每摄入100 g饲料所增加的体质量克数)与对照组相比均无显著性差异(表1~3)。
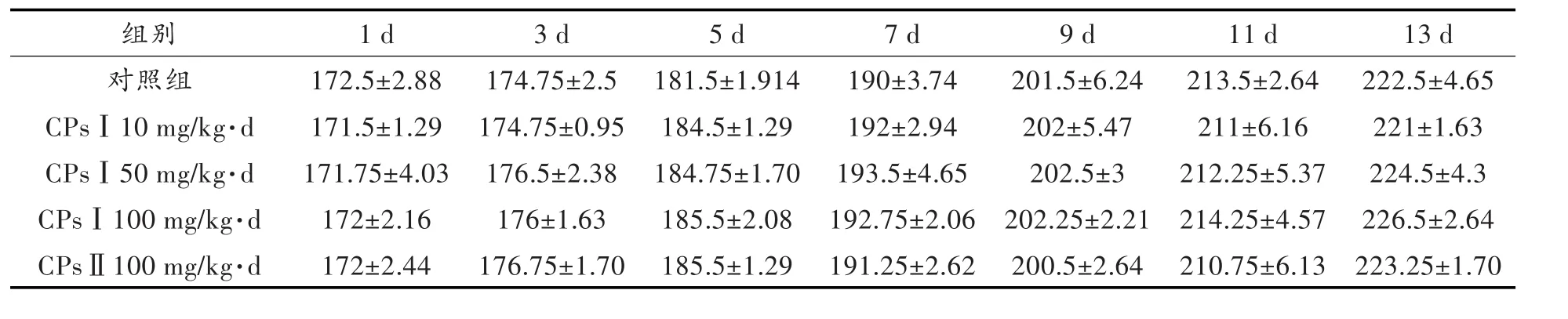
表1 CPs对大鼠体重的影响 /g

表2 CPs对大鼠摄食量的影响 /g
2.2 CPsⅠ和CPsⅡ染毒大鼠组织脏器病理观察
图1为CPs暴露14 d后大鼠肝脏病理切片。实验结果表明,CPsⅠ和CPsⅡ暴露后均引起大鼠肝损伤。随着CPsⅠ浓度的增加,肝损伤现象越明显。与对照组相比,10 mg/kg·d的CPsⅠ暴露组大鼠肝脏中出现肝细胞肿胀的现象(图未显示);50 mg/kg·d的CPsⅠ暴露组的肝脏出现少量肝细胞水样变性、胞质疏散(图1B);100 mg/kg·d的CPsⅠ暴露组肝脏出现大量肝细胞水样变性、胞质疏散(图1C)。而100 mg/kg·d的CPsⅡ暴露组肝脏也出现了肝细胞水样变性、胞质疏散(图1D)。
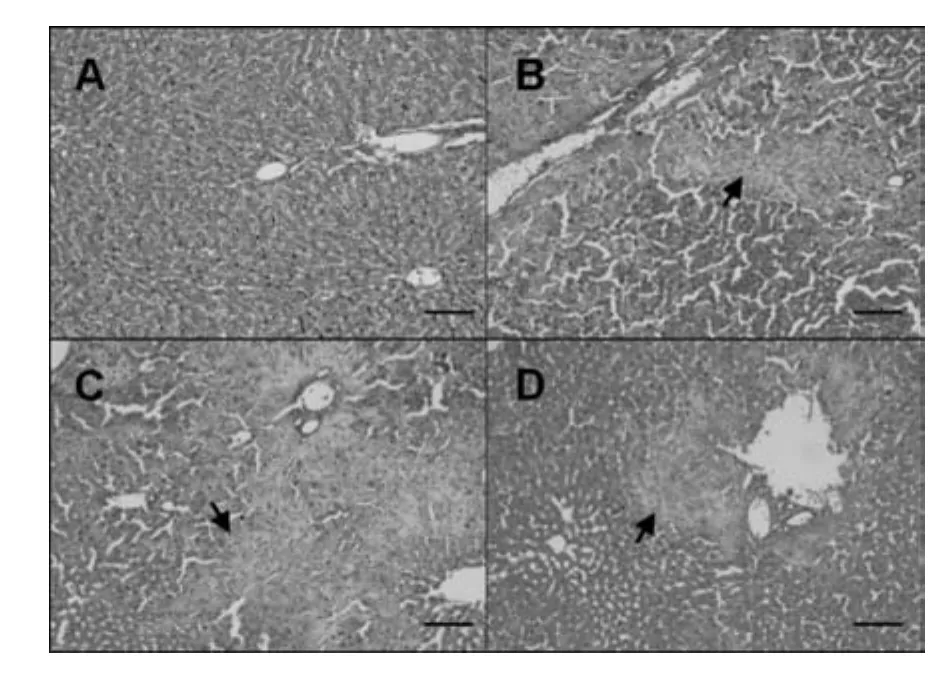
图1 CPs暴露14 d后雄性SD大鼠肝脏病理切片实验结果,HE×200
图2为CPs暴露14 d后大鼠肾脏病理切片。结果显示,与对照组相比,10 mg/kg·d的CPsⅠ暴露组肾脏无明显变化,肾小球分布正常,各级肾小管正常(图未显示);50 mg/kg·d的CPsⅠ暴露组肾脏中肾小管肿胀,肾小球分布正常;100 mg/kg·d的CPsⅠ暴露组肾脏中肾小管肿胀,肾小球萎缩。同时,100 mg/kg·d的CPsⅡ暴露组亦出现肾小球玻璃样变现象。
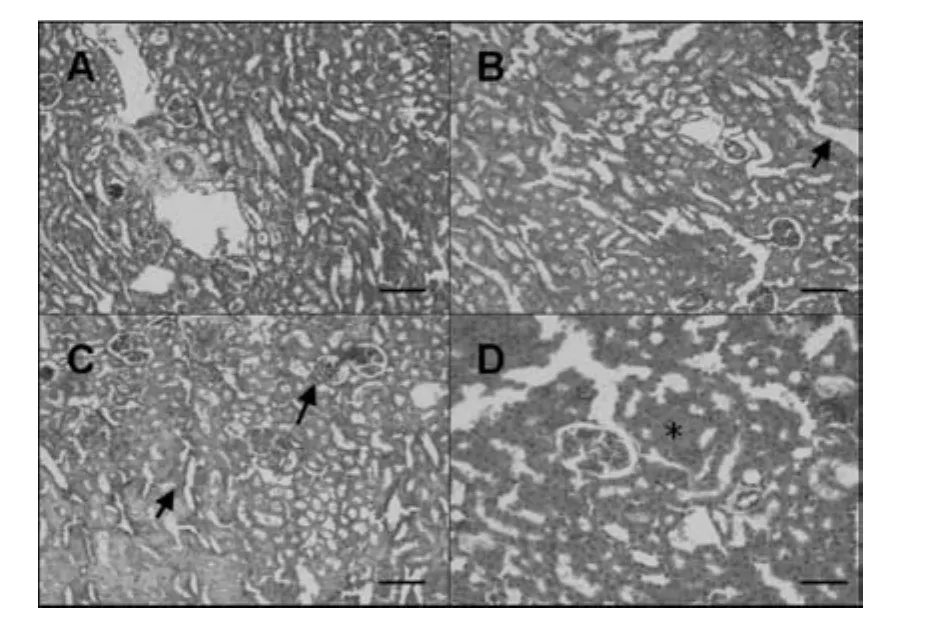
图2 CPs暴露14 d后SD大鼠(雄)肾脏病理切片实验结果,HE×200
从病理切片可见,CPsⅠ和CPsⅡ暴露14 d后对雄性SD大鼠肺脏造成明显损伤。实验结果显示,与对照组相比,100 mg/kg·d的CPsⅠ暴露组肺脏组织中出现炎症细胞浸润(图3B),100 mg/kg·d的CPsⅡ暴露组肺脏组织中出现肺泡隔增厚,炎症细胞浸润(图3C)。
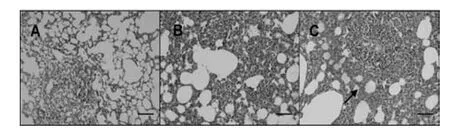
图3 CPs暴露14 d后SD大鼠(雄)肺病理切片实验结果,HE×200
由图4可知,与对照组相比,各暴露组SD大鼠心脏组织结构正常,未见明显的病理损伤。
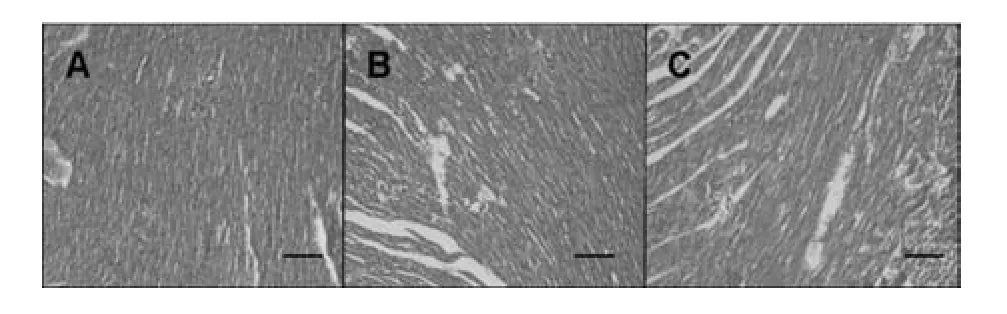
图4 CPs暴露14 d后SD大鼠(雄)心脏切片,HE×200
3 讨论
CPs对生物体潜在危害的研究已开展多年。但是,在中国还没有关于SCCPs对啮齿动物毒性的研究。本文以两种SCCPs含量不同的商品化CPs(CPsⅠ和CPsⅡ)对大鼠急性毒性暴露后,观察到两种CPs对大鼠均有一定毒性,主要表现为对大鼠肝脏、肾脏、肺部造成明显损伤,且病变程度与暴露剂量有明显的剂量效应关系。这与CPs对哺乳动物器官影响的研究具有相同结果[4,7]。
肝脏是动物体内的主要解毒器官,也是污染物蓄积和产生毒害作用的主要靶器官之一。当大鼠受到有毒物质暴露后,氧化胁迫作用可使肝脏组织的抗氧化系统作出反应,从而诱导或抑制肝脏代谢酶和多功能酶(如GST、过氧化氢酶、肝脏Ⅰ相代谢酶等)活性,并且可以增加体内过氧化物酶体数量,也可能导致代谢产物在肝细胞内积累;同时污染物对肝脏的毒害作用可能影响其糖原的代谢或减弱脂肪转化为磷脂的能力,导致脂肪在肝脏内积累。本文中两种CPs(CPsⅠ和CPsⅡ)中SCCPs含量分别为38.22%和0.08%,二者的含氯量分别为52%和42%。它们对大鼠暴露后,肝脏中肝细胞发生肿大及水样变性。实验结果显示,随着CPsⅠ暴露剂量的增加,肝损伤现象越来越明显,表现出明显的剂量效应关系。但高剂量的CPsⅠ和CPsⅡ之间的毒性没有明显差异。Nilsen等[7]用5种碳链长度和氯含量均不同的CPs暴露雄性SD大鼠7 d后,CP-149(C10-13,含氯量为49%)、CP-159(C10-13,含氯量为59%)及CP-171(C10-13,含氯量为71%)使大鼠肝脏中肝细胞肿大、过氧化物酶体增多和体积变大及滑面内质网扩增,并且没有观察到肝细胞坏死现象。CP-350(C14-17,含氯量为 50%)和 CP-549(C18-26,含氯量为49%)使肝脏产生的病理改变不及3种SCCPs改变程度深,由此认为肝脏的病变严重程度与碳链长度成反比,与含氯量成正比。该结果未能得到本实验的证实。Bucher等人用CPs(碳原子在10~13之间,平均含氯量为60%)对大鼠暴露两年后,出现了肝脏不同程度坏死[11],而本实验中CPsⅠ和CPsⅡ暴露14 d后,并没有出现肝细胞坏死现象,可能与暴露时间过短有关。
肾脏是动物体内的主要排泄器官,机体在新陈代谢过程中产生多种废物,绝大部分废物通过肾小球血滤过、肾小管的分泌,随尿液排出体外。Poon等[10]用 MCCPs对SD大鼠暴露13周后,在5000 ppm实验组中雄鼠肾脏指数增加、尿N-乙酰-β-D-氨基葡萄糖苷酶升高,并且肾小管上皮细胞细胞质中内涵体增加,透明滴聚集,导致肾小管肿胀、玻璃样变。本实验用商品化CPs暴露SD大鼠14 d后,100 mg/kg·d CPsⅠ暴露组肾脏中肾小管肿胀,肾小球萎缩;100 mg/kg·d CPsⅡ暴露组肾脏中肾小球玻璃样变。这与前人的实验结果相一致。Swenberg等[22]发现饱和的支链烷烃可以使透明滴在雄鼠肾小管中聚集。而CPs是通过饱和的支链烷烃加氯生成的,反应不完全,残存少量饱和支链烷烃于混合物中,所以CPs对肾脏毒性可能是由于CPs中含有的少量饱和支链烷烃造成的。
本文通过对SD大鼠各个脏器的病理学观察,初步比较研究了两种SCCPs含量差别很大的商品化CPs产品的生物学效应。发现SCCPs含量差别很大的两种CPs产品都可以造成SD雄性大鼠的肝脏、肾脏和肺脏出现明显病变,而且病变程度与暴露剂量有明显的剂量效应关系,但并不和SCCPs的含量成正比。CPs产生的毒性效应,一般都认为和烷烃的长度、含氯量、未氯化的烷烃、以及SCCPs含量相关,我们的初步结果表明,CPs的致毒机制,还需进一步深入研究,并不能仅仅简单归纳是SCCPs所造成的。
[1]Fiedler H.Chlorinated Paraffins[M].Berlin:Springer,2010:1-40.
[2]袁博,王亚韡,傅建捷,等.氯化石蜡分析方法的研究及土壤样品中氯化石蜡的测定[J].科学通报,2010(19):1879-1885.
[3]Pellizzato F,Ricci M,Held A,et al.Analysis of short-chain chlorinated paraffins:a discussion paper[J].Journal of Environmental Monitoring,2007,9(9):924-930.
[4]Birtley R D N,Conning D M,Daniel J W,et al.The toxicological effects of chlorinated paraffins in mammals[J].Toxicology and Applied Pharmacology,1980,54(3):514-525.
[5]Serrone D M,Birtley R D N,Weigand W,et al.Toxi⁃cology of chlorinated paraffins[J].Food and Chemical Toxicology,1987,25(7):553-562.
[6]Nilsen O G,Toftgård R.Effects of polychlorinated ter⁃phenyls and paraffins on rat liver microsomal cyto⁃chrome P-450 and in vitro metabolic activities[J].Ar⁃chives of Toxicology,1981,47(1):1-11.
[7]Nilsen O G,Toftgård R,Glaumann H,et al.Effects of chlorinated paraffins on rat liver microsomal activities and morphology[J].Archives of Toxicology,1981,49(1):1-13.
[8]Wyatt I,Coutss C T,Elcombe C R,et al.The effect of chlorinated paraffins on hepatic enzymes and thyroid hormones[J].Toxicology,1993,77(1/2):81-90.
[9]Burý šková B,Bláha L,Vršková D,et al.Sublethal tox⁃ic effects and induction of glutathione S-transferase by short chain chlorinated paraffins(SCCPs)and C-12 al⁃kane(dodecane)in Xenopus laevis frog embryos[J].Acta Vet Brno,2006,75:115-122.
[10]Poon R,Lecavalier P,Chan P,et al.Subchronic toxici⁃ty of a medium-chain chlorinated paraffin in the rat[J].Journal of Applied Toxicology,1995,15(6):455-463.
[11]Bucher J R,Alison R H,Montgomery C A,et al.Com⁃parative toxicity and carcinogenicity of two chlorinated paraffins in F344N rats and B6C3F1 mice[J].Funda⁃mental and Applied Toxicology,1987,9(3):454-468.
[12]Cooley H M,Fisk A T,Wiens S C,et al.Examination of the behavior and liver and thyroid histology of juve⁃nile rainbow trout(Oncorhynchus mykiss) exposed to high dietary concentrations of C10-,C11-,C12-and C14-polychlorinated n-alkanes[J].Aquatic Toxicolo⁃gy,2001,54(1-2):81-99.
[13]Peters J A,Tomy G T,Jones K C,et al.Occurrence of C10-C13 polychlorinated n-alkanes in the atmosphere of the United Kingdom[J].Atmospheric Environment,2000,34(19):3085-3090.
[14]Barber J L,Sweetman A J,Thomas G O,et al.Spatial and temporalvariability in air concentrations of short-chain(C10-C13)and medium-chain(C14-C17)chlorinated n-alkanes measured in the U.K.atmosphere[J].Environmental Science&Technology,2005,39(12):4407-4415.
[15]Muir D B E,Tomy G,Whittle M.Medium chain chlori⁃nated paraffins in great lakes food webs[J].Organohalo⁃gen compounds,2003,64:166-169.
[16]Nicholls C R,Allchin C R,Law R J.Levels of short and medium chain length polychlorinated n-alkanes in environmental samples from selected industrial areas in England and Wales[J].EnvironmentalPollution,2001,114:415-430.
[17]Iino F,Takasuga T,Senthilkumar K,et al.Risk as⁃sessment of short-chain chlorinated paraffins in Japan based on the first market basket study and species sensi⁃tivity distributions[J].Environmental Science&Tech⁃nology,2005,39:859-866.
[18]Takasuga T,Hayashi A,Yamashita M,et al.Prelimi⁃nary study of polychlorinated n-alkanes in standard mixtures,river water samples from Japan by HRGC-HRMS with negative ion chemical ionization[J].Organohalogen Compd,2003,60:424-427.
[19]Marvin C H,Painter S,Tomy G T,et al.Spatial and temporal trends in short-chain chlorinated paraffins in Lake Ontario sediments[J].Environmental Science&Technology,2003,37:4561-4568.
[20]Bennie D,Sullivan C,Maguire R J,et al.Occurrence of chlorinated paraffins in beluga whales(Delphiapter⁃us leucas)from the St.Lawrence River and rainbow trout(Oncorhynchus mykiss)and carp(Cyprinus car⁃pio) from Lake Ontario[J].Water Quality Research Journal of Canada,2000,35(2):263-281.
[21]Borgen A R,Schlabach M,Mariussen E.Screening of chlorinated paraffins in Norway[J].Organohalogen Compd,2003,60:331-334.
[22]Swenberg J A,Short B,Borghoff S,et al.The compara⁃tive pathobiology of α2u-globulin nephropathy[J].Tox⁃icology and Applied Pharmacology,1989,97(1):35-46.
