Beclinl基因沉默对胰腺癌MiaPaCa-2细胞生长的影响
2013-10-19李晓姝郭晓钟王华肖凤君李宏宇任丽楠
李晓姝 郭晓钟 王华 肖凤君 李宏宇 任丽楠
·短篇论著·
Beclinl基因沉默对胰腺癌MiaPaCa-2细胞生长的影响
李晓姝 郭晓钟 王华 肖凤君 李宏宇 任丽楠
Beclin1基因与酵母自噬基因Atg 6同源,是参与哺乳动物自噬体形成,调控细胞自噬过程的重要基因。Beclin1自噬基因的缺陷可能导致肿瘤细胞逃避自噬性死亡[1],而稳定转染Beclin1后可促进细胞的自噬活性,并降低了其成瘤能力[2]。本研究观察沉默胰腺癌MiaPaCa-2细胞的Beclin1基因表达后对其增殖、凋亡及细胞周期分布的影响,为胰腺癌的基因治疗提供新的思路。
一、材料与方法
1.靶向Beclin1的siRNA表达载体构建:根据siRNA设计原理,由上海吉玛制药技术有限公司构建3个插入靶向Beclin1基因的siRNA(Beclin1-siRNA)质粒以及阴性对照siRNA(NC-siRNA)质粒和荧光标记的siRNA(FAM-siRNA)质粒。经筛选后选择沉默效果最好的Beclin1-siRNA序列插入表达载体U6/Neo,构建表达载体U6/Neo-shBeclin1,同时构建阴性对照载体pGPU6/Neo-shNC及荧光对照载体pGPU6/GFP/Neo-shNC。
2.细胞转染及稳转细胞株筛选:人胰腺癌细胞系MiaPaCa-2由军事医学科学院提供,常规培养、传代。取对数生长期细胞,接种于24孔培养板,采用Lipofectamin 2000转染试剂盒(Invitrogen 公司)将上述3种表达载体分别转染MiaPaCa-2细胞,按说明书操作。转染后6、24 h在荧光显微镜下观察转染效率。取转染效率高的细胞的1/10进行传代,48 h后在培养液中加入G418(400 μg/ml)筛选稳转细胞株。18 d后收集细胞。
3.Beclin1蛋白表达检测:取对数生长期细胞,提取蛋白,采用常规蛋白质印迹法检测Beclin1蛋白,以β-actin为内参。兔抗人Beclin1单抗为Reagents 公司产品,兔抗人β-actin抗体及羊抗兔IgG多抗为Santa Cruz公司产品。
4.细胞增殖活性检测:采用CCK法检测。试剂盒为日本Dojindo Laboratories产品,按照试剂盒说明书操作。最后在酶联免疫检测仪于450 nm处测定细胞培养0、24、48、72、96 h的吸光值(A450值),以对照组为1,绘制增殖曲线。实验重复3次。
5.细胞凋亡及周期分析:取培养48 h的细胞,离心弃上清,应用1 ml预冷PBS洗涤3次,采用PI染色法检测细胞凋亡,采用ANNEXIN V-FITC N+PI法检测细胞周期。检测试剂盒购自北京众康志恒生物公司,按照试剂盒说明书操作,最后上流式细胞仪检测。

二、 结果
1.转染细胞Beclin1蛋白表达的变化:转染NC-siRNA的MiaPaCa-2细胞的Beclin1蛋白表达量为0.7046,转染3条靶向Beclin1-siRNA的MiaPaCa-2细胞Beclin1蛋白表达量分别为0.4077、0.2831、0.1073(图1),Beclin1蛋白的表达均下调,其中Beclin1-siRNA-3具有最佳的抑制效果,该靶序列为GCTGCCGTTATACTGTTCT。故应用该序列进行后续实验。
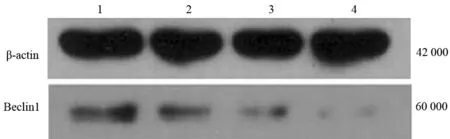
1:NC-siRNA;2:Beclin1-siRNA1;3:Beclin1-siRNA2;4:Beclin1-siRNA3
2.Beclin1-siRNA稳转MiaPaCa-2细胞增殖、凋亡及周期的变化:稳转的MiaPaCa-2细胞与阴性对照组相比较,其细胞增殖、凋亡无明显变化(图2、3),但对MiaPaCa-2细胞的周期分布产生明显影响(图4), S期细胞比例从对照组的(10.93±0.19)%减少到(9.20±0.22) %,G2期细胞比例从对照组的(7.92±2.56) %减少到(7.00±2.82)%,而G1期细胞从对照组(81.15±2.75)%增加到(83.80±2.60)%,差异均具有统计学意义(t值分别为7.308、6.129、30.6,P值均<0.01)。
讨论RNA干扰(RNA interference,RNAi) 是近些年发展起来的一种新技术,它主要是通过21~25 nt的小RNA反义链的介导,识别并靶向切割同源mRNA,从而发生转录后沉默。目前人工合成的siRNA已成为研究基因沉默后功能改变的一种重要工具,被广泛应用于肿瘤发生、发展相关的研究中。本研究采用该技术成功地获得Beclin1低表达的稳转MiaPaCa-2细胞株。
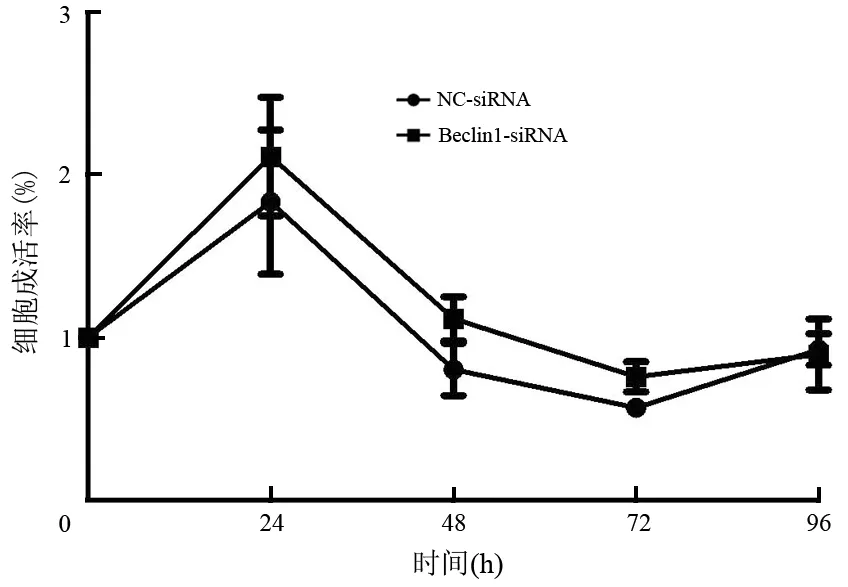
图2 转染Beclin1-siRNA及NC-siRNA的MiaPaCa-2细胞的增殖曲线
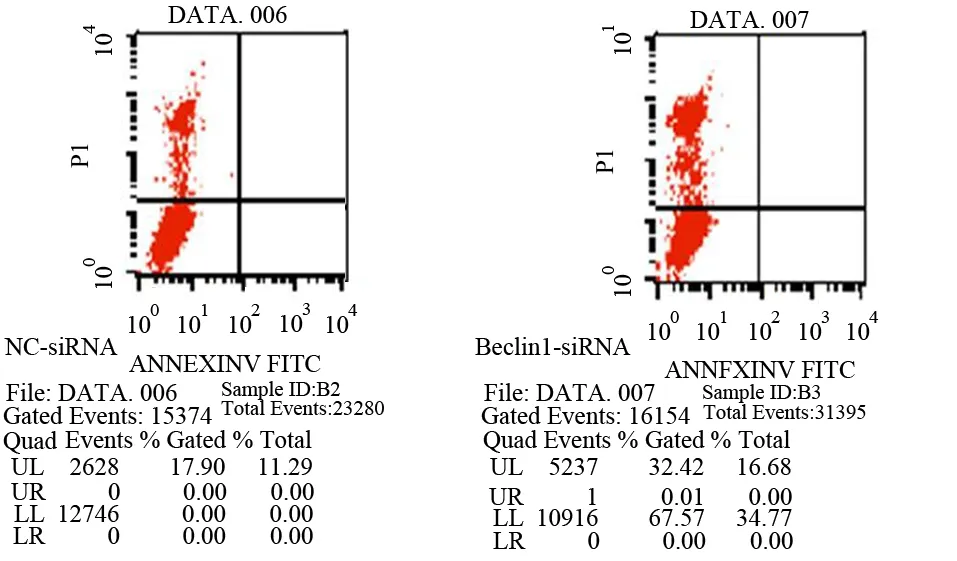
图3 转染Beclin1-siRNA及NC-siRNA的MiaPaCa-2细胞的凋亡
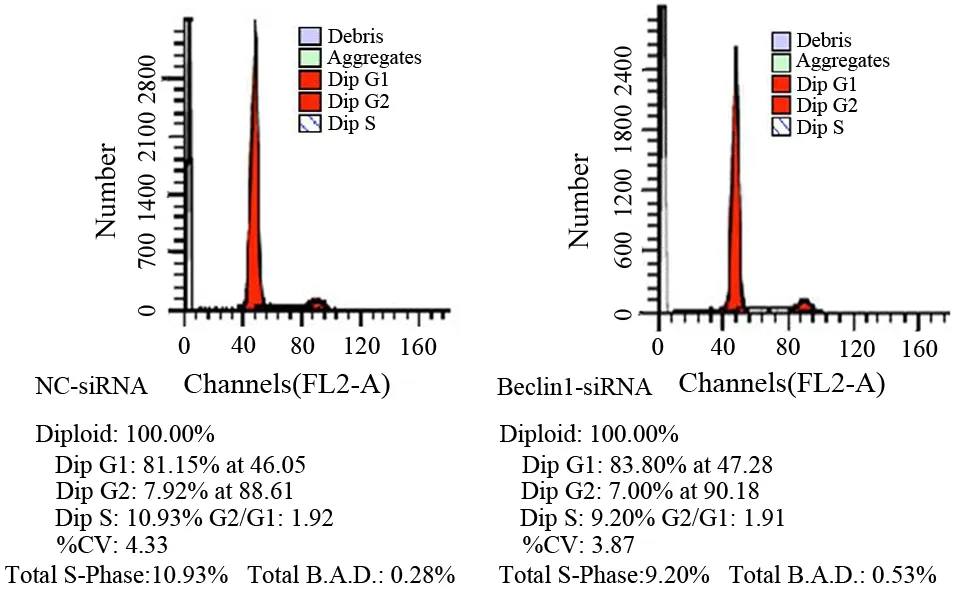
图4 转染Beclin1-siRNA及NC-siRNA的MiaPaCa-2细胞的周期分布
自噬是真核细胞特有的生命现象。通过自噬,细胞内受损变性或衰老的蛋白质、细胞器被消化降解,同时也可以再利用被分解的氨基酸、核苷酸、游离脂肪酸等以满足机体代谢需要或某些细胞器的更新,因此对于维持细胞内环境稳定起着非常重要的作用。目前在哺乳动物中发现有近30种自噬相关基因,它们通过多种信号通路调控细胞自噬的水平。其中Beclin1基因是一种重要的自噬调控基因,它所编码的Beclin1蛋白能够引导其他自噬相关蛋白定位于自噬体膜上,在自噬体的形成过程中起到关键的作用。
目前研究提示Beclin1可能参与细胞凋亡,但其作用机
制非常复杂,自噬启动或是抑制凋亡仍无一致结论。有研究结果显示,Beclin1可以通过BH3结构域与细胞凋亡的重要调节因子Bcl-2相互作用[3-4],这可能是Beclin1参与细胞凋亡的机制之一。推测磷酸化及非磷酸化的Bcl-2与Beclin1结合,可能对自噬或凋亡产生相反的作用,这与细胞的不同状态有关[5]。另一方面,有研究显示,人乳腺癌、卵巢癌和前列腺癌等肿瘤细胞中存在高频率的Beclin1单等位基因缺失[1]。人乳腺癌细胞系MCF-7稳定转染Beclin1后其自噬活性增强,同时降低其成瘤能力,提示自噬活性与抑制细胞增殖有关[2]。
本研究结果显示,沉默Belin1基因表达后,细胞的凋亡及增殖均未受到影响,是否存在其他重要的信号通路调控自噬过程需要进一步通过对自噬小体数量变化等检测去验证。
本研究结果还显示,Beclin1表达沉默后,MiaPaCa-2细胞的周期发生改变,S期细胞明显减少,G1期细胞明显增多,提示Beclin1低表达促使胰腺癌MiaPaCa-2从S期进入G1期,推测Beclin1在促进肿瘤形成过程中可能起作用。有研究认为,在肿瘤的不同发展阶段,自噬对细胞的影响不同。在肿瘤发生早期,抑制自噬可以引起癌前细胞持续生长,此时自噬抑制肿瘤形成[6-7]。当肿瘤处于进展阶段时,恶变的细胞持续分裂增殖,并利用自噬机制对抗营养缺乏和缺氧,尤其在实体肿瘤内部血供不良的癌细胞中表现更明显,此时自噬发挥的是促进肿瘤细胞生长的作用[8]。本研究与有些研究结论[1-2]不一致,其原因也可能与Beclin1异常表达在不同肿瘤组织及肿瘤发生、发展的不同阶段产生的自噬作用不同有关。
[1] Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion. Nature, 2008, 451:1069-1075.
[2] Liang XH, Jackson S, Seaman M, et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1. Nature, 1999, 402: 672-676.
[3] Strasser A. The role of BH3-only proteins in the immune system.Nat Rev Immunol, 2005, 5: 189-200.
[4] Sinha S, Levine B. The autophagy effector Beclin 1: a novel BH3-only protein. Oncogene, 2008, 27: S137-S148.
[5] Wei Y, Pattingre S, Sinha S, et al. JNK1-mediated phosphorylation of Bcl-2 regulates starvation-induced autophagy. Mol Cell, 2008, 30:678-688.
[6] Ogier-Denis E, Codogno P. Autophagy: a barrier or an adaptive response to cancer. Biochim Biophys Acta, 2003, 1603: 113-128.
[7] Gozuacik D, Kimchi A. Autophagy as a cell death and tumor suppressor mechanism. Oncogene, 2004, 23: 2891-2906.
[8] Cuervo AM. Autophagy: in sickness and in health. Trends Cell Biol, 2004, 14: 70-77.
2013-03-20)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2013.06.019
国家自然科学基金(81071982);辽宁省自然科学基金(201102238)
110083 沈阳,沈阳军区总医院消化科(郭晓钟、李宏宇、任丽楠);沈阳市第四人民医院消化科(李晓姝);军事医学科学院放射与辐射研究所(王华、肖凤君)
郭晓钟,Email: guoxiaozhong1962@163.com
