大黄甘草汤对高原急性坏死性胰腺炎合并肠损伤大鼠的影响
2013-10-19张方信李文祥邓芝云张盼陈嘉屿邓尚新王秀锋贾红梅苟艳子
张方信 李文祥 邓芝云 张盼 陈嘉屿 邓尚新 王秀锋 贾红梅 苟艳子
·论著·
大黄甘草汤对高原急性坏死性胰腺炎合并肠损伤大鼠的影响
张方信 李文祥 邓芝云 张盼 陈嘉屿 邓尚新 王秀锋 贾红梅 苟艳子
目的观察大黄甘草汤对高原急性坏死性胰腺炎(P-ANP)并发肠损伤大鼠的治疗效果。方法54只Wistar大鼠,由兰州市运至马衔山(海拔3848米)适应性喂养1个月。按完全随机法分为假手术组、P-ANP组、大黄甘草汤组,每组18只。采用逆行胰胆管注射4%牛磺胆酸钠方法制备P-ANP模型。大黄甘草汤组于造模前2 h、造模后每12 h给予大黄甘草汤0.6 ml/100 g体质量灌胃,假手术组和P-ANP组给予等容积生理盐水灌胃。术后6、12、24 h分批处死大鼠,取胰腺及小肠组织行组织病理学检查并评分,透射电镜观察肠黏膜超微结构变化。采用ELISA法检测小肠组织IL-10、TNF-α表达水平。结果造模后12 h,假手术组、P-ANP组、大黄甘草汤组的胰腺病理评分为(0.33±0.52)、(8.33±0.52)、(6.17±2.13)分;肠组织病理评分为(0.17±0.41)、(3.83±1.17)、(2.17±1.17)分。P-ANP组和大黄甘草汤组胰腺、小肠病理评分均显著高于假手术组(P值均<0.01),大黄甘草汤组又均显著低于同时间点的P-ANP组(P值均<0.05),且大黄甘草汤组肠组织和胰腺组织病理学损伤呈正相关(r=0.796,P<0.01)。P-ANP组大鼠肠黏膜超微结构损伤严重,而大黄甘草汤组较P-ANP组损伤明显减轻。造模后12 h,假手术组、P-ANP组、大黄甘草汤组小肠组织IL-10水平分别为(136.68±13.98)、(762.21±79.58)、(896.36±84.87)pg/g,TNF-α水平分别为(353.05±76.21)、(1913.87±259.33)、(1481.58±231.47)pg/g,P-ANP组和大黄甘草汤组IL-10、TNF-α水平均较假手术组显著增高,大黄甘草汤组IL-10水平又较P-ANP组显著增高(P<0.05),但TNF-α水平则较P-ANP组显著降低(P<0.05)。结论大黄甘草汤可迅速改善P-ANP大鼠并发的肠损伤。
胰腺炎,急性坏死性; 缺氧; 肠黏膜; 通透性; 大黄甘草汤
重症急性胰腺炎(SAP)是临床上常见的急腹症。高原地区特殊的自然环境和饮食习惯等因素导致的高原性SAP(plateau severe acute pancreatitis,P-SAP)更具有易发生、难治疗、易合并多种器官损伤等特征。大量研究证实,SAP时常存在肠黏膜屏障损伤[1],肠黏膜的通透性增加,引起肠道细菌及内毒素易位,导致胰腺组织继发感染,继而发生全身炎症反应综合征或多器官功能障碍综合征[2],这是SAP病死率居高不下的主要原因。大黄与甘草配伍的经典方剂大黄甘草汤出自《金匮要略》,苦寒与甘平相结合,能清、能下、能通,解毒而不伤正。本研究观察大黄甘草汤对天然高原环境下急性坏死性胰腺炎(ANP)合并肠损伤大鼠的影响,为临床治疗提供必要的理论及实验依据。
材料与方法
一、动物分组与高原缺氧ANP模型的建立
54只Wistar大鼠,购于兰州军区兰州总医院实验动物中心,清洁级,雌雄各半,体质量220~280 g。用汽车运至兰州马衔山(海拔3848 m)适应性喂养1个月,按完全随机法分为假手术组、P-ANP组和大黄甘草汤组,每组18只。采用逆行胰胆管缓慢注入4%牛磺胆酸钠(Sigma公司)0.1 ml/100 g体质量的方法制备ANP模型。假手术组仅开腹后轻翻胰腺组织。大黄甘草汤组于造模前2 h及造模后1次/12 h给予大黄甘草汤0.6 ml/100 g体质量灌胃。大黄甘草汤方剂:大黄12 g,甘草3 g,由兰州总医院药剂科提供,最终浓度为0.25 g/ml。假手术组及P-ANP组大鼠在相应时间点给予等量生理盐水灌胃。各组大鼠术后均于背部皮下注入生理盐水2 ml/100 g体质量以补充术中丢失的体液[3]。术后6、12、24 h分批处死大鼠。
二、胰腺及小肠组织病理学检查
处死大鼠后迅速取部分胰尾部组织及距回盲部5 cm处取5 cm肠组织置10%中性甲醛中固定,常规病理检查,并采用改良的Schmidt评分[4]及Chiu′s六级评分[5]分别对胰腺及小肠组织进行评分。
三、小肠组织超微结构检查
处死大鼠后迅速取上端空肠2 cm长的组织置入3%戊二醛中固定,依次脱水、包埋、超薄切片及醋酸铀、枸橼酸铅双染色,在透射电镜下观察肠黏膜组织超微结构的变化。
四、小肠组织IL-10、TNF-α表达水平检测
称取0.1 g保存于液氮中的小肠组织,加入0.9 ml预冷的PBS液,制备组织匀浆,离心取上清液,-20℃保存。采用ELISA试剂盒(R&D公司)检测小肠组织的IL-10、TNF-α表达水平。
五、统计学处理
结 果
一、胰腺及小肠组织病理变化
肉眼观假手术组大鼠胰腺大小、形态、色泽均正常,无腹腔积液。P-ANP组大鼠胰腺出现片状或全胰坏死,质硬,与周围组织广泛粘连;肠系膜可见广泛的点状皂化斑,大量血性腹水。大黄甘草汤组胰腺坏死面积较小,坏死程度较轻,有的只见胰腺充血,未见坏死,与周围组织粘连不广泛;肠系膜皂化斑较少,腹水不明显。
光镜下见假手术组大鼠胰腺结构基本正常(图1a);P-ANP组大鼠胰腺弥漫性出血及片状坏死,周围间质水肿,血管扩张、充血,间质和胰腺小叶大量炎症细胞浸润(图1b);大黄甘草汤组大鼠胰腺腺泡细胞变性,腺小叶结构轻度破坏,少量炎症细胞浸润,间质水肿,但充血不明显(图1c)。假手术组大鼠肠组织结构基本正常(图1d);P-ANP组大鼠肠黏膜绒毛顶端出现上皮下间隙,部分组织黏膜上皮脱落,上皮与固有层分离,间质裸露、水肿,炎性细胞浸润,中央乳糜管扩张(图1e);大黄甘草汤组大鼠肠黏膜的损伤程度较P-ANP组明显减轻,仅有部分肠绒毛顶端出现上皮下间隙,偶见上皮层与固有层分离,且分离程度较轻(图1f)。

图1假手术组、P-SAP组、大黄甘草汤组24 h点胰腺组织及小肠组织的病理改变(×100)
P-ANP组、大黄甘草汤组的胰腺及肠组织的病理评分均随时间延长而逐渐增加,并显著高于假手术组(P值均<0.01)。但大黄甘草汤组的病理评分均较同时间点的P-ANP组显著降低,差异有统计学意义(P值均<0.05,表1),且胰腺组织与肠组织的病理评分呈正相关(r=0.796,P<0.01)。
二、肠黏膜组织透射电镜变化
假手术组大鼠肠上皮超微结构基本正常(图2a)。P-ANP组大鼠肠黏膜的微绒毛倒伏,缩短、稀疏、缺损,肠上皮结构及细胞间紧密连接不清,微绒毛上皮细胞的胞核固缩、裸露,核周间隙增宽,线粒体及内质网空泡变性(图2b),并随时间的延长而加重。大黄甘草汤组大鼠肠黏膜上皮轻度肿胀,微绒毛排列轻度紊乱、脱失,部分缩短、断裂,细胞内肿胀的线粒体和内质网少见,细胞间紧密连接较明显,细胞间隔增宽程度较P-ANP组减轻(图2c)。

表1 各组胰腺及小肠组织的病理学评分
注:与假手术组比较,aP<0.01,与P-ANP组比较,bP<0.05
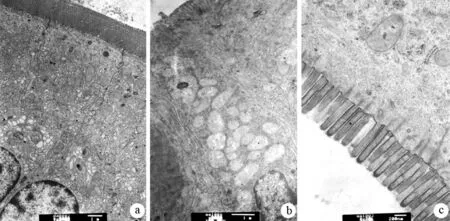
图2假手术组(a)、P-ANP组(b)、大黄甘草汤组(c)大鼠小肠黏膜的超微结构变化(a:×5000,b:×8000,c:×20000)
三、小肠组织IL-10、TNF-α表达变化
假手术组小肠组织IL-10、TNF-α水平均无明显
变化。P-ANP组和大黄甘草汤组IL-10、TNF-α水平均较假手术组显著增高;IL-10水平呈时间依赖性逐渐降低,而TNF-α水平呈时间依赖性逐渐增高。大黄甘草汤组IL-10水平较P-ANP组显著增高,但TNF-α水平较P-ANP组显著降低(P值均<0.05,表2)。


组别时点(h)只数IL-10TNF-α假手术组66132.77±11.49358.77±75.83126136.68±13.98353.05±76.21246137.80±12.82346.36±72.28P-ANP组66902.19±58.03a1664.21±301.50a126762.21±79.58a1913.87±259.33a246689.32±89.72a2225.10±324.63a大黄甘草汤组661031.91±95.35ab1216.58±249.21ab126896.36±84.87ab1481.58±231.47ab246808.58±91.16ab1776.53±221.09ab
注:与假手术组比较,aP<0.01,与P-ANP组比较,bP<0.05
讨 论
SAP时肠损伤十分常见,且常发生在其他脏器损伤之前,对疾病的发展与转归有重要影响[6]。高原地区SAP患者合并肠损伤较平原地区SAP患者更严重,其原因可能有:(1)高原低氧可引起红细胞代偿性增生、血细胞比容升高,加之高原人群习惯进食牛羊肉等含脂量高的食物,使血液黏稠度增高,易导致胰腺及肠黏膜微循环障碍[7];(2)肠道是缺氧敏感器官,高原缺氧条件容易使肠组织发生损伤,而肠损伤又可作为继发症状,加重原有病情[8];(3)低氧环境下,机体各种细胞因子处于高水平状态,当SAP时,细胞因子失衡发生更早、更严重;(4)高原环境下胰腺组织缺血、缺氧产生的氧自由基、中性粒细胞激活及缺血-再灌注损伤是SAP时潜在的损伤因素[9]。此外,炎症因子,尤其是抗炎因子IL-10和促炎因子TNF-α,在SAP的发生、发展过程中也起着重要作用。Norman等[10]发现,ANP发生30 min后,大鼠胰腺组织TNF-α mRNA高表达,随ANP进展,在肺及肝脏等器官组织中也可检测到TNF-α mRNA的表达增加。
近年来,中医学认为SAP的病因病机为饮食伤胃,肝胆失调,导致肝脾郁滞,热、湿、瘀蕴结中焦,由于肝胆和脾胃功能失调,疏泄不利,气机不畅,气滞血瘀而发病。根据中医“六腑以通为用”的原则,使用通腑泻下的方法,可有效消除SAP早期出现的腹胀,减轻腹压,通畅胰胆管,改善腹腔脏器血液供应。大黄甘草汤以大黄为主,配甘草组成,大黄可促进肠道蠕动及肠黏膜血液循环,加快肠道细菌和毒素排泄,减少细菌易位的机会,促进损伤的肠黏膜修复,防止小血栓形成,改善胰腺及肠组织微循环[11]。甘草具有补脾益气,清热解毒,祛痰止咳,缓急止痛,调和诸药等功效,具有抗菌、抗炎、抗变态反应以及非特异性免疫调节等药理作用[12],还具有解痉、抗溃疡、保肝作用。有研究报道,大黄甘草汤治疗SAP可明显改善患者肝肾功能及全身情况,缩短住院时间,减少并发症[13]。
本研究结果显示,高原ANP大鼠肠黏膜损伤严重,肠组织病理损伤与胰腺损伤呈正相关关系。此外,P-ANP组大鼠肠组织中TNF-α水平呈时间依赖性升高,IL-10的水平在造模后显著上升,随后呈时间依赖性降低,导致抗炎细胞因子的相对不足,提示炎症递质过度释放与肠屏障损伤可能在P-ANP的发生、发展过程中形成了某种协同效应。
总之,大黄甘草汤能迅速减轻高原ANP大鼠胰腺及肠组织损伤。大黄、甘草来源广泛,价格低廉,使用方便,可成为治疗高原SAP的常规辅助药物。
[1] Liu ZH, Peng JS, Li CJ, et al. A simple taurocholate-induced model of severe acute pancreatitis in rats. World J Gastroenterol, 2009,15: 5732-5739.
[2] Zhang XP, Zhang J, Song QL, et al. Mechanism of acute pancreatitis complicated with injury of intestinal mucosa barrier. J Zhejiang Univ Sci B, 2007,8: 888-895.
[3] 唐丙喜, 邓芝云, 孔祥才, 等. 大黄甘草汤对急性坏死性胰腺炎大鼠并发的肺损伤的影响. 中华胰腺病杂志, 2010,10: 180-183.
[4] Schmidt J, Lewandrowsi K, Warshaw AL, et al. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol, 1992,12: 41-51.
[5] Chiu CJ, McArdle AH, Brown R, et al. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg, 1970,101: 478-483.
[6] Capurso G, Zerboni G, Signoretti M, et al. Role of the gut barrier in acute pancreatitis. J Clin Gastroenterol, 2012,46: S46-S51.
[7] 张盼, 张方信. 高原缺氧环境下重症急性胰腺炎的发病机制和治疗进展. 医学综述, 2010,16: 2411-2414.
[8] 吴文明, 张方信, 张盼, 等. 高原缺氧条件对大鼠肠黏膜组织及缺氧诱导因子-1α、诱导型一氧化氮合酶表达的影响. 解放军医学杂志, 2010,35: 592-594+600.
[9] Rahman SH, Ammori BJ, Holmfield J, et al. Intestinal hypoperfusion contributes to gut barrier failure in severe acute pancreatitis. J Gastrointest Surg, 2003,7: 26-35.
[10] Norman JG, Fink G, Franz M, et al. Active interleukin-1 receptor required for maximal progression of acute pancreatitis. Ann Surg, 1996, 22:163-169.
[11] 陈德昌, 马丽琼, 刘绍泽. 大黄对脓毒症大鼠肠道细菌及其移位的影响. 中国危重病急救医学, 2009,21: 17-20.
[12] 王巧娥, 任虹, 曹学丽. 甘草研究开发与利用现状. 中国农学通报, 2011,22: 290-295.
[13] 张方信, 唐丙喜, 邓芝云, 等. 大黄甘草汤在重症急性胰腺炎患者中的治疗观察. 临床消化病杂志, 2010,22: 38-41.
EffectofDahuangGancaodecoctiononintestinalinjurycausedbyacutenecrotizingpancreatitisatplateau
ZHANGFang-xin,LIWen-xiang,DENGZhi-yun,ZHANGPan,CHENJia-yu,DENGShang-xin,WANGXiu-feng,JIAHong-mei,GOUYan-zi.
DepartmentofGastroenterology,GeneralHospitalofLanzhouCommand,Lanzhou730050,China
DENGZhi-yun,Email:liwenx11@126.com
ObjectiveTo investigate the therapeutic effects of dahuang gancao decoction on intestinal injury caused by plateau acute necrotizing pancreatitis (ANP).MethodsFifty-four Wistar rats were transported from Lanzhou to Maxianshan (altitude 3848 m) for 30 days adaptive feeding, then they were randomly divided into 3 groups (n=18 in each group), namely sham-operated group (SO), P-ANP group (P-ANP), dahuang gancao decoction intervention group (DG). P-ANP model was induced by retrograde injection of 4% sodium taurocholate into the biliary and pancreatic duct. Dahuang gancao decoction 0.6 ml/100 g weight was gavaged 2 h before and every 12 h after P-ANP model induction. The same volume of normal saline was gavaged in the SO and P-ANP group. After 6, 12, 24 h, all rats were sacrificed, and pancreas and intestine tissues were harvested to observe the pathological changes. The change of intestinal mucosal ultrastructure was observed under transmission electron microscope. The expression of IL-10, TNF-α in intestinal tissue was determined by ELISA.Resultstwelve hours after P-ANP induction, the pancreas pathological scores were 0.33±0.52, 8.33±0.52, 6.17±2.13; the intestine pathological scores were 0.17±0.41, 3.83±1.17, 2.17±1.17 in SO group, P-ANP group and DG group. The values in P-ANP group and DG group were significantly higher than that in SO group (P<0.01), and the corresponding values in DG group were significantly lower than that in P-ANP group (P<0.05), and there was a positive association between pancreas and intestine injuries (r=0.796,P<0.01). The injury of intestinal mucosal ultrastructure in P-ANP groups was severe; however, the injury was less severe in DG group. Twelve hours after ANP induction, the IL-10 levels in intestinal tissue were (136.68±13.98), (762.21±79.58), (896.36±84.87) pg/g; the TNF-α levels in intestinal tissue were (353.05±76.21), (1913.87±259.33), (1481.58±231.47) pg/g in SO group, P-ANP group and DG group. The values in P-ANP group and DG group were significantly higher than that in SO group, and the corresponding values of IL-10 in DG group were significantly higher than that in P-ANP group (P<0.05), but the corresponding values of TNF-α were significantly lower than that in P-ANP group (P<0.05).ConclusionsDahuang gancao decoction may quickly improve intestine injury caused by P-ANP in rats.
Pancreatitis, acute necrotizing; Anoxia; Intestinal mucosa; Permeability; Dahuang gancao decoction
2013-05-30)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2013.06.008
全军后勤科研计划(CLZ12J005)
730050 兰州,兰州军区兰州总医院消化科(张方信、张盼、陈嘉屿、邓尚新、王秀锋、贾红梅、苟艳子),检验科(邓芝云);兰州大学第二临床医学院消化科(李文祥)
邓芝云,Email:liwenx11@126.com
