连接黏附分子C单抗对小鼠急性坏死性胰腺炎肝损伤的保护作用
2013-10-19胡端敏杨勇唐文
胡端敏 杨勇 唐文
连接黏附分子C单抗对小鼠急性坏死性胰腺炎肝损伤的保护作用
胡端敏 杨勇 唐文
重症急性胰腺炎(SAP)往往伴有多器官的功能损伤,其中肝脏的损伤十分多见,且肝功能损害程度对预测SAP预后尤为重要。SAP导致的炎症细胞过度激活和在肝脏组织的浸润是肝功能损伤的重要机制[1],其中细胞黏附分子粘附于炎症细胞的过程,对白细胞过度激活以及SAP时脏器损伤的发生、发展有重要意义。连接黏附分子C(junctional adhesion molecule-C, JAM-C)是近年新发现的在血管内皮细胞上分布的细胞黏附分子,它介导中性粒细胞向炎症部位和组织损伤处浸润和聚集[2]。本研究组前期的研究发现,JAM-C在急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)小鼠全身主要器官的表达明显增高[3]。本研究应用抗JAM-C单抗干预ANP小鼠,观察抑制了JAM-C介导的粘附作用对ANP小鼠肝损伤的影响。
一、材料和方法
1.实验动物及分组:清洁级昆明小鼠18只,雌雄不分,体质量(20±2)g,购自苏州大学动物实验中心。按完全随机法将小鼠分为对照组、ANP组、JAM-C单抗处理组(抗体组),每组6只。采用腹腔注射雨蛙素(50 μg/kg体质量,美国Sigma公司)6次,间隔1 h的方法制备ANP模型,末次注射后立即腹腔注射内毒素10 mg/kg体质量。抗体组以同样方法制备ANP模型,同时在首次注射雨蛙素30 min后腹腔内注射羊抗小鼠JAM-C单抗0.3 ml(300 μg,美国R&D公司),末次雨蛙素注射后腹腔内注射内毒素10 mg/kg体质量。
2.血清酶学和TNF-α浓度测定:在末次注射后3 h,心脏穿刺收集血液,应用OLYMPUS全自动生化仪检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和淀粉酶活性,采用ELISA法测定血清TNF-α水平,ELISA试剂盒购自武汉博士德生物有限公司,操作步骤均严格按照说明书。
3.胰腺、肝脏组织病理检查:取血后用颈椎脱臼法处死小鼠,开腹取胰腺及肝脏组织,置10%甲醛溶液固定,常规石蜡包埋、切片、HE染色,光镜下观察。按Schmidt等[4]和Mota等[5]的标准分别对胰腺和肝脏组织行病理学评分。

二、结果
1.胰腺病理变化及评分:对照组胰腺组织正常(图1)。ANP组胰腺高度水肿,腺泡呈孤岛状,广泛腺细胞坏死,细胞结构模糊不清,胞质内空泡形成,局部有融合性坏死灶,坏死区有大量中性粒细胞和单核细胞浸润(图1),胰周脂肪坏死,有大量炎症细胞浸润,血管扩张充血,间质内动脉痉挛,静脉明显扩张淤血,炎症细胞附边,局部血管壁出血、坏死。抗体组胰腺间质充血水肿,有中性粒细胞和单核细胞浸润,少量局灶性腺泡坏死,血管病变不明显,无出血(图1)。对照组、ANP组、抗体组胰腺病理评分分别为0、(9.3±1.3)、(6.2±1.1)分,抗体组评分较ANP组显著降低(P<0.05)。
2.肝脏病理变化及评分:对照组肝脏组织结构未见明显异常(图1)。ANP组肝脏充血,肝小叶内肝索结构紊乱,肝细胞广泛空泡样变性,肝血窦内充满红细胞,门管区炎症细胞浸润(图1)。抗体组肝细胞肿胀明显,散在空泡样变性,少量炎细胞浸润(图1)。对照组、ANP组、抗体组肝脏组织病理评分分别为0、(7.8±1.6)、(5.2±1.1)分,抗体组评分较ANP组显著降低(P<0.05)。
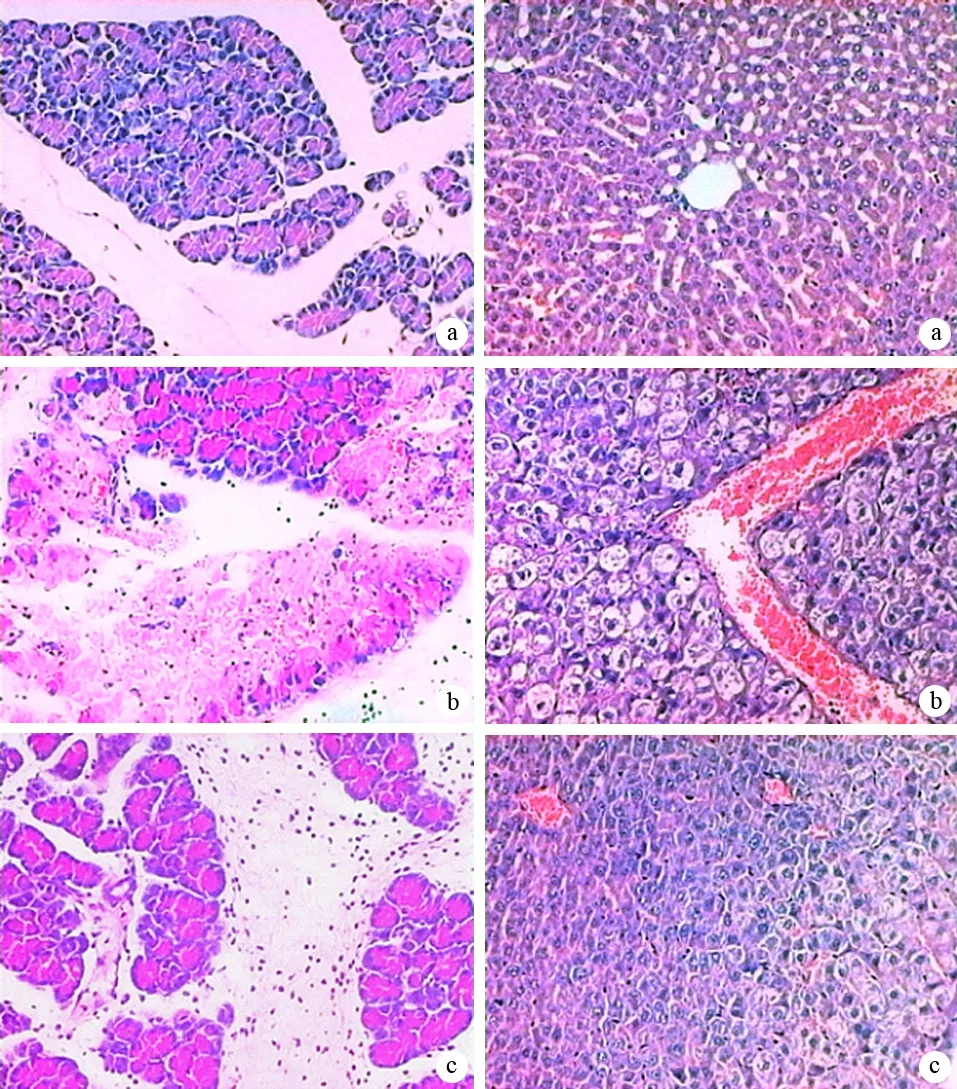
图1对照组(a)、ANP组(b)、抗体组(c)胰腺(左)和肝脏(右)的病理变化(HE ×100)
3.血清ALT、AST、淀粉酶、TNF-α水平的变化:对照组、ANP组、抗体组的ALT分别为(40±5)、(121±26)、(85±16)U/L;AST分别为(118±18)、(386±42)、(258±36)U/L;淀粉酶分别为(1876±245)、(17985±1064)、(13870±988)U/L;TNF-α分别为(58±13)、(628±48)、(320±23)ng/L。ANP组各指标均显著高于对照组,抗体组各指标均较ANP组显著降低,但仍显著高于对照组(P值均<0.05)。
讨论JAM-C是免疫球蛋白超家族成员之一,它主要分布在白细胞、血小板、各种上皮及血管内皮细胞上。在腹膜炎[6]、肺炎[7]、皮肤炎症[8]、关节炎[9]等动物模型的研究中发现JAM-C增加了中性粒细胞在炎症部位和组织损伤处的浸润和聚集。
Rau等[10]使用细胞间黏附分子-1(ICAM-1)单抗预处理ANP大鼠,结果有效地减少了ANP大鼠胰腺内的白细胞浸润,明显降低了胰腺炎症的病理评分,抑制了胰腺的早期坏死和后期的细胞凋亡。Hartwig等[11]报道,阻断黏附分子L选择素的表达能明显降低白细胞渗出和肺损害。这些研究的重点主要是针对介导白细胞趋边、滚动和初步粘附的分子。JAM-C主要分布在血管内皮细胞间的紧密连接上,它的配体主要是分布在各种白细胞上的整和素Mac-1(αLβ2、CD11b/CD18)。正是由于这种细胞膜分布上的特异性,JAM-C在白细胞激活向炎症区域募集的过程中主要作用于白细胞的跨壁穿越过程。Chavakis等[12]使用JAM-C的可溶形式(sJAM-C)结合中性粒细胞上的整和素Mac-1后,发现血管炎症明显减轻,且白细胞渗出也明显减少。Scheiermann等[13]报道,拮抗JAM-C能使缺血再灌注损伤小鼠的中性粒细胞血管外渗明显减少。Vonlaufen等[14]发现高表达JAM-C的转基因小鼠制备ANP模型后胰腺和肺组织炎症损伤明显重于正常小鼠制备的ANP模型。本研究结果显示,JAM-C单抗处理后的ANP小鼠胰腺和肝脏组织的病理损伤明显减轻,血清ALT、AST、淀粉酶水平显著下降,同时血TNF-α水平亦显著下降。因TNF-α是ANP合并全身炎症反应综合征的主要炎症因子,与急性胰腺炎的临床预后密切相关[15],故用抗体中和JAM-C后不仅能减轻ANP小鼠胰腺和肝脏组织的炎症损伤,还可能有效缓解全身炎症反应。因此,阻断参与ANP后期细胞事件的黏附分子JAM-C可能成为治疗ANP肝损伤的有效治疗方法。
[1] Yang R, Shaufl AL, Killeen ME, et al. Ethyl Pyruvate Ameliorates Liver Injury Secondary to Severe Acute Pancreatitis. J Surg Res,2009,153:302-309.
[2] Ody C, Jungblut-Ruault S, Cossali D, et al. Junctional adhesion molecule C(JAM-C) distinguishes CD27+germinal center B lymphocytes from non-germinal center cells and constitutes a new diagnostic tool for B-cell malignancies. Leukemia, 2007, 21:1285-1293.
[3] 胡端敏, 杨勇, 唐文.JAM-C在小鼠急性坏死性胰腺炎模型不同组织中的表达.世界华人消化杂志, 2010,18:81-83.
[4] Schmidt J, Rattner DW, Lewandrowski K, et al. A better model of acute pancreatitis for evaluating therapy. Ann Surg, 1992, 215:44-56.
[5] Mota R, Sańchez-Bueno F, Berenguer-Pina JJ, et al. Therapeutic treatment with poly(ADP-ribose) polymerase inhibitors attenuates the severity of acute pancreatitis and associated liver and lung injury. Bri J Pharmacol, 2007, 151: 998-1005.
[6] Chavakis T,Keiper T,Matz-Westphal R,et al.The junctional adhesion molecule-C promotes neutrophil transendothelial migration in vitro and in vivo.J Biol Chem,2004,279:55602-55608.
[7] Aurrand-Lions M, Lamagna C, Dangerfield JP, et al. Junctional adhesion molecule-C regulates the early influx of leukocytes into tissues during inflammation. J Immunol, 2005, 174:6406-6415.
[8] Ludwig RJ, Zollner TM, Santoso S, et al. Junctional Adhesion Molecules (JAM)-B and -C Contribute to Leukocyte Extravasation to the Skin and Mediate Cutaneous Inflammation. J Invest Dermatol, 2005, 125:969-976.
[9] Palmer G, Busso N, Aurrand-Lions M, et al. Expression and function of junctional adhesion molecule-C in human and experimental arthritis. Arthritis Res Ther, 2007,9:R65.
[10] Rau B, Paszkowski A, Esber S, et al.Anti-ICAM-1 antibody modulates late onset of acinar cell apoptosis and early necrosis in taurocholate-induced experimental acute pancreatitis. Pancreas, 2001, 23:80-88.
[11] Hartwig W, Jimenez RE, Fernandez-del Castillo C, et al. Expression of the adhesion molecules Mac-1 and L-selectin on neutrophils in acute pancreatitis is protease- and complement-dependent. Ann Surg, 2001, 233:371-378.
[12] Chavakis T, Keiper T, Matz-Westphal R, et al. The Junctional Adhesion Molecule-C Promotes Neutrophil Transendothelial Migration in Vitro and in Vivo. J Biol Chem, 2004,279: 55602-55608.
[13] Scheiermann C, Colom B, Meda P, et al. Junctional adhesion molecule (JAM)-C mediates leukocyteinfiltration in response to ischemia reperfusion injury. Arterioscler Thromb Vasc Biol, 2009, 29:1509-1515.
[14] Vonlaufen A, Aurrand-Lions M, Pastor CM, et al. The role of junctional adhesion molecule C (JAM-C) in acute pancreatitis. J Pathol, 2006, 209:540-548.
[15] 李荣洲,任宗海,林讷,等. 急性胰腺炎患者血清ICAM-1、TNF-α和P选择素浓度与病情严重程度的关系. 胰腺病学,2005,5:170-171.
2013-05-15)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.06.017
苏州大学医学发展基金项目(EE123715)
215004 江苏苏州,苏州大学第二附属医院消化科
唐文,Email: sztangwen@163.com
