KAI1基因转染对乏氧培养下胰腺癌MiaPaCa-2细胞增殖、迁移及VEGF表达的影响
2013-10-19刘旭郭晓钟李宏宇陈江许文达
刘旭 郭晓钟 李宏宇 陈江 许文达
·论著·
KAI1基因转染对乏氧培养下胰腺癌MiaPaCa-2细胞增殖、迁移及VEGF表达的影响
刘旭 郭晓钟 李宏宇 陈江 许文达
目的观察转染KAI1基因的人胰腺癌MiaPaCa-2细胞在乏氧条件下培养后细胞增殖、迁移、侵袭能力的变化,探讨其可能机制。方法应用KAl1基因过表达质粒转染乏氧条件培养后的人胰腺癌MiaPaCa-2细胞,采用蛋白质印迹法检测转染细胞KAI1、VEGF-C、VEGF-A蛋白的表达,四甲基偶氮唑蓝(MTT)法检测转染细胞的增殖,细胞划痕及Transwell小室实验观察转染细胞的迁移及侵袭能力,酶联免疫吸附测定法检测培养上清液中人VEGF-C、VEGF-A含量。结果转染KAI1基因后的MiaPaCa-2-K细胞的KAI1蛋白表达量较未转染细胞显著增加[(0.549±0.021)比0]。乏氧条件培养后转染细胞的增殖无明显变化,但它的迁移距离明显缩短,穿膜细胞数显著减少[(14.0±5.8)比(43.0±14.4)个,P<0.05];细胞的VEGF-C表达显著降低[(0.218±0.043)比(0.745±0.069)。P<0.05],但VEGF-A表达变化不显著;细胞培养上清液中VEGF-C含量显著减少[(1236±247)比(2045±221)pg/ml,P<0.01]。结论转染KAl1基因的MiaPaCa-2细胞在乏氧条件下培养后的细胞迁移、侵袭能力减弱,其机制可能是通过下调VEGF-C的表达来抑制胰腺癌淋巴转移的。
胰腺肿瘤; 缺氧; 细胞增殖; 细胞运动; 血管内皮生长因子类; KAI1基因
【Keywrods】 Pancreatic neoplasms; Anoxia; Cell proliferation; Cell movement; Vascular endothelial growth factors; KAI1 gene
早期即发生淋巴转移是胰腺癌重要特征和预后极差的重要因素[1]。早期胰腺癌组织常处于乏氧状态,乏氧状态下胰腺癌细胞的增殖和转移明显活跃[2],因此,乏氧状态可能促进了胰腺癌的淋巴转移。KAI1基因是一种肿瘤转移抑制基因,其对胰腺癌的迁移、侵袭、自噬均具有调节作用。近期研究结果显示,在乏氧状态下KAI1是一种重要的乏氧靶基因[3]。本研究将插入KAI1基因的真核质粒转染人胰腺癌MiaPaCa-2细胞,观察乏氧条件培养后细胞增殖、迁移、侵袭能力及VEGF蛋白表达的变化,探讨KAI1基因调控胰腺癌淋巴转移的可能作用及机制。
材料和方法
一、KAl1基因转染
MiaPaCa-2细胞株为沈阳军区总医院消化内科保存。携带人KAI1全长cDNA的真核表达质粒(pCMV-KAI1) 由本研究组前期构建[4-5]。在完全密闭的方盒中持续通入由乏氧设备产生的乏氧气体(1% O2、5% CO2和94% N2),将处于对数生长期的MiaPaCa-2细胞在乏氧环境中培养1周后接种到6孔板。采用Lipofectamine 2000(美国Invotrogen公司)将pCMV-KAI1转染MiaPaCa-2细胞,经G418筛选后扩增培养。以转染pCMV空质粒及未转染细胞作为对照。
二、蛋白质印迹法
收集各组对数生长期的2×106个细胞,裂解并收集细胞总蛋白,采用BCATM蛋白定量试剂盒对蛋白进行定量。采用常规蛋白质印迹法检测KAI1蛋白及VEGF-C、VEGF-A蛋白的表达。各种抗体均购自美国Santa Cruz公司,以β-actin作为内参,采用Quantity One软件(BioRad)测定蛋白条带的灰度值,以目的条带与内参条带灰度比值表示蛋白表达量。
三、四甲基偶氮唑蓝(MTT)法
将各组对数生长期细胞调整密度至1×104个/ml,取200 μl细胞悬液接种入96孔细胞培养板。分别培养24、48、72、96 h,每组每个时间点设3个复孔。培养到时间点时,每孔加入20 μl MTT溶液(5 mg/ml)继续培养4 h,加入150 μl DMSO振荡10 min。在酶标仪上检测各孔490 nm波长处的吸光值(A490值),以只含培养液并加入150 μl DMSO的空白对照孔调零,绘制细胞生长曲线。
四、Transwell小室侵袭实验
将对数生长期的各组细胞用无血清DMEM调整到密度为1×105个/ml。在Transwell小室(美国Costar公司)的上室加入细胞悬液100 μl,下室加入600 μl含有10%胎牛血清的DMEM培养液。每组设3个小室。在乏氧条件下培养12 h。取出小室,用PBS淋洗,用棉签轻轻刮除上室中未迁移的细胞,固定、染色、计算穿膜细胞数并拍照。实验重复3次。
五、细胞划痕实验
收获对数生长期的各组细胞,调整细胞密度至1×105个/ml,接种于6孔板中,每组设3个复孔。乏氧条件下培养至细胞呈单层,以移液器枪头在培养孔底部呈“1”型划过。以无血清DMEM培养液洗涤以弃去漂浮细胞,更换为含10%胎牛血清的培养液继续培养,在培养24、48、72 h后镜下观察细胞爬过划痕的情况并拍照。实验重复3次。
六、酶联免疫吸附测定(ELISA)法
取对数生长期细胞,以每孔1×105个细胞接种于12孔板中。乏氧条件培养下细胞贴壁生长24 h,收集细胞培养上清液,离心取上清液。在VEGF-C酶联免疫试剂盒(美国Ray Bio公司)提供的已标记的ELISA酶标板的各孔先加入样品稀释液40 μl,然后再将待测样品10 μl加于酶标板底部(最终稀释度为5倍)。按试剂盒说明书操作。以空白孔调零,测定各孔450 nm波长的吸光值(A450值)。
七、统计学处理
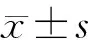
结 果
一、转染细胞的鉴定
未转染的MiaPaCa-2细胞和空载体转染细胞(MiaPaCa-2-p)均无KAI1蛋白表达,转染pCMV-KAI1的MiaPaCa-2细胞(MiaPaCa-2-K)的KAI1蛋白表达量为0.549±0.021(图1),提示成功构建了KAI1基因高表达的MiaPaCa-2细胞株。
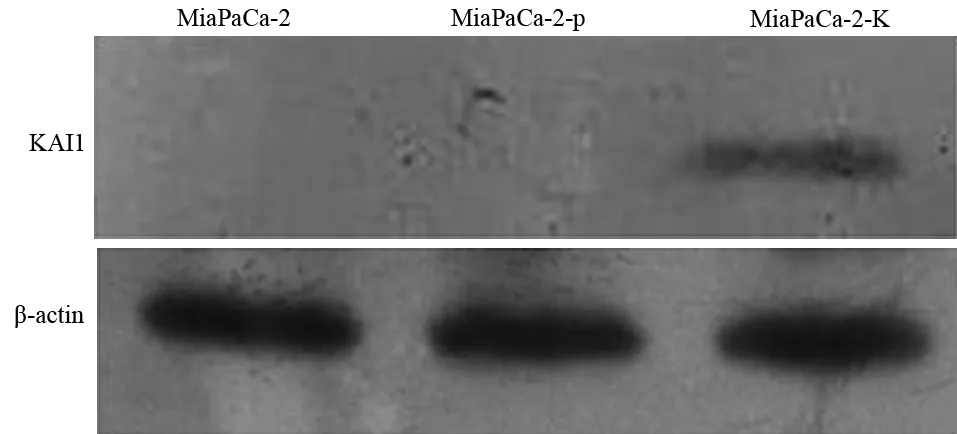
图1 各组MiaPaCa-2细胞的KAI1蛋白表达
二、乏氧条件培养下各组细胞的增殖状况
在乏氧环境中培养24、48、72、96 h后,MiaPaCa-2细胞的A490值分别为0.18、0.20、0.39、0.44;MiaPaCa-2-p细胞为0.17、0.19、0.36、0.46,MiaPaCa-2-K细胞为0.16、0.17、0.33、0.41。3组细胞的增殖速度无明显差异(图2)。
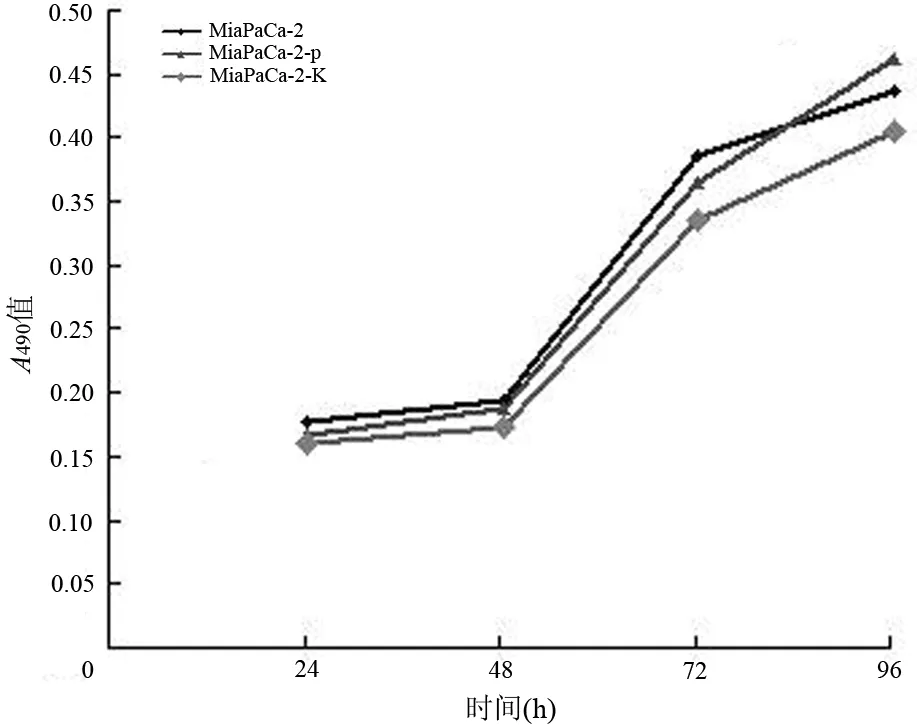
图2 各组MiaPaCa-2细胞的生长曲线
三、乏氧条件培养下各组细胞的迁移能力
MiaPaCa-2-K 组细胞的迁移距离较MiaPaCa-2及MiaPaCa-2-p细胞均短(图3)。
四、乏氧条件培养下各组细胞的侵袭能力
MiaPaCa-2、MiaPaCa-2-p、MiaPaCa-2-K组的穿膜细胞数分别为(43.0±14.4)、(48.0±12.6)、(14.0±5.8)个(图4),MiaPaCa-2-K组的穿膜细胞数较MiaPaCa-2-p组及MiaPaCa-2组均显著减少,差异具有统计学意义(t值分别为10.67、12.85,P值均<0.05)。
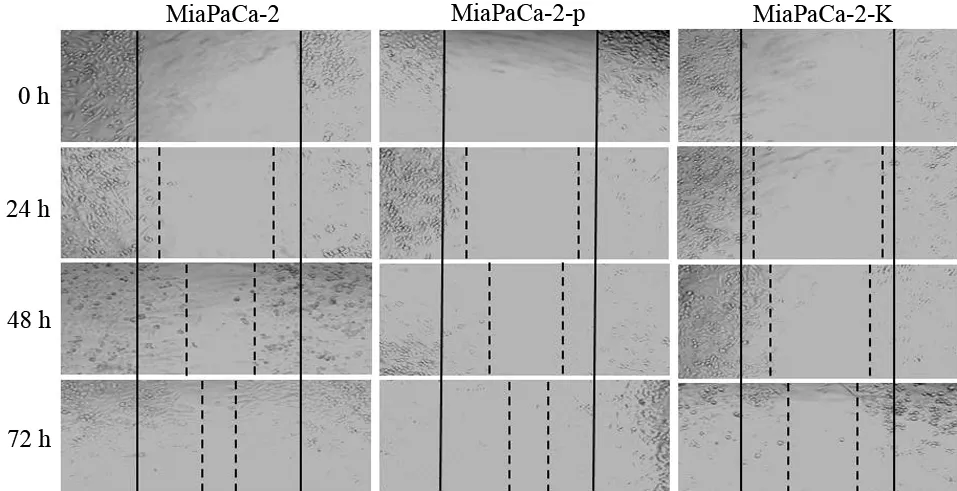
图3 各组MiaPaCa-2细胞的迁移情况(×100)
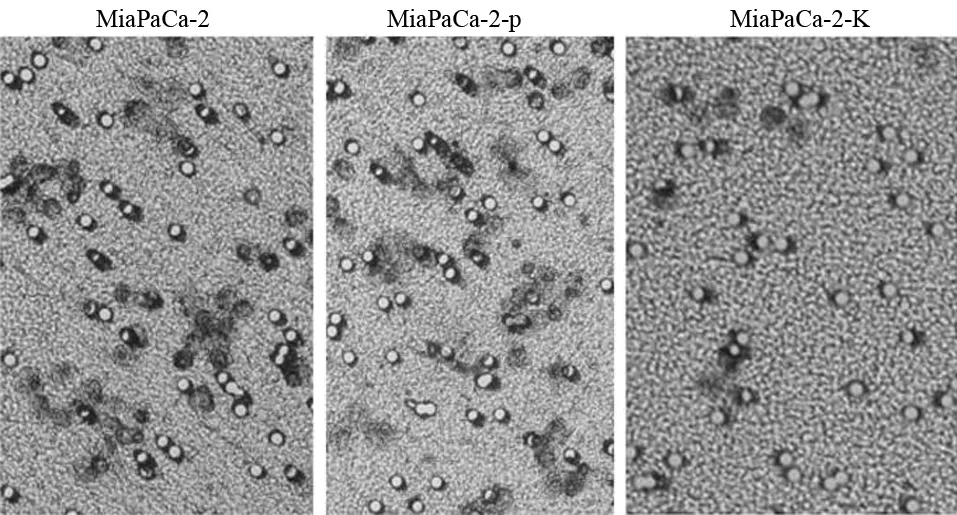
图4 各组MiaPaCa-2细胞的穿膜细胞(×200)
五、乏氧条件培养下各组细胞VEGF-C、VEGF-A蛋白表达
MiaPaCa-2、MiaPaCa-2-p、MiaPaCa-2-K细胞VEGF-C表达量分别为0.745±0.069、0.687±0.087、0.218±0.043,VEGF-A表达量分别为0.389±0.073、0.385±0.067、0.365±0.058(图5)。MiaPaCa-2-K组细胞的VEGF-C表达较其他两组细胞显著下降,差异具有统计学意义(t值分别为13.12、11.65,P值均<0.05),但各组间VEGF-A的表达差异无统计学意义。
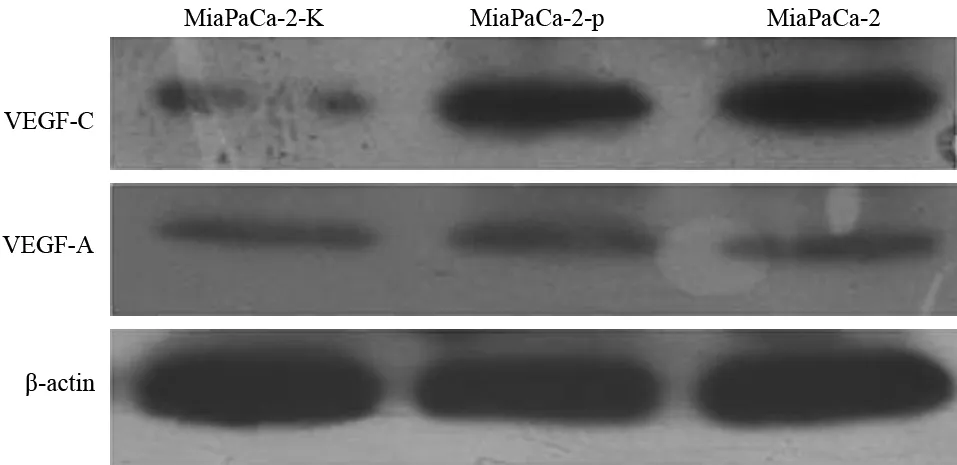
图5 各组MiaPaCa-2细胞的VEGF-A、VEGF-C蛋白表达
MiaPaCa-2、MiaPaCa-2-p、MiaPaCa-2-K细胞培养上清液中VEGF-C含量分别为(2045±221)、(2163±239)、(1236±247)pg/ml,MiaPaCa-2-K组细胞显著低于其他两组(t值分别为11.36、10.93,P值均<0.01)。
讨 论
转移是恶性肿瘤的显著特点,淋巴转移是重要的肿瘤转移途径之一。由于毛细淋巴管的管腔大而不规则(直径10~60 μm),管壁仅由一层淋巴内皮细胞和极薄的结缔组织构成,且其主要功能是可根据组织内压调节细胞间的连接以容许液体及大分子物质通过[6],因此,毛细淋巴管具有比毛细血管更大的通透性,癌细胞也更容易进入毛细淋巴管发生淋巴转移。
KAI1基因编码的蛋白质CD82属Ⅲ型膜蛋白的4次跨膜超家族(transmembrane 4 su perfamily,TM4SF)[6],具有4个高度保守的疏水跨膜结构(TM1-4)、一个近N端小的细胞外环(extracellular loops1,EC1)和一个近C端大的细胞外亲水环状结构(EC2)。该结构平行于细胞膜,也决定了该蛋白功能的特异性。它可介导包括细胞与细胞、细胞与细胞外基质等在内的信号转导,并在细胞的聚集、粘附、迁移、增殖过程中具有一定的调节作用。本研究组以往的研究发现,早期胰腺癌(Ⅰ、Ⅱ期) KAI1 mRNA表达显著高于伴有淋巴结或远处转移的晚期胰腺癌(Ⅲ、Ⅳ期),KAI1基因高表达显著抑制细胞的侵袭能力[7]。细胞内1-磷酸鞘氨醇(S1P)的产生是由鞘氨醇激酶(SPK)催化生成的,而SPK信号通路与细胞迁移密切相关。高表达KAI1基因的胰腺癌细胞S1P的合成降低,因此推测KAI1基因具有抑制胰腺癌细胞SPK活性的作用,并抑制胰腺癌细胞迁移[5]。本研究在乏氧条件下培养人胰腺癌细胞MiaPaCa-2,结果显示 KAI1基因的高表达对细胞增殖作用不明显,但可显著抑制癌细胞的迁移,可能是其抑制淋巴转移的重要机制之一。
相关研究显示,部分VEGF家族成员和受体信号通路在淋巴管新生和淋巴转移过程中起着关键性作用。并已证实胰腺癌细胞可以合成并释放VEGF-C、VEGF-A等因子[8-9],刺激淋巴管内皮细胞增殖,趋化其向病变部位迁移[10],最终促进肿瘤淋巴转移的发生。本研究结果显示,在乏氧条件培养下KAI1高表达对胰腺癌MiaPaCa-2细胞VEGF-A的表达无明显作用,但显著抑制了VEGF-C的表达及其在培养上清中的含量,提示KAI1基因抑制淋巴转移的作用可能是通过下调VEGF-C表达来实现的。
[1] Pawlik TM, Gleisner AL, Cameron JL, et al. Prognostic relevance of lymph node ratio following pancreatic oduodenectomy for pancreatic cancer. Surgery, 2007, 141:610- 618.
[2] Hill RP,Marie-Eqyptienne DT,Hedley DW.Cancer stem cells,hypoxia and metastasis.Semin Radiat Oncol,2009,19:106-111.
[3] Kim B, Boo K, Lee JS, et al. Identification of the KAI1 metastasis suppressor gene as a hypoxia target gene. Biochem Biophys Res Commun, 2010, 393:179-184.
[4] 郭晓钟, 徐建华,刘民培,等.KAI1基因抑制胰腺癌细胞转移机制的探讨.中华内科杂志,2004,43:360-362.
[5] 郭晓钟,张巍巍,王立生,等.KAI1基因抑制胰腺癌细胞鞘氨醇激酶活性及其迁移.中华内科杂志, 2006,45:752-754.
[6] Butler MG, Isogai S, Weinstein BM. Lymphatic development. Birth Defects Res C Embryo Today, 2009, 87:222-231.
[7] Miranti CK. Controlling cell surface dynamics and signaling: How CD82/KAI1 suppresses metastasis. Cell Signal, 2009,21:196-211.
[8] Su JL, Yang PC, Shih JY, et al. The VEGF-C/Flt-4 axis promotes invasion and metastasis of cancer cells. Cancer Cell, 2006, 9:209-223.
[9] Hirakawa S, Brown LF, Kodama S, et al. VEGF-C-induced lymphangiogenesis in sentinel lymph nodes promotes tumor metastasis to distant sites. Blood, 2007,109:1010-1017.
[10] Saintigny P, Kambouchner M, Ly M, et al. Vascular endothelial growth factor-C and its receptor VEGFR-3 in non-small-cell lung cancer: concurrent expression in cancer cells from primary tumour and metastatic lymph node. Lung Cancer, 2007,58:205-213.
EffectsofKAl1genetransfectiononproliferation,migration,invasionandVEGFexpressionofpancreaticcancerMiaPaCa-2cellsunderhypoxiccondition
LIUXu,GUOXiao-zhong,LIHong-yu,CHENJiang,XUWen-da.
DepartmentofGastroenterology,GeneralHospitalofShenyangMilitaryAreaCommand,Shenyang110016,China
GUOXiao-zhong,Email:guoxiaozhong1962@163.com
ObjectiveTo investigate the effects of KAll gene transfection on proliferation, migration, invasion and VEGF expression of pancreatic cancer MiaPaCa-2 cells under hypoxic condition, and explore possible mechanism.MethodsThe pcMV-KAI1 vector which contained the full length of KAI1 cDNA was transfected into pancreatic cancer cells MiaPaCa-2, and KAI1, VEGF C, VEGF A protein expressions were determined by Western blot. The proliferation of pancreatic cancer cells was evaluated by MTT method. Wound-healing assay and cell invasion assay were used to detect the migration and invasion of pancreatic cancer cells. The expression of VEGF C, VEGF A in supernatant of culture was measured by ELISA method.ResultsThe expression of KAI1 protein in MiaPaCa-2 K transfected with KAI1 was significantly higher than that in non-transfected cells [(0.549±0.021)vs0,P<0.05]. The proliferation under hypoxic condition was not significantly different, but the migration distance was significantly shorter and the number of transmembrane cell was significantly decreased [(14.0±5.8)vs(43.0±14.4),P<0.05]. The expression of VEGF-C in cell was significantly decreased [(0.218±0.043)vs(0.745±0.069),P<0.05], but the expression of VEGF-A was not significantly different; the expression of VEGF-C in cell culture supernatants was significantly decreased [(1236±247)vs(2045±221)pg/ml,P<0.01].ConclusionsThe migration, invasion ability of pancreatic cancer MiaPaCa-2 cells with KAll transfection under hypoxic condition is decreased, and the possible mechanism of inhibiting lymphatic metastasis is down-regulation of VEGF-C expression.
2013-06-24)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2013.06.003
国家自然科学基金(81071982)
110016 辽宁沈阳,沈阳军区总医院消化内科
郭晓钟,Email: guoxiaozhong1962@163.com
