无溶剂法OMS-2催化氧化苯甲醇制苯甲醛的研究*
2013-10-17蔡妃妹刁贵强成晓玲王路枝任永辉曹小荣
蔡妃妹,余 林,孙 明,刁贵强,成晓玲,余 倩,王路枝,任永辉,曹小荣
(广东工业大学轻工化工学院,广东广州 510006)
氧化锰八面体分子筛 (OMS-2)含有 Mn4+,Mn3+,Mn2+3种变价状态,具有温和的表面酸碱性、良好的氧化还原性和优异的离子交换性[1],是一种被广泛使用的化学计量氧化剂[2]。V.D.Makwana等[3-4]却发现OMS-2能高选择性地催化气相氧分子与苯甲醇的液相选择氧化反应,由于该反应体系均用甲苯作为溶剂,毒性大,不利于环保,因此需要研究在无溶剂的条件下进行反应。目前,仅有少数文献报道了以过氧化氢叔丁醇(TBHP)为氧化剂,以Au/MgO[5]或 Au/U3O8[6]为催化剂,在无溶剂的条件下能高效地催化氧化苯甲醇制苯甲醛,但是所采用的催化剂都很昂贵。因此,需要开发廉价的催化剂代替这些昂贵的催化剂。为此,笔者尝试在无溶剂条件下,以通过超声波辅助溶胶-凝胶法合成的OMS-2为催化剂,70%TBHP为氧化剂,研究其对苯甲醇选择性催化氧化的性能。
1 实验部分
1.1 试剂及仪器
高锰酸钾,富马酸,苯甲醇,70%过氧化氢叔丁醇,30%过氧化氢,无水乙醇。
Micromeritics Gemini V2380型吸附仪,D/MAX-3A型X射线衍射仪,AutoChemⅡ2920多用吸附仪,TECNAI-10型透射电子显微镜,Agilent 7820A气相色谱仪。
1.2 催化剂的制备
在室温下,将KMnO4和富马酸按照物质的量比为3∶1混合[先配制 300 mL高锰酸钾溶液(0.25 mol/L)并将其倒入三口烧瓶中,然后将2.902 g富马酸粉末直接加入高锰酸钾溶液中],超声搅拌30 min,室温下凝胶24 h,随后洗涤至中性,置于90℃干燥箱中干燥12 h,研磨后得到样品,将样品在马弗炉中于空气气氛中焙烧,温度分别为 400,500,600,700 ℃,焙烧时间均为3 h,焙烧升温速度为4℃/min,所得最终产物分别标为 MnOx-400,MnOx-500,MnOx-600和MnOx-700。
1.3 催化剂活性的测试
将催化剂(0.5 g)、苯甲醇(20 mL)加入到 50 mL三颈烧瓶中预热至80℃,再将20 mL的70%TBHP缓慢滴入反应体系中,同时剧烈搅拌、回流反应一段时间后取样,然后在高速冷冻离心机中以8000 r/min的速度离心10 min分离出溶液中固体催化剂,取上层清液在安装有DB-624毛细色谱柱和TCD检测器的Agilent 7820A型气相色谱仪上分析。
2 结果与讨论
2.1 XRD表征
图1为不同温度焙烧的样品XRD谱图。由图1可见,经400℃焙烧后,样品在2θ为12.6°、18.0°、28.7°、37.5°、41.9°和 60.1°处出现了 OMS-2(KMn8O16,PDF 42-1348)的主要特征衍射峰,在谱图中未见杂相峰,表明无定形的氧化锰转变为晶相OMS-2[7]。然而,焙烧温度大于或等于600℃时,在约32.8°处出现1个杂相峰,表明样品开始分解,经检索该峰与bixbyite型的 Mn2O3(PDF 10-0069)的特征峰接近。不同温度焙烧的样品的比表面积如表1所示,由表1看出,随着焙烧温度的增加,样品的比表面积降低。当焙烧温度从400℃增加到500℃时,样品的比表面积剧烈变化,反映出其结构的显著变化[2]。
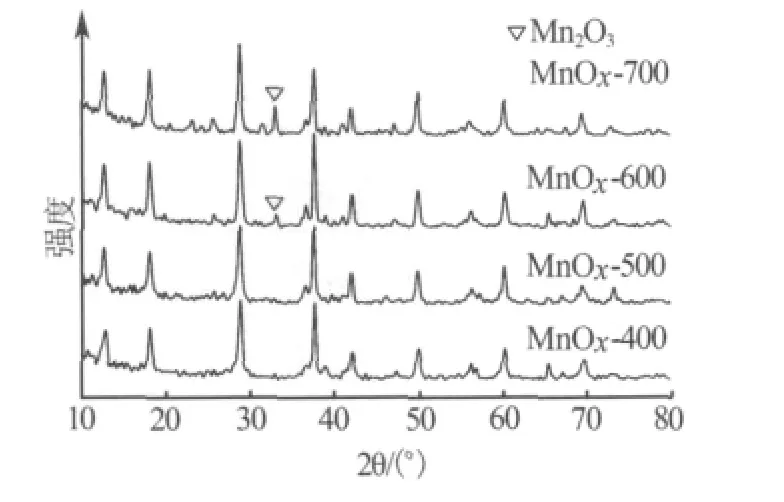
图1 不同锰氧化物的XRD谱图
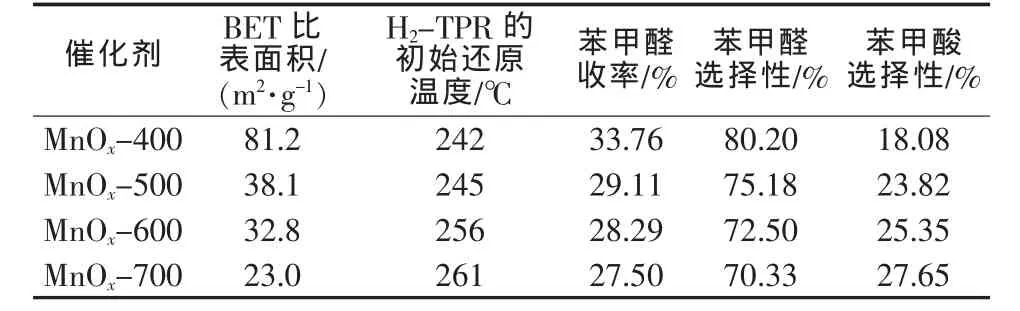
表1 不同锰氧化物对苯甲醇氧化反应结果的影响
2.2 不同锰氧化物的催化活性比较
在20 mL苯甲醇、20 mL TBHP、0.5 g催化剂、反应时间为2 h、反应温度为80℃的条件下,不同锰氧化物在苯甲醇氧化反应中的催化性能列于表1。从表1可以得出:随着焙烧温度的升高,苯甲醛收率逐渐降低,苯甲醛选择性逐渐降低,而苯甲酸选择性是逐渐增大的,其中MnOx-400(OMS-2)表现出较高的活性且对苯甲醛的收率(33.76%)最高,这可能与样品的初始还原温度[2]、晶相和比表面积有关。因此,下文均以OMS-2为催化剂,考察反应条件对苯甲醇选择氧化反应性能的影响。
2.3 反应条件的影响
2.3.1 不同氧化剂的影响
考察了不同氧化剂(H2O2、O2和 TBHP)对实验结果的影响,如图2所示。从图2可看出,以TBHP为氧化剂的反应,反应2 h后苯甲醛的收率可达33.76%,此时苯甲醛的选择性为80.2%。而在相同条件下O2和H2O2为氧化剂的苯甲醛收率仅分别为13.05%和0.77%,苯甲醛的选择性均为100%。随着反应时间的延长,TBHP为氧化剂的苯甲醛收率变化不大,其中反应3 h时苯甲醛收率(34.55%)最高;O2为氧化剂的苯甲醛收率缓慢地升高,反应10 h后,苯甲醛收率只有18.41%,而苯甲醛选择性仍然为100%;H2O2为氧化剂的苯甲醛收率和选择性基本不变。文献[8-10]报道用H2O2作为氧化剂,都能取得不错的效果,但是将H2O2用在该反应体系中,苯甲醛的收率却非常低,这可能是因为在OMS-2催化剂上H2O2分解太快,释放出的O2来不及参加反应,另一种可能是体系中水含量较多从而导致催化剂失活。综合考虑,选择TBHP作为氧化剂较为适宜。
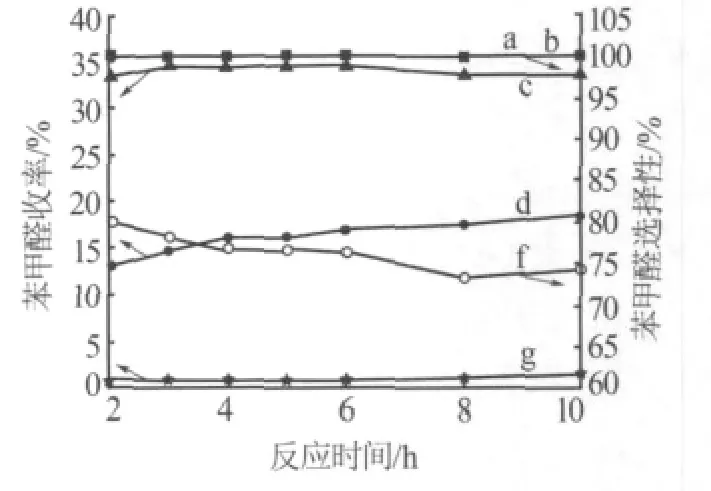
图2 不同氧化剂对反应的影响
2.3.2 反应时间的影响
考察了反应时间对实验结果的影响,如图3所示。从图3可看出,在该反应体系中,苯甲醇不仅液相氧化生成苯甲醛,还生成苯甲酸及苯甲酸苄酯等副产物。
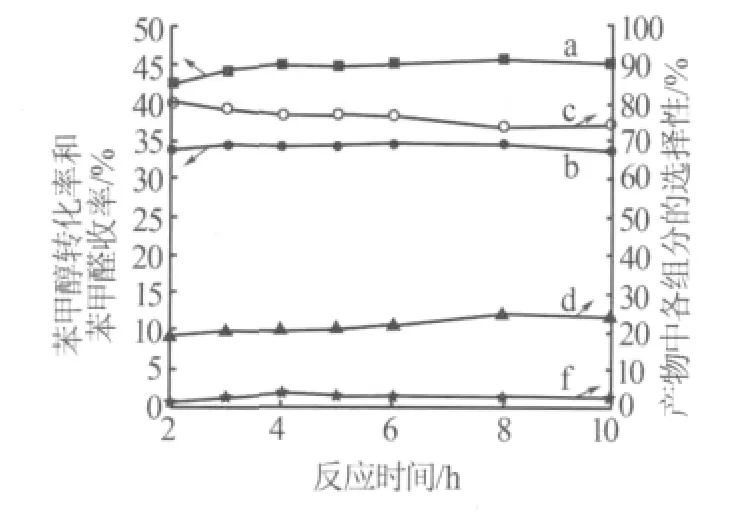
图3 反应时间对反应的影响
随着反应时间的延长,苯甲醇转化率逐渐提高;苯甲醛收率先升高后降低;苯甲醛选择性逐渐降低。虽然反应较复杂,但是不难看出,反应至4 h时,苯甲醇转化率为44.72%,此时苯甲醛收率为34.31%,苯甲醛选择性为76.74%;再反应2 h后,苯甲醛收率为34.52%,苯甲醛选择性为76.39%;再延长反应时间,苯甲醛收率和选择性明显降低,表明苯甲醇氧化反应是连续反应,其催化过程的连续反应如下:
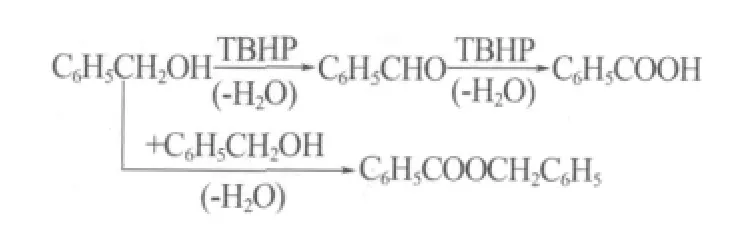
由此可见,延长反应时间同样导致苯甲醛发生深度氧化生成苯甲酸。随时间延长,苯甲酸选择性先升高后略微降低;苯甲酸苄酯选择性基本不变。综合考虑,反应4 h较为适宜。
2.3.3 反应温度的影响
考察了反应温度对实验结果的影响,如图4所示。从图4可看出,当温度为30~60℃时,苯甲醇的转化率和苯甲醛收率缓慢地增加,苯甲醛的选择性变化不大,均大于94%。当升高温度至80℃时,苯甲醇的转化率和苯甲醛收率迅速增加并达到最高,分别为44.72%和34.31%。但当反应体系温度高于80℃时,苯甲醇的转化率、苯甲醛收率和选择性都稍微下降,其原因可能是温度过高导致TBHP分解过快和生成的苯甲醛被进一步氧化为苯甲酸。综合考虑,反应温度为80℃较为适宜。
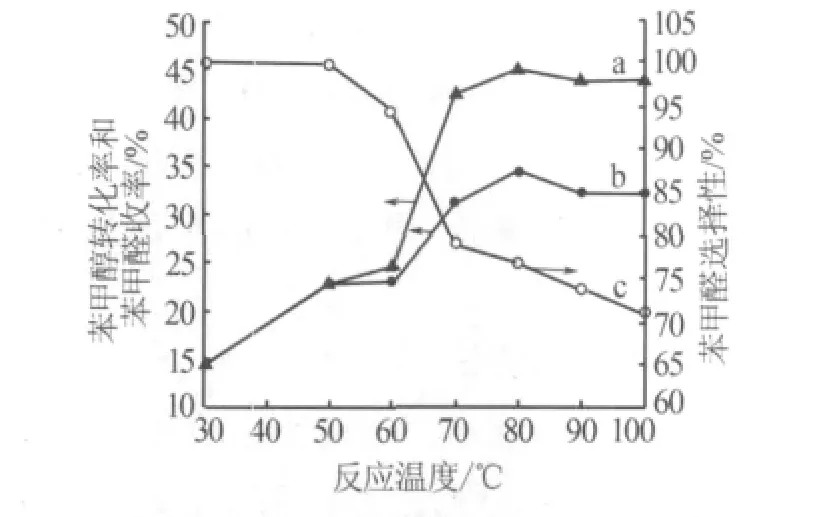
图4 反应温度对反应的影响
2.3.4 TBHP用量的影响
考察了TBHP用量对实验结果的影响,如图5所示。从图5可看出,当加入TBHP的量从0增加到20 mL时,苯甲醇的转化率和苯甲醛收率随之增大,苯甲醛的选择性下降;当TBHP的量继续增加时,苯甲醛收率和选择性均下降,这是由于苯甲醇的氧化反应首先是被氧化成苯甲醛,而过量的TBHP会使苯甲醛再氧化成苯甲酸。值得注意的是,未加入TBHP的反应,苯甲醛的收率和选择性分别为3.58%和100%,说明OMS-2的晶格氧能化学计量地与苯甲醇反应生成苯甲醛。考虑到苯甲醛的收率和选择性,可确定 V(苯甲醇)∶V(TBHP)=1∶1 较为适宜。
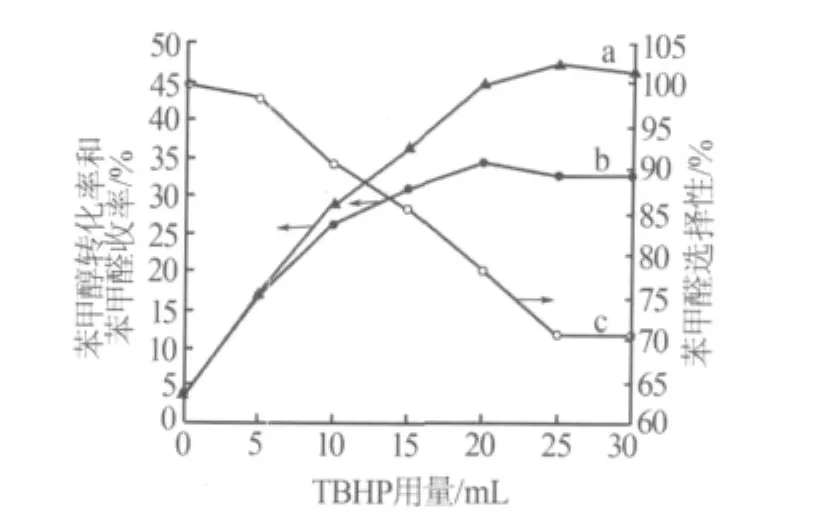
图5 TBHP用量对反应的影响
2.4 催化剂的重复使用性能
以OMS-2作催化剂,在优化的反应条件下考察催化剂的重复使用性能。用新鲜催化剂OMS-2时苯甲醛收率和选择性分别为34.31%和76.74%,经3次循环使用后苯甲醛收率和选择性分别为33.38%和74.75%,苯甲醛的收率和选择性稍微下降。实验结果表明,催化剂重复使用活性较好。
3 结论
该催化体系是在无溶剂、无卤素条件下进行,具有清洁、安全、简便等特点。在该体系中,不同氧化剂、反应时间、反应温度和TBHP用量等条件对反应有明显的影响,OMS-2作催化剂具有较高的苯甲醛收率和选择性,适宜的反应条件是:催化剂用量为0.5 g、V(苯甲醇)∶V(70%TBHP)=1∶1、反应温度为80℃、反应时间为4 h。催化剂循环使用活性较好。
[1]Suib S L.Structure,porosity,and redox in porous manganese oxide octahedral layer and molecular sieve materials [J].Journal of Materials Chemistry,2008,18:1623-1631.
[2]Hu Jing,Sun Keqiang,He Daiping,et al.Amorphous manganese oxide for catalytic aerobic oxidation of benzyl alcohol[J].Chinese Journal of Catalysis,2007,28(12):1025-1027.
[3]Makwana V D,Son Young-Chan,Howell A R,et al.The role of lattice oxygen in selective benzyl alcohol oxidation using OMS-2 catalyst:a kinetic and isotope-labeling study[J].Journalof Catalysis,2002,210(1): 46-52.
[4]Makwana V D,Garces L J,Liu Jia,et al.Selective oxidation of alcohols using octahedral molecular sieves:influence of synthesis method and property-activity relations[J].Catalysis Today,2003,85(2/3/4):225-233.
[5]Choudhary V R,Dumbre D K.Magnesium oxide supported nanogold:A highly active catalyst for solvent-free oxidation of benzyl alcohol to benzaldehyde by TBHP[J].Catalysis Communications,2009,10(13):1738-1742.
[6]Choudhary V R,Dumbre D K.Solvent-free selective oxidation of benzyl alcohol to benzaldehyde by tert-butyl hydroperoxide over U3O8-supported nano-gold catalysts[J].Applied Catalysis A:General,2010,375(2):252-257.
[7]唐幸福,黄秀敏,邵建军,等.氧化锰八面体分子筛纳米棒的合成及其催化甲醛低温氧化性能 [J].催化学报,2006,27(2):97-99.
[8]Biradar A V,Dongare M K,Umbarkar S B.Selective oxidation of aromaticprimaryalcoholsto aldehydesusingmolybdenum acetylide oxo-peroxo complex as catalyst[J].Tetrahedron Letters,2009,50(24):2885-2888.
[9]Yu Yuanyuan,Lu Bin,Wang Xiaoguang,et al.Highly selective oxidation of benzyl alcohol to benzaldehyde with hydrogen peroxide by biphasic catalysis[J].Chemical Engineering Journal,2010,162(2):738-742.
[10]Jia Aizhong,Lou Lanlan,Zhang Cui,et al.Selective oxidation of benzyl alcohol to benzaldehyde with hydrogen peroxide over alkali-treated ZSM-5 zeolite catalysts[J].Journal of Molecular Catalysis A:Chemical, 2009,306(1/2):123-129.
