一氧化碳还原硫酸镁制备氧化镁的工艺研究*
2013-10-17陈学安常新安肖卫强王少华
孙 冲,陈学安 ,常新安,肖卫强,王少华
(1.北京工业大学材料科学与工程学院,北京 100124;2.北京工业大学固体微结构与性能研究所;3.金川集团公司化工厂)
高纯氧化镁(纯度>99%),尤其是轻烧高纯氧化镁是制备高级碱性耐火材料、特种陶瓷等的原料[1]。传统制备高纯氧化镁的方法主要有卤水纯碱法、卤水碳铵法、卤水-石灰法、白云石碳化法、菱镁矿碳化法、镁盐直接热解法等[2-6]。其中,卤水纯碱法只适用于卤水、纯碱资源较丰富的地区;卤水碳铵法也受原材料是否能本地供给的限制,且能耗较高;卤水-石灰法以价格低廉的石灰作沉淀剂,成本相对较低,但盐湖水氯镁石溶液中往往含有SO42-、HCO3-、CO32-,它们和 Ca(OH)2反应形成沉淀而使氧化镁产品纯度降低,且氢氧化镁沉淀为絮状悬浮物过滤困难;白云石碳化法虽然成本较低,但生产的氧化镁产品中钙含量高;菱镁矿碳化法工艺路线复杂;而镁盐直接热解法存在加热温度高,能耗大,设备要求高等弊端。笔者用一氧化碳还原硫酸镁来制备高纯氧化镁,生产出符合HG/T 2573—2006《工业轻质氧化镁》的氧化镁产品。
1 实验部分
1.1 实验原理
根据化学热力学原理[7],对一般反应∑νiAi=0,

式中:Ai为反应物或生成物;νi为计量系数,反应物取“-”号,生成物取“+”号;T 为绝对温度;QT为温度T 时的反应熵;∑νiGf,T,i⊖为反应物或生成物在温度T时的标准摩尔吉布斯自由能;ΔGT⊖为化学反应在温度T时的标准摩尔吉布斯自由能;KT⊖为化学反应在温度T时的标准平衡常数;R为气体常数,8.314 J/(K·mol)。
MgSO4热解制备MgO可以采用一氧化碳还原硫酸镁、活性炭还原硫酸镁、硫酸镁直接分解等方式,其发生的反应如下:

根据热力学判据,只要 ΔGT<0,即 QT< KT⊖,反应就能正向自发进行直至平衡(QT=KT⊖)。对上述反应使用HSC5.0热力学软件进行计算,结果见图1。

图1 各反应热力学 lg(KT⊖/QT)-T 图
由图 1可见:反应(1)在 573.15 K 以上时lg(KT⊖/QT)=-ΔGT/(2.303RT)>0,即 ΔGT<0,反应就能进行。反应(2)在 773.15 K 以上时,ΔGT<0,反应能发生。 反应(3)在 1473.15 K 以上时 ΔGT<0,反应才能发生,且热焓△HT≫0,是个强吸热反应。因此,还原介质C或还原气氛CO的存在大大降低了MgSO4的分解温度和分解热耗。但是,即使是分析纯的活性炭也含有大约3%(质量分数)的硫酸盐杂质,用炭作还原剂得到的氧化镁产物中,硫酸根含量严重超标。最终选择一氧化碳作为还原剂,既降低了能耗又制得了高纯氧化镁产品。
1.2 试剂与仪器
试剂:无水硫酸镁(分析纯);一氧化碳(工业级,体积分数为99%)。
仪器:SGL-1200型高温管式炉;FA1004型电子分析天平;S-3400N型扫描电子显微镜;D8ADVANCE型X射线粉末衍射仪(Cu靶,扫描范围 2θ=10°~90°)。
1.3 实验过程
称取经严格筛分后的MgSO4样品5 g,置于Al2O3舟中,再将Al2O3舟置于管式炉,设定反应温度与反应时间并通入CO气体,气流量控制在0.1L/min,反应结束后称取产物质量,计算MgSO4的分解率,实验装置如图2所示。对所得产品进行粉末X射线衍射分析,将最佳工艺条件下得到的MgO通过SEM观测其形貌,并按照HG/T 2573—2006进行产品质量检验。

图2 实验装置图
2 结果与讨论
2.1 反应温度对无水硫酸镁分解率的影响
J.Plewa 等[8]报道CO与MgSO4反应生成 MgO的最低温度在大约873.15 K。因此,将实验的最低温度选定为873.15 K。当反应时间设定为30 min,硫酸镁粒径为106 μm时,反应温度对硫酸镁分解率的影响如图3所示。由图3可见:973.15 K以下,硫酸镁分解率随反应温度的升高而显著增大;973.15 K以上,硫酸镁的分解率基本保持不变。由此可以认为,973.15 K为无水硫酸镁完全分解的最佳温度。

图3 反应温度对无水硫酸镁分解率的影响
2.2 加热时间对无水硫酸镁分解率的影响

图4 加热时间对无水硫酸镁分解率的影响
当加热温度为973.15 K,硫酸镁粒径为106 μm时,热解时间对硫酸镁分解率的影响如图4所示。由图4可见:在10~30 min,随时间延长硫酸镁的分解率升高较快;当热解时间在30 min左右时,硫酸镁的分解率高于99%;继续延长时间,分解率缓慢升高。由此可以认为,无水硫酸镁完全分解的最佳加热时间为30 min。
2.3 样品粒径对无水硫酸镁分解率的影响
加热温度为973.15 K,热解时间为30 min时,粒径对硫酸镁分解率的影响如图5所示。由图5可见:随着硫酸镁粒径减小,硫酸镁的分解率逐渐增大;当粒径达到 106 μm 时,分解率为 99.3%; 继续减小粒径,分解率增幅放缓。因此,无水硫酸镁完全分解的最佳样品粒径为106 μm。

图5 粒径对无水硫酸镁分解率的影响
2.4 正交试验法确定硫酸镁分解的最佳条件
为了找出样品粒径、反应温度、加热时间对硫酸镁分解率的影响,在前期大量探索实验基础上,利用4因素3水平L9(34)正交试验法,进行了一氧化碳还原无水硫酸镁制备氧化镁的工艺条件优化研究。
表1为各因素和水平表,表2为正交试验设计表和相对应的硫酸镁分解率及实验结果的极差分析。由表2可知,粒径和时间对硫酸镁分解率总体上影响不大,影响硫酸镁分解率各因素重要顺序为:反应温度>加热时间>样品粒径,较优水平组合为A2B1C3。如前所述,当反应温度超过973.15 K,加热时间超过30 min之后,硫酸镁的分解率升高并不明显。考虑到能耗因素,最终选择A2B2C2组合进行实验,即:温度为 973.15 K,时间为 30 min,粒径为106 μm,此时 MgSO4的分解率达到 99.3%。

表1 正交试验因素水平表

表2 正交试验结果及极差分析表
2.5 最终氧化镁产品的检验结果
图6为CO在不同温度下热还原MgSO4时产物的XRD谱图及氧化镁(PDF45-0946)和无水硫酸镁(PDF21-0546)的标准粉末衍射谱图。由图6可见:873.15 K时,只有极少量MgSO4与CO反应生成MgO; 923.15 K 时,MgO 含量增加;973.15 K 时,产物的XRD峰位置和强度与氧化镁标准卡片(PDF45-0946)完全一致,说明产物是具有立方Fm-3m(No.225)晶体结构的氧化镁,a=0.42121(2)nm,Z=4。XRD谱图上未发现其他物质的衍射峰,表明得到的氧化镁纯度很高,晶型单一。
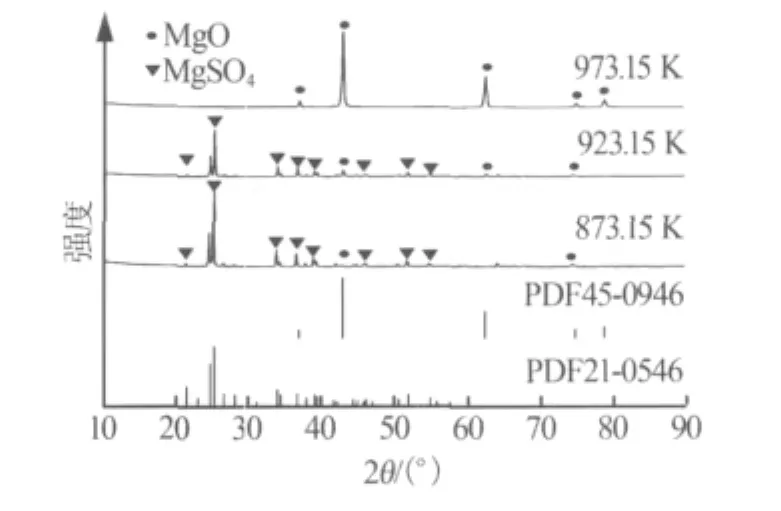
图6 不同温度下产物的XRD谱图
图7为按A2B2C2组合进行实验所得氧化镁的SEM图。由图7可见,氧化镁呈颗粒状,粒径分布在2~6 μm,其单分子表面为多孔蓬松状。

图7 氧化镁的SEM图
委托中海油天津化工研究设计院的国家无机盐产品质量监督检测中心对所得氧化镁进行产品质量检验。表3为产品质量检测对比报告。由表3可知,该产品符合HG/T 2573—2006规定的Ⅰ类优等品质量指标。

表3 所得氧化镁产品质量分析结果 %
3 结论
以CO为还原剂热还原MgSO4时,在较低的反应温度(973.15 K)就可以得到高纯MgO,且工艺简单,流程短。在相同热解时间下,硫酸镁的分解率随着反应温度的升高而增大;在相同温度下,硫酸镁的分解率随着反应时间的延长而升高,但反应进行30 min后,反应趋于完全,再延长时间对分解率影响不大;硫酸镁的分解率还与其粒径有关,随着粒径的减小,其分解率增大。当温度为973.15 K、热解时间为30 min、硫酸镁粒径为 106 μm时,分解率达到99.3%。
[1]许荣辉,李海民.高纯氧化镁制备原理初探[J].盐湖研究,2003,11(4): 39-41.
[2]张宏娟.高纯氧化镁的清洁生产工艺[D].山东:山东大学,2006.
[3]胡章文,王自友,杨保俊,等.高纯氧化镁制备工艺研究[J].安徽工程科技学院学报,2004,19(4):18-21.
[4]徐辉,刘卫平,杨喜云,等.以硫酸盐亚型盐湖卤水为原料制备高纯轻质氧化镁[J].中南大学学报:自然科学版,2011,42(8):2204-2208.
[5]张义勇,师敏,于雪峰,等.石灰石-苦卤法、氨法制备高纯镁砂工艺比较[J].无机盐工业,2011,43(1):45-47.
[6]张京京,冯雅丽,李浩然.硫酸镁直接热解制备氧化镁的研究[J].无机盐工业,2010,42(5):11-14.
[7]梁英教.物理化学[M].北京:冶金工业出版社,1998.
[8]Plewa J,Steindor J.Kinetics of reduction of magnesium sulfate by carbon oxide [J].Journal of Thermal Analysis,1987,32:1809-1820.
