PLLA/HA复合材料电纺丝覆膜气管支架的制作及力学性能的基础研究
2013-10-17马永富梁朝阳郭俊唐
马永富 刘 阳 梁朝阳 郭俊唐 张 涛
解放军总医院胸外科,北京 100853
组织工程研究,是将功能细胞种植于一种仿生细胞外基质的生物支架材料上,使其增殖与分化后植入机体组织,从而修复并再生病损组织。因此组织工程支架材料的结构和功能必须具有类似细胞外基质的作用,具有良好的生物相容性、可吸收性及较好力学性能[1]。目前研究表明,一种材料难以满足组织工程支架材料的要求,因此,不同材料之间的复合、改性及其性能研究是组织工程研究的重点[2-4]。
聚左旋乳酸(PLLA)和羟基磷灰石(HA)都是最常用的修复材料。PLLA是一种具有良好生物相容性和生物可降解性的聚合物,但也存在强度低、降解产物呈酸性导致局部炎症等缺点。HA是骨组织中主要的无机成分,但是其力学强度低,脆性大,抗折及抗冲击性能较差。将PLLA和HA复合,可以综合二者的优点,使材料在具有良好的生物降解性的同时具备较好的力学性能。
聚左旋乳酸/羟基磷灰石(PLLA/HA)复合材料支架目前被广泛研究,主要集中于复合材料的制备工艺及改性方面,以期获得更好的生物相容性及生物力学性能。在既往支架基础实验和临床应用的基础上[5-8],进行一种新型PLLA/HA复合材料电纺丝覆膜气管支架的研制。
1 资料与方法
1.1 一般资料
PLLA分子量为150 000,购自山东医用器械研究所;三氯甲烷溶液购自北京化工厂;HA购自清华大学核研所。
1.2 方法
1.2.1 可降解支架研制
1.2.1.1 支架的形状设计 利用三维设计软件Autodesk Inventor设计支架模型及模具(图1)。
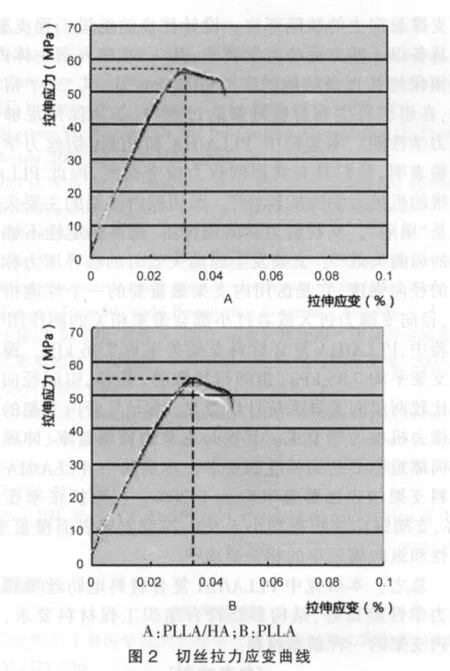
1.2.1.2 PLLA/HA和PLLA切丝力学比较 以三氯甲烷作为溶剂,一容器中加入4.0 g PLLA和1.0 g HA,体积浓度为10%(g/mL);另一容器中加入5 g PLLA,体积浓度为10%(g/mL)。恒温磁力搅拌24 h后形成悬浊溶液,倒入特制成膜器具后,鼓风干燥箱中放置48 h,挥发去除气泡,制成PLLA/HA和纯PLLA薄膜,切成横截面为1.0 mm×1.0 mm的细丝,每组3根切丝,切丝拉伸力学实验表明PLLA/HA和纯PLLA具有类似的拉力应变曲线(图2)。
1.2.1.3 支架制作 按照上述方法制成PLLA/HA薄膜,切成横截面为1.0 mm×1.0 mm的细丝。于模具上制成长度80 mm,直径分别为20~26 mm的支架。
1.2.1.4 PLLA/HA复合材料支架的电纺丝覆膜 ①PLLA/HA纺丝液的制备:以三氯甲烷为溶剂,按照上述方法,配置PLLA/HA纺丝液[体积浓度10%(g/mL)]。②纤维膜的制备:将纺丝液注入特制储液管容器中,固定在电纺丝装置一端,另一端连接光滑电极板,以20 000 V静电电压打开电源,调节电压,以特制模板收集纤维,得到电纺丝覆膜。覆盖支架主体后,形成PLLA/HA复合材料支架(图3)。④扫描电镜(SEM)分析微观形态及结构,观察电纺丝覆膜的的表面形态、孔径情况及其孔隙率(图4)。

1.2.2 PLLA/HA复合材料支架的机械力学性能
将支架放置在Zwick Z020型电子万能实验机力学测试装置中,压缩至所需直径后得到径向支撑力数据与国产镍钛合金支架(图5)进行比较。

1.3 统计学方法
应用SPSS 11.0软件包进行统计学处理,计量资料比较采用t检验,计数资料组间对比采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 径向支撑力测试结果
PLLA/HA复合材料支架压缩至相应直径13~19 mm,其径向支撑力测试结果见表1。径向支撑力:PLLA/HA复合材料支架平均为7.96 kPa,镍钛合金支架平均为7.85 kPa。组间行均数的t检验,径向支撑力比较,两组间差异无统计学意义(P=0.7 651>0.05)。
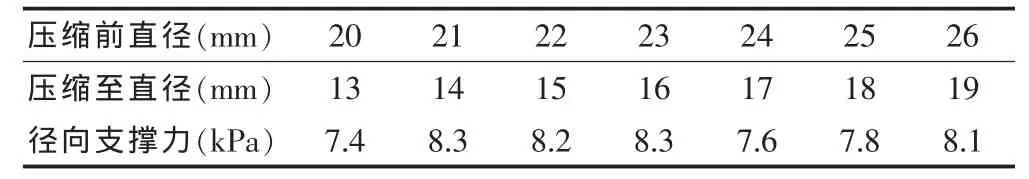
表1 PLLA/HA复合材料支架径向支撑力测试结果
2.2 表面覆盖率、支架轴向收缩率、支架扩张率
PLLA/HA复合材料支架表面覆盖率、支架轴向收缩率、支架扩张率测试结果见表2。

表2 复合材料支架表面覆盖率、支架轴向收缩率及支架扩张率测试结果
2.3 PLLA/HA复合材料电纺丝覆膜的扫描电镜观察及分析
扫描电镜观察可见电纺丝技术制备的PLLA/HA复合材料覆膜可以形成大小不同尺寸的孔,孔隙率较好。羟基磷灰石的加入使纤维直径增大且表面粗糙程度增加(图4)。
3 讨论
聚乳酸(PLA)是目前生物降解医用材料领域中最受重视的材料之一。因其于机体内具有无毒性、生物可降解性和良好的生物相容性,而被广泛应用于医用缝合线、骨修复材料、药物控制释放材料及人造皮肤材料的加工和制作[9]。PLA按照旋光性的不同,可分为左旋(PLLA)和右旋(PDLA)2个种类。由于生物体内都是左旋,所以医用材料一般都选用PLLA[10]。PLLA和PDLA皆为部分结晶高分子,在体内的讲降解过程中,由于PLLA的降解产物为L-乳酸,最终以二氧化碳和水的形式排出体外,被人体完全代谢,因此PLLA在医用领域的应用更具竞争力[11-12]。但PLLA在机体内的降解过程中,存在以下问题:因其本身呈疏水性,导致细胞亲和性差;PLLA在机体内缓慢降解过程中产生的局部弱酸性环境,引发机体炎症反应[13]。所以,实际应用中需要通过改性的方法来改善聚乳酸的降解性能及生物相容性,即通过分子设计合成以PLLA为主的各类共聚物或者复合物。如已有报道中提及,羟基磷灰石(HA)可被用于聚乳酸的改性处理[14-15]。HA富含人体组织所必需的钙和磷元素,是人体骨骼中的主要无机成分[16],因而它具备良好的生物容性及骨传导性。已有文献证明HA具有与羧基基团形成化学键的能力[17],可以缓冲PLLA的酸性降解产物导致的局部炎性反应[18],本研究复合HA于PLLA材料中,正是因为HA代谢过程中产生的弱碱性环境中和了PLLA的降解产物在局部产生的乳酸性产物,从而减少了无菌性炎症的发生概率[19-20]。
电纺丝技术,在组织工程复合材料制作领域中,是一项重要并且常用的工艺。其原理是在高压静电作用下,利用电场力克服聚合物或者复合材料溶液的表面张力,使之形成一股带电的喷射流,于收集装置上电纺丝纤维逐层随机分布,溶剂挥发后,形成无序排列的电纺丝纤维编织的覆膜。由于其纤维结构是取向不同的纤维交织而成,结合较弱,并且会形成不同尺寸的孔,而这些孔的大小及其孔隙率都会对支架的覆膜的性能产生重要的影响。目前组织工程复合材料孔的尺寸大多在20~100 nm[21]。而材料的孔隙率越高,就能够越大限度地为细胞提供生存空间,更好地起到细胞外基质的作用。而当体外培养的细胞进入孔内增殖与分化,能够推动周围的纤维以扩展空间,相应会提高复合材料的细胞渗透性[22]。在一项研究细胞增长的评价实验中,更发现电纺纤维的结构还很有利于促进细胞生长,并有效地促进细胞的接触和渗透[23]。本实验中,通过扫描电镜观察发现PLLA/HA复合材料电纺丝覆膜形成大小不同尺寸的孔,孔隙率较好。而HA的加入,更增加了纤维的直径和表面粗糙程度。这将十分利于种入其间的细胞在与周围环境良好交互的同时,还能很好地保持其自身结构,并沿着纤维不断地定向生长。所以,利用电纺丝技术生产的复合材料纤维,能够很好地仿生细胞外基质,具有良好的生物学性能。
在设计支架的过程中,支架的力学性能是在支架的材料、结构外另一个要考量的重要方面。因为支架的作用不只是为细胞提供生长的表面,更要具备良好的机械稳定性以支撑起宿主的缺陷部位。设计优良的组织工程支架,必须具备以下两方面的力学要求:其一,在植入宿主体内后,必须保持其自身结构的完整性和稳定性;其二,于宿主体内,在组织再生和材料降解的过程中,必须保持足够的机械力学性能。本实验中,PLLA/HA和PLLA切丝力学比较实验表明,他们具有类似的拉力应变曲线,因此PLLA/HA纤维的机械力学性能较好[24]。医用腔内支架的主要失效模式是“塌陷”。从材料力学的角度讲,就是稳定性不够而造成的屈曲失效[25]。支架发生屈曲失效时的临界压力称为支架的径向强度,它是医用内支架最重要的一个性能指标之一,径向支撑力过大或者过小都会带来相关的副作用[26]。本实验中,PLLA/HA复合材料支架为平均7.96 kPa,镍钛合金支架平均7.85 kPa。组间行均数的t检验,组间径向支撑力比较两组间差异无统计学意义。满足气管内支架的径向支撑力机械力学要求。其次是支架表面覆盖率、伸展性和纵向缩短率要达到相应的要求。本实验中,PLLA/HA复合材料支架的表面覆盖率均小于20%,支架扩张率在4%~6%,支架纵向缩短率均小于9%,符合支架表面覆盖率、伸展性和纵向缩短率的相关要求[27]。
总之,本研究中PLLA/HA复合材料电纺丝覆膜支架的力学性能良好,结构形态符合组织工程材料要求,是气管内支架的一种新型材料。
[1]Hutmacher DW.Scaffolds in tissue engineering bone and cartil age[J].Bio materials,2000,21(24):2529-2543.
[2]Wang M,Bonfield W.Chemically coupled hydroxyapatite polyethylene composites:structure and properties[J].Biomaterials,2001,22:1311-1320.
[3]Yasuhiko I.Reduction of surface induced in ammatory reaction on PLGA/MPC polymer blend[J].Biomaterials,2002,23:3897-3903.
[4]张超,胡蕴玉.羟基磷灰石/胶原聚乳酸三维多孔框架材料的制备成形及分析[J].中国生物医学工程学报,2004,5(23):439-442.
[5]Liu Y,Sun Y,Zhou NK,et al.Nitinol alloy endotracheal stent for treatment of tracheal stenosis[J].Chin Med J,1997,11(7):540-542.
[6]Liu Y,Sun Y,Zhou NK,et al.Nitinol alloy endotracheal stent in the treatment of trachest enosis:experimental study in a canine model[J].ELSA,1995,1(2):39-40.
[7]刘阳,孙玉鹗,黄孝迈,等.镍钛记忆合金支架治疗气管狭窄的实验研究及临床应用[J].中华外科杂志,1993,31(5):267-268.
[8]刘阳,孙玉鹗,黄孝迈,等.镍钛记忆合金支架气管腔内支架的治疗气管软化实验研究[J].中华胸心血管外科杂志,1995,11(4):233-234.
[9]张亚臣,荣烨之.医用聚乳酸的生物特性及其临床应用[J].上海医学,2005,28(1):79-80.
[10]崔福斋.可降解医用介入支架的研发进展[J].国外塑料,2005,23(11):58-64.
[11]Kulkarni RK,Pani KC,Neuman C,et al.Polylatic acid for surgical implants[J].Archs Surg,1966,6(3):839-843.
[12]Miller RA,Brady JM,Cutright DE.Degradation rates of oral resorbable implants(polylactates and polyglycolates):rate modification with changes in PLA/PGA copolymer ratios [J].J Biomed Mater Res,1977,11(5):711-719.
[13]宋存先.可降解与吸收材料—生物医用材料[M].天津:天津大学出版社,2000:50.
[14]Verheyen CCPM,Dhert WJA,Petit PLC,et al.In vitro study on the integrity of a hydroxyapatite coatingwhen challenged with staphylo-coc[J].J Biomed Mater Res,1993,27:775-781.
[15]Shikinamn Y,Hata K,Okunu M.Ultra-high-strength resorbable implantsmade from bioactive ceramic particles/polylactide composites[J].Biocramic Proc Int Symp Ceram Med,1996,9:391-394.
[16]Skavtsas VI.Biomaterials and bone mechanotransduction[J].Biomaterials,2001,22(19):2581-2593.
[17]Liu Q,Wijn JR,De Bakker D,et al.Polyacids as bonding agents in hydroxyapatite polyester-ether(polyactive TM 30/70)composites[J].J Mater Sci Mater Med,1998,9:23-30.
[18]Jones NL,Williams DF.Poly(L-lactide)and poly(L-lactide)-ceramic filled composites:a long term in vivo/in vitro degradation study[J].Toronto:Trans.5th world Biomaterials Congress,1996:441.
[19]史国齐,陈元维,秦滢杰,等.D,L-聚乳酸降解产物对内皮细胞生长影响的体外实验[J].中国组织工程研究与临床康复,2007,11(26):5086-5089.
[20]Aunoble S,Clément D,Frayssinet P,et al.Biological performance of a new beta-TCP/PLLA composite material for applications in spine surgery:in vitro and in vivo studies[J].J Biomed Mater Res A,2006,78(2):416-422.
[21]Zhao DM,Wang YX,Yu DS,et al.Composition graded films of flroroapatiteP/PHBfabricated via electrospinning for tissue engineering[J].Journal of Bioactive and Compatible Polymers,2007,22(4):379-393.
[22]Martins A,Araujo JV,Reis RL,et al.Electrospun nanostructured scaffolds for tissue engineering applications[J].Nanomedicine,2007,2(6):929-942.
[23]Yoshimoto H,Shin YM.A biodegradable nanofiber scaffold by electrospinning and its potential for bone tissue engineering[J].Biomaterials,2003,24(12):2077-2082.
[24]Caraccio N,Cuccato S,Pratesi F,et al.Effect of type Ⅰ interferon on cell viability and apoptosis in primary human thyrocyte cultures[J].Thyroid,2009,19(2):149-155.
[25]吴莲元.板壳理论[M].上海:上海交通大学出版社,1989.
[26]Kim YH,Park SW,Lee CW.Conparision of Sirolimus-eluting stent,paclitaxel-eluting stent,and bare mental stent in the trachea of long coronary lesions[J].Catheterization and Cardiovascular Intervengions,2006,67:181-187.
[27]崔福斋.可降解医用介入支架的研发进展[J].国外塑料,2005,23(11):58-64.
