哈茨木霉对7种植物病原菌的生防机制研究
2013-10-16郎剑锋孔凡彬石明旺杨洪生
郎剑锋,孔凡彬,石明旺,杨洪生
(河南科技学院,河南新乡453003)
木霉是一类在土壤环境中普遍存在且具有生防特性的微生物.目前研究证明,木霉可寄生18个属的29种植物病原菌[1].具有抗逆性强、生长速度快、孢子存活期长、对病原菌具有较强的重寄生作用、对环境影响小,以及不易使病原菌产生抗性等特点,可促进植物生长、控制病害发生.木霉的研究已有很长历史,早在20世纪30年代,人们就发现木霉菌对植物病原菌有拮抗作用.20世纪70年代以来,国内外大量工作者对木霉菌的拮抗作用机制作了许多深入研究,报道了很多木霉菌作为生防制剂的研究进展,证实了木霉菌对病原菌的多种作用机制,同时在温室及田间试验中也取得了较好的效果.Harman等[2]用木霉菌处理水稻种子并接种稻瘟病菌或白叶枯病菌,使水稻幼苗过氧化物酶及苯丙氨酸解氨酶活性增强,在某一时段显著高于未经木霉处理的对照.Trichoderma harzianum的内切几丁质酶和水解酶的协同作用可抑制灰葡萄孢孢子的萌发[3].木霉菌能有效抑制辣椒白绢病和油菜菌核病病斑增长,控制病菌蔓延,而且促进菌核的腐烂,减少菌核形成[4].现在市场上已经有不少商品化的木霉制剂,木霉在农业生产中正发挥出越来越大的作用.
本研究以从土壤上分离到的一株木霉菌,测定其对7种植物病原菌的抑制作用,明确哈茨木霉对病原菌的作用机制,以期为今后生防制剂的制备打下基础.
1 材料与方法
1.1 试验材料
试验所用哈茨木霉Trichoderma harzianum及7种植物病原菌小麦纹枯病菌Rhizoctonia cerealis、玉米纹枯病菌Rhizoctonia spp.、西瓜枯萎病菌Fusarium oxysporum f.sp.cucmrium、水稻纹枯病菌Rhizoctorzia solani、蒜苔炭疽病菌Colletotrichum gloeosporioides Penz.、水稻恶苗病菌Fusarium moniliforme Sheld、小麦根腐病菌Bipolaris shoemaker均由河南科技学院资源与环境学院植物病理实验室提供.
1.2 试验方法
1.2.1 哈茨木霉对7种病原菌的抑菌作用 试验采用对峙培养方法[5],活化好的各供试病原菌和供试哈茨木霉菌置于28℃黑暗条件下培养3 d.用打孔器(D=5 mm)沿菌落边缘打菌饼(打过不同菌种后用乙醇清洗打孔器,酒精灯火焰灼烧,降至室温).用接种针将木霉菌与病原菌菌饼分别接种于PDA平板培养基距离中心1 cm处同一直线上的两点上,每皿1个病原菌菌饼和1个木霉菌菌饼.同时设只接病原菌和哈茨木霉菌的平板作为对照,每处理重复3次[6-7].28℃恒温培养,逐日观察菌落的生长和哈茨木霉菌抑制作用效果,测量处理病原菌和对照病原菌菌落半径,计算抑制率.抑制率的计算公式为:

接菌方法与测量时间根据病原菌菌丝生长速度确定.木霉菌丝生长较快,部分病原菌菌丝生长较慢.水稻恶苗病菌、水稻纹枯病菌、西瓜枯萎病菌、蒜苔炭疽病菌、小麦根腐病菌为先接种病原菌,待3 d后接种木霉拮抗菌,第5天测量菌落大小;小麦纹枯病菌与木霉菌同时接种,第3天测量菌落大小.接种病原菌为生长旺盛的菌株,木霉为生长2 d的菌株.
1.2.2 木霉菌丝提取物对7种病原菌的抑菌作用 取实验室PDA培养基28℃黑暗条件下培养3 d的木霉菌株1皿,用50 m L无菌水浸泡洗下菌丝体.浸泡3 h后将液体分装入离心管,离心得到其粗提液.粗提液用细菌过滤器过滤后,即为木霉菌丝提取物.将提取物加入PDA培养基混匀(按照提取液∶PDA培养基=1∶9比例),即为含木霉菌丝提取物培养基.培养基倒为平板,待冷却硬化后接种直径为0.5 mm病原菌菌饼,以加无菌水培养基的平板为对照(无菌水∶PDA培养基=1∶9),3次重复.置于28℃恒温培养箱中培养,逐日观察菌落直径,连续观察3 d,计算抑制率[8].
1.2.3 哈茨木霉对小麦纹枯病菌重寄生作用的观察 在PDA培养基中央放置1块20 mm×20 mm无菌盖玻片.在左侧距盖玻片40 mm处接种木霉菌,右侧距盖玻片20 mm处接种病原真菌.28℃恒温培养,
逐日观察.待木霉菌丝与病原菌菌丝相接触后取下盖玻片,倒扣于载玻片上,在光学显微镜下观察木霉菌与病原菌的菌丝体作用方式[9].
2 结果与分析
2.1 哈茨木霉对7种病原菌的抑菌作用
哈茨木霉对7种植物病原菌的抑菌效果见表1.
由表1可知,哈茨木霉对表中7种病原菌均有抑制作用,其中对西瓜枯萎病菌的抑制率最高,可达44.3%;对水稻恶苗病菌抑制率次之,为41.2%;对玉米纹枯病菌抑制率为40%;对小麦根腐病菌抑制率最低,为13.4%.

表1 哈茨木霉对7种病原菌的抑菌作用Tab.1 Inhibition of Trichoderma harzianum on seven pathogens
哈茨木霉与病原菌平板对峙过程中,哈茨木霉菌丝迅速扩展,包围病原菌菌落,占领生存空间,与病原菌菌丝接触后强烈抑制病原菌的菌丝生长,病原菌菌丝停止生长且菌丝变黄褐色,供试病原菌的菌落逐渐被哈茨木霉菌落覆盖,哈茨木霉菌丝扩展至全皿,并在病原菌菌落上产生大量绿色分生孢子.
2.2 哈茨木霉菌丝提取物对7种病原菌的抑菌作用
哈茨木霉菌丝提取物对7种植物病原菌的抑菌效果见表2.
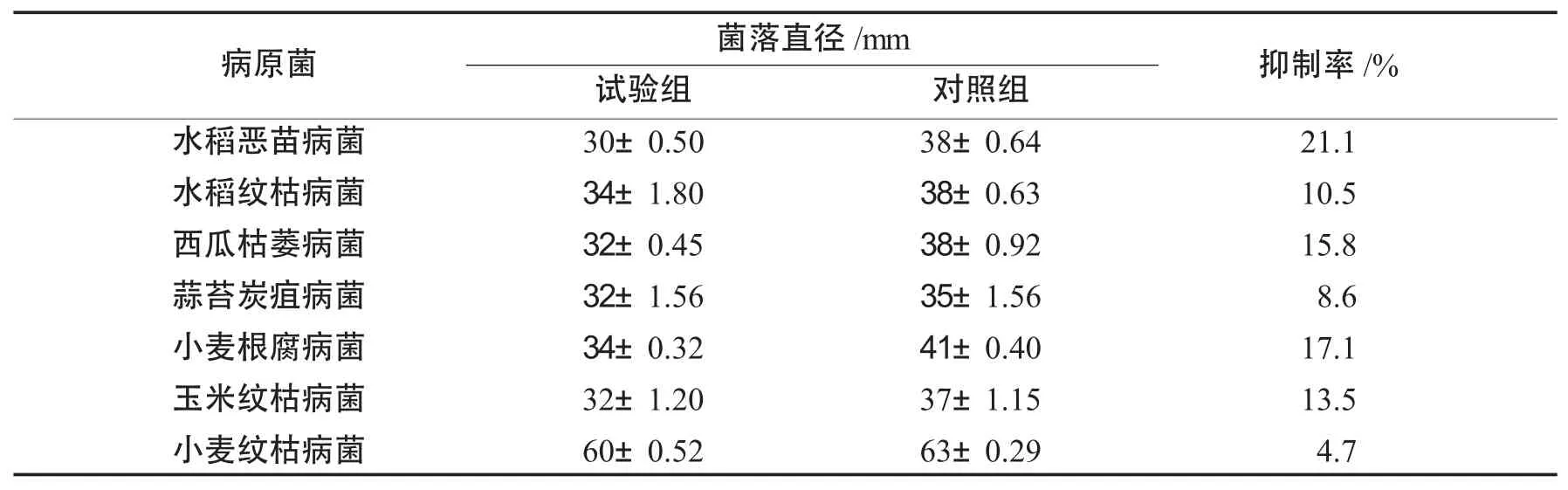
表2 哈茨木霉菌丝提取物对7种病原菌的抑菌作用Tab.2 Inhibition of mycelia extract of Trichoderma harzianum on seven pathogens
由表2可知,哈茨木霉菌丝提取物对7种病原菌均有抑制作用,其中对水稻恶苗病菌抑制效果最为明显,对小麦根腐病菌抑制效果次之,对小麦纹枯病菌抑制效果较差.数据表明木霉菌丝中含有可以抑制病原菌生长的物质,但是对不同病原菌的作用效果不同.
2.3 哈茨木霉对小麦纹枯病菌重寄生作用的观察
哈茨木霉对小麦纹枯病菌重寄生作用的光学显微观察结果见图1.

图1 哈茨木霉菌丝与病原菌菌丝作用方式Fig.1 Mode action of mycelia of Trichoderma harzianum against Rhizoctonia cerealis
由图1可知,显微镜下观察到哈茨木霉菌丝与小麦纹枯病菌菌丝接触后,哈茨木霉菌菌丝以缠绕、穿插、紧贴等方式寄生在小麦纹枯病菌菌丝上(见图1中箭头所指的圆圈处所示),使得病原菌的菌丝变形,同时产生分生孢子,木霉菌丝通过侵入到病原菌的菌丝内吸收其营养,造成病原菌菌丝的断裂、解体.
3 小结与讨论
本试验研究了哈茨木霉对7种病原菌的拮抗作用机制,试验结果表明,木霉对该7种病原菌均有不同程度的抑制作用.对大多数病原菌的抑制率能达到25%以上,对西瓜枯萎病菌的平均抑制率最高,可达44.3%.木霉菌丝粗提物对病原菌的生长具有一定的抑制作用,但普遍抑制率较低.哈茨木霉菌对病原菌的作用方式之一是争夺营养和生长空间.木霉菌较病原菌对环境的适应性强,且生命力顽强,生长速度更快,能够快速抢占生长的空间,利用病原菌菌丝体营养物质作为起点,吸收营养,从而抢占病原菌的入侵位点,阻碍病原菌的发展蔓延.由木霉与小麦纹枯病菌的相互作用发现,木霉的菌丝发达,可以缠绕到病原菌菌丝上,吸取病原菌体内的营养物质,对病原菌形成重寄生作用,分解病原菌,致使病原寄主死亡,这和以往的研究结果是一致的[8-10].此株木霉抑菌具有广谱性,能对多种病原菌产生作用,是一种理想的、难得的生防资源.后期可对其进行诱变选育,试验其在田间应用情况和是否可以诱导植株产生抗病性.
[1]胡琼.木霉对植物促生作用的研究进展[J].北方园艺,2010(7):197-200.
[2]Harman G E,Howell C R,Viterbo A,et al.Trichoderma species-opportunistic,avirulent plant symbionts[J].Nature Reviews Micobiology,2004,2:43-56.
[3]Howell C R.Mechanisms employed by Trichoderma species in the biological control ofplant diseases:the history and evolution of current concepts[J].Plant Disease,2003,87(1):4-10.
[4]姚元枝.木霉菌防治油菜菌核病和辣椒白绢病的研究[J].怀化师专学报,1997,16(6):67-69.
[5]王伟东,高亚梅.哈茨木霉对几种病原菌的拮抗作用及液体产孢培养条件的研究[J].黑龙江八一农垦大学学报,2010,22(6):4-8.
[6]袁佐清.土壤中木霉的分离纯化以及对植物病原真菌的拮抗研究[J].西北农业学报,2006,15(5):132-135.
[7]张风革.木霉对土传病害的生防机制及其应用前景[J].吉林农业,2009(8):68.
[8]宋晓妍,陈秀兰.棉花黄萎病菌拮抗木霉的筛选及其抑菌机制的研究[J].山东大学学报,2005,40(6):98-102.
[9]滕安娜.生防木霉拮抗黄瓜枯萎病菌的初步研究[J].现代农业科技,2010(1):159.
[10]管怀骥,陈莉.哈茨木霉TH-1菌株对小麦纹枯病的控制效果研究[J].安徽农业科学,201l,39(16):9664-9665.
