分枝杆菌转化甾醇产9α-羟基雄甾烯酮促进剂的筛选
2013-10-15张怀成王风清马昱澍魏东芝
张怀成,王风清,马昱澍,魏东芝
(华东理工大学 生物反应器国家重点实验室 鲁华生物技术研究所,上海200237)
自然界中存在着以胆固醇及其类似物和相关衍生物为代表的一大类化合物,即甾体化合物。这类化合物以环戊烷多氢菲为母核,携带不同修饰基团。由于其母核上不同位置的不同取代基,往往表现出显著不同的生理活性[1],对大脑的发育、稳态维持等生理机能的调控至关重要。甾体药物主要是甾体激素类药物以及甾体型抗生素,如胆酸、雌二醇、雄酮、烟曲霉酸、夫西地酸等[2]。
甾体药物的合成,目前较成熟的商业应用工艺是利用薯蓣皂素(Diosgenin)经化学修饰成16-醋酸双烯醇酮后进一步合成得到,但该工艺存在成本高、步骤多、收率低、经济性差、环境友好度低、土地资源和自然资源浪费大等不足[3]。相较而言,甾体药物的半合成制备,即利用天然甾体作为骨架进行结构改造更具优势。其中以甾醇为原料、利用分枝杆菌等微生物转化生产甾体医药中间体9α-羟基雄甾烯酮(9α-OHAD),是目前甾体医药工业体系的一条重要工艺路线。然而甾醇水溶性差、传质效率低、底物毒害、产物抑制以及产物降解等问题均制约着微生物菌株转化能力的提高,也是影响该工艺推广应用的重要瓶颈[3]。
甾醇为非极性化合物,在水中的溶解度极低,仅约1μmol·L-1左右,且甾醇在水相中的传质效率很低,其生物可利用度不高,严重制约了分枝杆菌对甾醇底物的摄取利用效率[4]。研究表明,环糊精、硅油、聚丙二醇(PPG)、聚乙二醇(PEG)、离子溶液(Ionic liquids)、邻苯二甲酸二辛酯(DOP)、有机试剂(如甲醇、乙醇、丙酮)等均能有效促进微生物对甾醇的转化,可显著提高目标产物的积累量[5,6]。目前,PEG、PPG、硅油作为甾醇转化促进剂的相关研究备受关注[5,7,8],但研究多局限于对有机溶剂、离子溶液、硅油等大类别的探究,而系统的、细致的应用性研究很少。基于此,作者在此就PEG200、PPG2000和多种硅油对分枝杆菌HK86转化甾醇产9α-OHAD的促进效果进行了比较分析,以期筛选到优良的甾醇转化促进剂。
1 实验
1.1 菌株
新金分枝杆菌 HK86(Mycobacterium neoaurum HK86),自行保存。
1.2 培养基及各类配制溶液
种子培养基(MYC/01):柠檬酸2g·L-1,甘油20g·L-1,K2HPO40.5g·L-1,柠檬酸铁铵0.05g·L-1,MgSO4·7H2O 0.5g·L-1,NH4NO32g·L-1,加1L去离子水,用NaOH溶液调pH值至8.0。
种子固体培养基(MYC/01S):以种子培养基(MYC/01)为基础,添加1%琼脂粉。
发酵培养基(MYC/02):葡萄糖10g·L-1,柠檬酸2g·L-1,K2HPO40.5g·L-1,柠檬酸铁铵0.05g·L-1,MgSO4·7H2O 0.5g·L-1,(NH4)2HPO43.5g·L-1,加1L去离子水,用NaOH溶液调pH值至7.0,添加设计浓度的甾醇。
甾醇母液(200g·L-1):20g植物甾醇,添加5g吐温-80,加热溶解并定容至100mL,700W下超声99次(每次超声5s、间隔5s),4℃保存。
卡那霉素(Kanamycin)溶液:称取1g卡那霉素溶解于10mL水中,将其配制成100mg·mL-1的母液,用0.22μm过滤器过滤除菌,而后按每管1mL分装成小份,-20℃保存备用。工作液浓度为母液稀释2000倍,即50μg·mL-1。
1.3 菌种保藏
菌株培养至OD600为2~3,甘油终浓度20%,于-40℃冻存。
1.4 方法
1.4.1 菌体的培养与甾醇转化
在MYC/01S上涂布活化分枝杆菌HK86,挑取单菌落转接至装有MYC/01的5mL试管中进行种子一级活化,加入抗性(50μg·mL-1卡那霉素),培养5d左右至菌体呈亮黄色;而后以7%接种量将一级活化种子液转接到装有 MYC/01的摇瓶中(30mL/250 mL)进行二级活化,抗性添加同上,于30℃、200r·min-1培养活化3~4d至菌体呈淡黄色;再将二级活化种子液以10%的接种量转接至装有MYC/02的摇瓶中(30mL/250mL,底物浓度为10g·L-1),并以拟定添加方式和添加量加入甾醇转化促进剂,于30℃、200r·min-1培养7d。最后萃取产物,进行定性和定量分析,评价各实验组菌株对底物的转化能力,并将其与对照组(加入等量的无菌水)相比较。
1.4.2 底物甾醇与产物9α-OHAD的分析
1.4.2.1 样品制备
将发酵转化液用乙酸乙酯以1∶1萃取2次,合并萃取液,减压干燥后备用。
1.4.2.2 薄层层析(TLC)分析
实验准备:层析液流动相为石油醚-乙酸乙酯(6∶4,体积比);层析硅胶G/L板规格为5cm×10cm,于点样端后0.5cm处铅笔均匀标记以便进行结果的横向分析,而后将其于100℃烘烤10min,备用;展层剂先加至层析缸中饱和30min左右;样品用乙酸乙酯萃取或复溶。
样品点板层析:用10μL移液枪分别吸取样品10μL于各铅笔标记处点样,点样间距约0.5~1cm;点样方式:多次少量,尽量缩小点样面积。
层析:将层析液倒入层析缸进行饱和,然后将点样后的TLC薄板斜置于层析缸内,待展层剂扩散至薄板上端后,取出薄板,用吹风机吹干,置于254nm紫外下观察斑点,并初步判断转化水平。
显色:将上一步骤处理后的TLC薄板用20%稀硫酸均匀喷淋,用干纸巾擦拭薄板背面残液,之后将其置于110℃烘箱内烘烤15min左右,使底物和各组分产物、副产物充分显色,并进行定性分析。
1.4.2.3 高效液相色谱(HPLC)分析
样品处理:转化发酵液用乙酸乙酯以1∶1萃取,12 000r·min-1离心3min;取100μL含有产物的上清液置于洁净的1.5mL EP管中,置于通风橱中至乙酸乙酯挥发殆尽;而后加入10倍(1000μL)色谱级甲醇复溶(即将样品稀释10倍进行检测)。
检测参数:Agilent 1100型高效液相色谱仪;DAD紫外检测器,波长254nm;柱温40℃;进样量5μL;流速1mL·min-1;流动相为甲醇∶水(7∶3,体积比);Agilent XDB-C18色谱柱(4.6mm×250mm)。
2 结果与讨论
2.1 甾醇转化促进效果比较
选择PEG200、PPG2000和二甲基硅油作为甾醇转化促进剂,在发酵培养48h时添加,添加浓度均为5%,考察不同转化促进剂对甾醇转化的促进作用,结果见图1。

图1 PEG200、PPG2000和二甲基硅油对甾醇转化的促进作用Fig.1 Promotion effect of PEG200,PPG2000and dimethyl silicone oil on the transformation of sterol to 9α-OHAD
由图1可知,PEG200、PPG2000和二甲基硅油的加入均能在一定程度上促进菌株对底物甾醇的转化能力,产物9α-OHAD的积累量分别提高了50%、85%和95%,其中二甲基硅油的促进效果最显著。因此,后续研究进一步考察多种硅油对甾醇转化的促进效果。
2.2 甾醇转化促进剂的筛选
基于硅油对微生物转化甾醇具有显著促进作用,对7种不同规格的硅油进行了更为系统、细致的分析,不同硅油对甾醇转化的影响见图2。
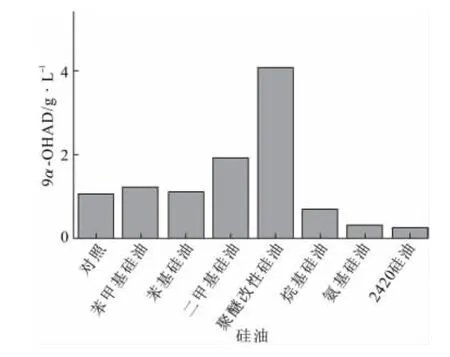
图2 不同硅油对甾醇转化的影响Fig.2 Effect of different silicone oils on the transformation of sterol to 9α-OHAD
由图2可知,苯甲基硅油、苯基硅油、二甲基硅油和聚醚改性硅油对甾醇的转化均有不同程度的促进作用,尤其是聚醚改性硅油,产物积累量提高了近300%;而烷基硅油、氨基硅油和2420硅油则相反,对甾醇转化有比较明显的抑制作用,其中2420硅油对甾醇转化的抑制最为严重。这表明并非所有硅油都会对甾醇的转化起促进作用,这一点在相关文献[5,7,8]中未指明。
随后考察了硅油添加量对甾醇转化的影响,结果见图3。
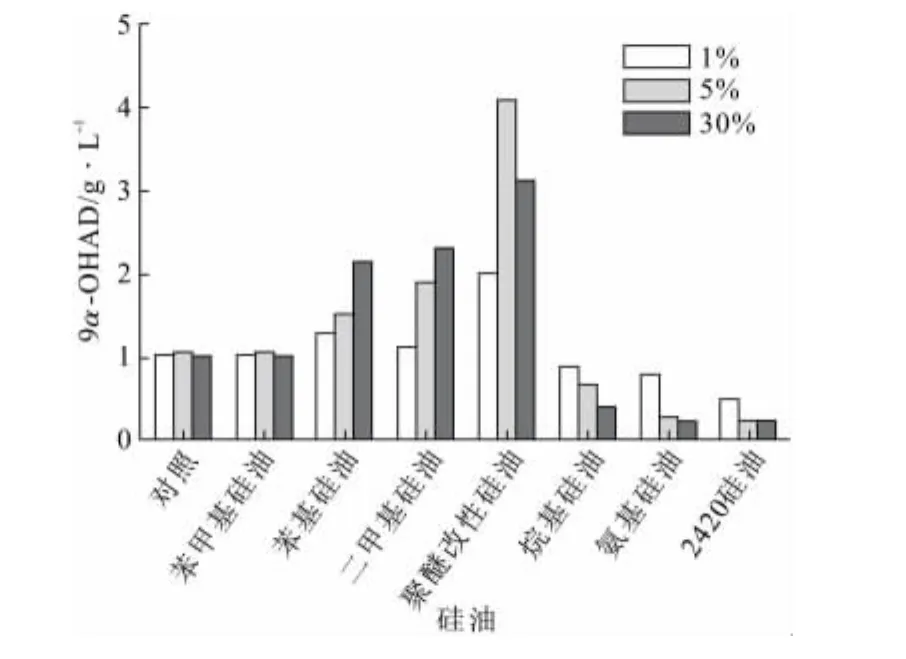
图3 硅油添加量对甾醇转化的影响Fig.3 Effect of addition amount of silicon oil on the transformation of sterol to 9α-OHAD
由图3可知:总体上,具有正面促进作用的硅油,其添加30%的效果略好于添加1%和5%时的效果,但对于聚醚改性硅油来讲,添加5%的效果却要优于添加30%的效果,转化率高出20%左右。经过对各规格硅油的1%、5%和30%三个不同添加量的转化分析比较,更加确认了聚醚改性硅油在微生物甾醇转化上的突出表现,排除了由于促进剂非最优浓度导致促进效果有限而造成的对最佳促进剂选择的干扰。同时,由图3还可知聚醚改性硅油拥有较低的最佳添加浓度,更有生产应用价值。综上所述,选择聚醚改性硅油为最佳甾醇转化促进剂。
2.3 聚醚改性硅油添加量和添加方式的优化
进一步考察聚醚改性硅油添加量对甾醇转化的影响,结果见图4。
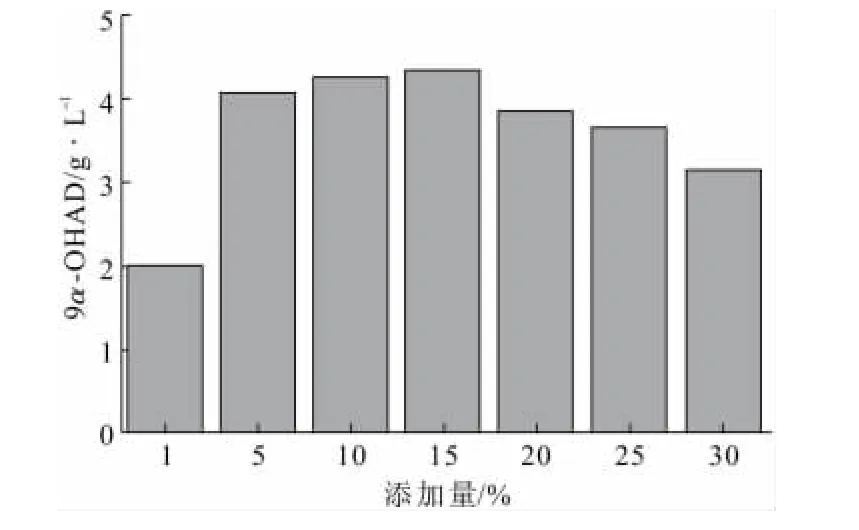
图4 聚醚改性硅油添加量对甾醇转化的影响Fig.4 Effect of addition amount of polyether-modified silicone oil on the transformation of sterol to 9α-OHAD
由图4可知,聚醚改性硅油在底物甾醇投料量为10g·L-1的条件下,最佳添加量为15%。
进一步对聚醚改性硅油的添加方式进行考察发现:聚醚改性硅油在第0d添加(即与菌种转接同时直接添加)、第1d添加和第2d添加的实验结果差别不大,没有显著的优劣之分。同时,聚醚改性硅油在115℃下保持30min后,其对甾醇转化的促进作用也未出现显著差别,这表明聚醚改性硅油具有一定的耐高温特性。鉴于此,为了操作方便,同时避免添加聚醚改性硅油时可能产生的不必要染菌,选择在配制发酵培养基时同时加入聚醚改性硅油和甾醇,灭菌后使用。
3 结论
PEG200、PPG2000和二甲基硅油的加入均能在一定程度上促进分枝杆菌HK86对底物甾醇的转化能力,提高产物9α-OHAD的积累量。最终筛选到的最佳甾醇转化促进剂是聚醚改性硅油,其最佳添加方式是在发酵起始时与甾醇同时添加,10g·L-1的甾醇投料量下的最佳添加量为15%。
[1]Murray H C,Hickory C,Peterson D H.Oxygenation of steroids by Muoorales fungi[P].USP 2 602 769A,1952-07-08.
[2]王风清.利用分枝杆菌降解植物甾醇生产雄甾烯酮的研究[D].天津:天津科技大学,2003.
[3]Donova M V,Egorova O V.Microbial steroid transformations:Current state and prospects[J].Applied Microbiology and Biotechnology,2012,94(6):1423-1447.
[4]Malaviya A,Gomes J.Androstenedione production by biotransformation of phytosterols[J].Bioresource Technology,2008,99(15):6725-6737.
[5]Marques M P C,Carvalho F,de Carvalho C C C R,et al.Steroid bioconversion:Towards green processes[J].Food and Bioproducts Processing,2010,88(1):12-20.
[6]魏琦,熊志刚,冀志霞,等.微生物转化雄甾-4-烯-3,17-双酮的菌种筛选和转化条件的初步研究[J].微生物学通报,2007,34(6):1134-1137.
[7]Stefanov S,Yankov D,Beschko V.Biotransformation of phytosterols to androstenedione in two phase water-oil systems[J].Chemical and Biochemical Engineering Quarterly,2006,20(4):421-427.
[8]Fernandes P,Marques M,Cabral J M S.Towards fastened development and optimization of production processes anchored in biologicals[J].2010BERG Annual Report,Research Highlights,2010:30-31.
