214型离子交换树脂固定化假丝酵母脂肪酶的研究
2013-10-14钱俊青蒋盛蓝秦德怀凌春英
钱俊青,蒋盛蓝,秦德怀,郭 辉,凌春英
(浙江工业大学 药学院,浙江 杭州310032)
大豆油精制副产物脱臭馏出物是提取天然维生素E的良好原料.但维生素E和脂肪酸、甘油三酯、甾醇等以混溶的形式存在于馏出物中,分离困难.国内外许多学者对从脱臭馏出物中提取天然维生素E做了大量的研究和探讨,到目前为止,这些工艺主要有:尿素络合法、简单溶剂萃取法、皂化法、酸催化酯化蒸馏法、超临界萃取法[1].目前,生产上常用的这些方法中溶剂用量大对环境有破坏,对天然维生素E的功能也会产生影响.而酶法预处理主要是利用脂肪酶将游离脂肪酸甲酯化后将其与维生素E脱除[2],这是更为理想的方法.假丝酵母脂肪酶在提取天然维生素E的预处理中良好的催化性能已引起了广泛关注.但是在预处理过程中,脂肪酶会水解甘油三酯产生新的脂肪酸,增加维生素E分离难度.如能降低水解能力,保持酯化能力,将大大有利于天然维生素E的纯化预处理.
树脂交换吸附法固定化酶是一种简单的酶固定化方法,这种方法成本低,操作简单,固定化条件温和,可再生,固定的酶活力高.固定的脂肪酶在有机介质中有着比在水相中更好的稳定性,并且树脂交换吸附法在一定程度上可以改变酶的催化性能[3-8].对6种树脂在固定化假丝酵母脂肪酶中应用的效果进行比较后发现,214型离子交换树脂固定化酶后,酶的水解作用基本消失而酯化能力得到了保持.因此,继续对214型树脂固定化酶的单因素条件进行试验及响应面研究,并以酶结合率作为考察指标,得到了固定化的最佳条件.在此条件下固定的脂肪酶,水解作用消失,而酯化能力得到保持.
1 实验部分
1.1 主要试剂及仪器
大豆油脱臭馏出物,浙江新昌制药厂;假丝酵母脂肪酶,北京凯泰新世纪生物技术有限公司;离子交换树脂213,214,312,大孔吸附树脂 D314,D113,D730,浙江争光实业股份有限公司;水浴恒温振荡器SHA-CA,金坛市杰瑞尔电器有限公司.
1.2 离子交换吸附法制备固定化酶
1.2.1 离子交换树脂的预处理
用去离子水清洗树脂三次,除去灰尘等杂质;然后用4%的HCl溶液在搅拌下酸洗2h,水洗除去杂质,再用4%的NaOH溶液碱洗2h;最后用去离子水水洗至中性,并在去离子水中保存备用.
1.2.2 固定化酶的制备
称取处预理过的树脂,加入5.0mL一定浓度的溶于Tirs-HCl缓冲液的酶液.将锥形瓶置于恒定温度和转速的恒温水浴振荡器中,进行交联反应.反应结束后,取出树脂,用去离子水水洗3次,除去树脂表面未被交联的假丝酵母脂肪酶,减压抽滤后,4℃冰箱保存备用.
1.2.3 酶结合率的测定及计算
在制备固定化酶实验中,分别取固定化前酶液、固定化后剩余酶液在595nm下测定其吸光度值,通过计算,得到对应的酶液浓度.根据如下计算公式可得到酶结合率,即

1.3 固定化酶催化大豆油脱臭馏出物脂肪酸甲酯化/水解反应
1.3.1 酯化反应过程
将3.0g的大豆油脱臭馏出物加入25mL的带塞磨口锥形瓶中,按照比例加入甲醇,充分摇匀.然后加入适量固定化后的假丝酵母脂肪酶(相同酶量的游离酶做对照实验),摇匀,最后加入15%缓冲液,pH 8.4Tirs-HCl缓冲液,使其充分混合.将锥形瓶置于恒定温度30.0℃和转速150r/min的恒温水浴振荡器中,反应18h后,测定酯化率.
1.3.2 水解反应过程
将3.0g大豆油脱臭馏出物加入25mL的带塞磨口锥形瓶中,直接加入适量固定化后的假丝酵母脂肪酶(相同酶量的游离酶做对照实验),摇匀,然后加入15%缓冲液,pH 8.4Tirs-HCl缓冲液,使其充分混合.将锥形瓶置于恒定温度30℃和转速150r/min的恒温水浴振荡器中,反应18h后测定水解率[9].
1.4 Box-Behnken试验设计
采用 Box-Behnken响应面设计法[10]对影响固定化酶结合量的关键因素进行研究和优化,以获得最佳条件及操作水平范围.实验辅助软件为Design Expert 7.1.
以酶结合量为响应值,设为Y,影响显著的因子分别以X1,X2,X3代表,按方程xi=(Xi-X0)/ΔX对自变量进行编码.其中:xi为自变量的编码值;Xi为自变量的真实值;X0为实验中心点处自变量的真实值;ΔX为自变量的变化步长.因子编码及各自变量水平见表1.

表1 Box-Behnken实验设计因素水平及编码1)Table 1 Experimental range and levels of independent variables
设该模型通过最小二乘法拟合的二次多项方程为

其中:Y为预测响应值;β0为常数项;βi为线性系数;βij为交互项系数;βii为二次项系数.对于影响不显著的其它工艺参数,皆选定在单因素最适水平.
2 结果与讨论
2.1 树脂种类的选择
本实验选择的固定化条件为:树脂1.0g,酶液5.0mL 10.0mg/mL,水浴温度30℃,转速150r/min,固定化时间3h.6种树脂酶结合率的比较如图1所示,6种树脂固定化酶的酯化能力如图2所示.

由图1可知:312,214,D314树脂的酶结合率相比其他几种树脂的更高,这3种树脂酶结合能力的排序为:D314>214>312.
由图2可知:在酯化反应中,312,214,D314型树脂固定化的脂肪酶表现出较高的酯化能力;在水解反应中,312和214树脂固定化的脂肪酶水解作用基本消失.因此,312型和214型树脂固定化的脂肪酶的酯化专一性较强,这也说明这两种树脂制成的固定化酶酯化性能更好.
综上所述,选择既具有较高的酶结合率又具有较高酯化能力的以聚丙烯酸为骨架的强碱、弱酸性阴离子树脂214作为载体对脂肪酶固定化做进一步研究.
2.2 酶固定化条件各单因素的优化
为了进一步研究214型离子交换树脂固定化的各项条件,对树脂的量、酶的质量浓度、pH、吸附时间、振荡转速、振荡温度6个因素进行考察.以酶结合率为考察指标,筛选最适宜的固定化条件.
2.2.1 酶液浓度的筛选
称取树脂1.0g分别与5.0mL不同浓度的酶液混合,在水浴温度30℃、转速150r/min的条件下固定化3h,结果如图3所示.
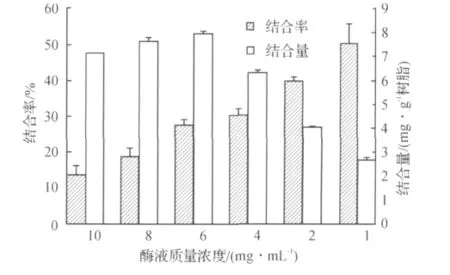
图3 酶质量浓度对结合率的影响Fig.3 Effect of lipase concentration amount on binding ratio of lipase
从图3可以看出:酶结合率随酶质量浓度的增大而减小;结合量随着酶质量浓度的增大相应增多,当酶质量浓度超过6.0mg/mL后,结合量随酶质量浓度增大而小幅减少.由于载体结合位点有限,随着载体负酶量的增大,酶分子间因互相拥挤造成一定的空间位阻,从而不利于酶与载体结合位点的接触.酶液质量浓度为6.0mg/mL是最适的,此时酶的结合率较高,单位树脂上的酶量也是最多的.
2.2.2 树脂的量的筛选
称取不同量的树脂分别与6.0mg/mL和5.0 mL酶液混合于30℃水浴中,在转速150r/min的条件下固定化3h,结果如图4所示.
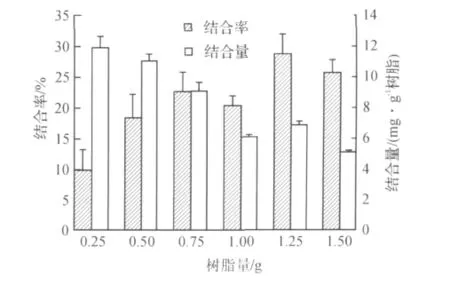
图4 树脂量对结合率的影响Fig.4 Effect of resin's amount on binding ratio of lipase
从图4可以看出:酶结合率随树脂量的增大而增大;而酶结合量随树脂量的增大而减少.综合酶结合率、单位树脂上的酶量,树脂的量选取0.75g为宜.
2.2.3 酶液pH 的筛选
称取0.75g树脂分别与5.0mL 6.0mg/mL不同pH的酶液混合,水浴温度30℃、转速150r/min条件下固定化3h,结果如图5所示.
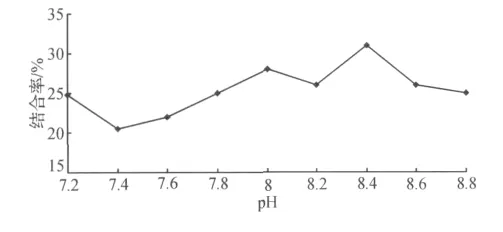
图5 pH对酶结合率的影响Fig.5 Effect of pH on binding ratio of lipase
从图5可以看出:在pH为8.4时,酶结合率达到最高的30%.这是由于在特定的pH值下,酶分子上的活性基团处于最佳的离子状态,易于树脂上的结合位点结合.因此,固定化酶的最适pH为8.4.
2.2.4 固定化时间的筛选
称取0.75g树脂与6.0mg/mL pH8.4的酶液5.0mL混合,在水浴温度30℃、转速150r/min条件下固定化不同的时间,结果如图6所示.

图6 固定化时间对酶结合率的影响Fig.6 Effect of immobilized time on binding ratio of lipase
从图6可以看出:随着固定化时间的延长,酶的结合率增大;当固定化时间超过3h后,增幅变缓并趋于平衡.另外,固定化酶的酯化性能试验显示在4h处有一个转折,先增大后减小.这是由于214树脂上的羟基数量有限,一定时间后,结合位点达到饱和,另外酶与酶之间过于聚集也造成了一定的空间位阻.综合考虑,固定化的时间取4h为佳.
2.2.5 振荡转速的筛选
称取0.75g树脂与6.0mg/mL pH8.4的酶液5.0mL混合,在水浴温度30℃、不同振荡转速条件下固定化4h,结果如图7所示.
从图7可以看出:最佳振荡转速为150r/min,此时酶结合率为28.32%,而振荡转速超过200 r/min,酶结合率显著下降.可能是由于振荡转速过快,导致酶从树脂结合位点脱落.

图7 振荡转速对酶结合率的影响Fig.7 Effect of rotate speed on binding ratio of lipase
2.2.6 水浴温度的筛选
称取0.75g树脂与6.0mg/mL pH8.4的酶液5.0mL混合,于转速150r/min、不同的水浴温度下固定化4h,结果如图8所示.

图8 固定化温度对酶结合率的影响Fig.8 Effect of immobilized temperature on binding ratio of lipase
从图8可以看出:在30~35℃时,脂肪酶结合率较高.当温度高于40℃后,酶的结合率反倒下降.因此,水浴温度控制在30~35℃时,效果最好.从图8中可知,酶结合率最高的水浴温度为30℃.
2.3 酶固定化条件响应面优化试验
2.3.1 酶固定化的条件响应面优化分析
根据酶固定化的二次多元回归方程,分别绘制响应面图及其等高线图,结果见图9—11.
由响应面图可知:缓冲溶液pH值和酶浓度对固定化酶活的交互影响不显著(图9),而当固定振荡转速时,高酶结合量在pH(8.2~8.5)和5.5~7.5mg/mL时得到.酶液质量浓度和振荡转速对固定化酶活的交互影响较显著(图10),而当pH为8.4时,高酶结合量在酶液质量浓度(5.5~7.5mg/mL)和转速125~200r/min获得.pH和转速对固定化酶活的影响也较显著(图11),而当酶浓度为为6.0mg/mL时,高酶结合量则在pH(8.2~8.45)和转速130~200r/min获得.
由软件分析得到最佳固定化条件为酶液质量浓度6.09mg/mL,pH 8.4,振荡转速134.26r/min,固定化酶预测值为酶结合量为10.46mg/g树脂.
2.3.2 模型验证实验
为了验证模型方程的合适性和有效性,进行了最适脂肪酶固定化条件的验证试验.重复五次的固定化酶酶结合量的平均值为11.03mg/g树脂,试验值与预测值吻合情况良好.可见该模型可以用于预测脂肪酶的固定化规律,证明了此模型是合适有效的,并具有一定的实践指导意义.
酶固定化条件优化后,固定化酶结合量为11.03 mg/g树脂,比优化前增加.并且酶的水解作用消失,可以在VE提取的预处理反应中获得较好的甲酯化效果.
3 结 论
从6种树脂中筛选出了聚丙烯酸为骨架的强碱、弱酸性阴离子树脂214作为固定化假丝酵母脂肪酶的最适载体.在单因素试验的基础上结合响应面法对214型离子交换树脂固定化假丝酵母脂肪酶工艺进行优化.得到的最佳工艺为:5mL酶液中加入0.75g树脂,酶液质量浓度为6.09mg/mL,缓冲液pH 8.40,振荡转速为134.26r/min,固定化温度为30℃,固定化时间4h.根据实验所得的最佳固定化条件下制得的固定化酶结合量为11.03mg/g树脂,此条件下的固定化酶在甲酯化反应中水解基本消失,而酯化能力可以得到保持.这将使从大豆脱臭馏出物中提取天然维生素E的酶法预处理效果更好.
[1]谷克仁,王秀华.脱臭馏出物提取VE的酶预处理[J].中国油脂,2006,31(2):41-43.
[2]周秀秀,辛嘉英,陈林林.等大豆油脱臭馏出物的酶法甲酯化[J].农产品加工学刊,2010(8):53-55.
[3]崔娟,吴坚平,杨立荣.脂肪酶固定化研究和应用[J].化学反应工程与工艺,2005,21(1):43-48.
[4]CRUZ J C,PFROMM P H,REZAC M E.Immobilization of Candida antarctica lipase B on fumed silica[J].Proc Biochem,2009,44:62-69.
[5]陈建龙,祁建城,曹仪植,等.固定化酶研究进展[J].化学与生物工程,2006,23(2):7-9.
[6]WANG Zhen-gang,WAN Ling-shu,LIU Zhen-mei,et al.Enzyme immobilization on electrospun polymer nanofibers:an overview[J].J Mol Catal B:Enzym,2009,56(4):189-195.
[7]GAO Si-liang,WANG Yu-jun,TAO Wang,et al.Immobilization of lipase on methyl-modified silica aerogels by physical adsorption[J].Biores Technol,2009,100(2):996-999.
[8]徐娟,张梁,石贵阳.离子交换树脂固定化α-淀粉酶的研究[J].食品工业科技,2008,9(4):75-80
[9]MASANOBU K,TSUYOSHI H,YOSHITAKA Y.Immobilization of lipase on a new inorganic ceramics support toynite and reactivity and enanitoselectivity of the immobilized lipase[J].Journal of Molecular Catalysis B:Enzymaitc,2000,9(4):269-274.
[10]PALOMO J M,MU~NOZ G,LORENTE F G,et al.Interfacial adsorption of lipases on very hydrophobic support(octadecyl-Sepabeads):immobilization,hyperactivation and stabilization of the open form of lipases[J].Journal of Molecular Catalysis B:Enzymatic,2002,19(20):279-286.
