茶园根际土壤细菌群落结构及多样性
2013-10-12胡桂萍宋凤琴陈李林尤民生福建农林大学应用生态研究所福建福州35000农业部闽台作物有害生物综合治理重点实验室福建福州35000
赵 艳,胡桂萍,宋凤琴,陈李林,尤民生*福建农林大学应用生态研究所,福建福州35000;>农业部闽台作物有害生物综合治理重点实验室,福建福州35000
铁观音是我国重要的茶品种,主要种植区为福建安溪地区,主要适生于亚热带酸性土壤。已有研究表明,由于茶园多为单一化种植,随着植茶年限的增加,茶园土壤pH值明显下降,Ca、Mg等盐离子和微量元素相对缺乏,而Al、F和多酚类物质逐渐在茶园土壤中富集和积累,从而形成特有的茶园土壤微生态环境,包括微生物群落结构及土壤酶体系,土壤微生物呼吸作用等(Shi et al.,1999;Tachibana et al.,1995)。早在1985年,洪桢瑞等研究发现,茶树根际环境里有多种类群微生物,包括一些对增进土壤肥力有显著效益的种群,如固氮细菌、氮化细菌、纤维分解细菌等,且根际细菌群中以简单氨基酸类物质为养料的细菌占有很高比例,主要为假单孢菌属Pseudomonas、短杆菌属Brevibacterium、土壤杆菌属Agrobacterium和微球菌属Micrococcus等属的细菌(洪祯瑞等,1985)。近年来,茶园土壤中固氮菌类等功能性微生物已有比较深入的研究。胡磊(2010)采用nifH基因对套种圆叶决明的茶园根际土壤进行PCR-RFLP分析,发现土壤中的固氮微生物群落结构丰富,主要为 α-、β-、γ-变形菌门及蓝细菌门。目前,对于茶园根际土壤微生物群落结构的研究报道较少,郑雪芳等(2010)分析得到不同海拔茶园土壤微生物磷脂脂肪酸(phospholipid fatty acid,PLFA)组成差异大,且微生物群落PLFA组成与海拔具有相关性。
根际土壤微生物是一个复杂的群体,随着种植物的生长,会形成特有的根际微生物群落。根际土壤中存在的微生物具有一定的生理活性和功能多样性,能促进植物根部生长和营养物质的吸收利用,其群落结构组成及多样性与植物的生长相辅相成(郑雪芳等,2010)。大量研究表明,根际土壤微生物群落结构对于植物的产量和质量具有重要的贡献(林生等,2012)。研究茶园生境条件下根际土壤微生物群落结构及多样性,对于阐明茶园根际土壤微生物学特点和确立健康茶园土壤微生物学指标有重要意义。本试验通过变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)分析铁观音种植区不同海拔茶园根际土壤微生物中细菌的群落结构,结合Shannon-Wiener多样性指数分析不同海拔茶园根际土壤微生物中细菌群落的多样性,利用生态学统计软件Canoco(Braak,1988)对安溪茶园根际土壤微生物群落结构和环境变量中的土壤理化性质进行蒙特卡罗检验(Monte Carlo Test)(Robert et al.,1999),对影响茶园根际土壤细菌群落组成的环境因子进行冗余分析(redundancy analysis,RDA)(van den Wollenberg,1977),获得茶园根际土壤细菌群落结构、分布特征及影响其分布的环境因子和主环境因子,进一步明确铁观音生长的微生态特点,为铁观音的健康生长和管理提供微观理论基础。
1 材料与方法
1.1 供试土壤
2011年7月14~15日,于福建省泉州市安溪县西坪镇上尧村、感德镇两地,采用GPS定位,分别从海拔200~760 m分梯度采集茶园根际土壤,共15处茶园(附表1)。以茶树主茎为中心,在半径20~30 cm的范围内取土,去掉茶树根部表面土层,采集0~20 cm土壤。以5点取样法对各茶园根际土壤进行随机采样,然后将其混合到一个采集袋内,带回实验室,置于4℃冰箱中保存。取500 g用于DGGE试验,其余500 g送至福建省农业科学院土壤肥料所进行土壤理化性质检测(附表2)。
1.2 研究方法
1.2.1 茶园根际土壤总 DNA的提取 采用Fast DNA® SPIN Kit for Soil试剂盒进行提取,500 mg土样加入到Lysing matrix管中,按Mahmoudi的步骤进行提取(Araya et al.,2006)。
1.2.2 茶园根际土壤DNA的PCR扩增 采用16S通用引物8F和1492R(Ercolini,2004)进行PCR扩增,得到细菌16S片段之后,再用V3区引物R534和F341-GC(许爱清等,2010)对细菌V3区进行扩增。所用引物序列见表1,反应体系如下:(1)16S rDNA的PCR扩增体系:引物8F(10 pmol·μL-1)1 μL,引物 1492R(10 pmol·μL-1)1 μL,土壤总DNA 1 μL,Taq PCR Mastermix(天根生化科技有限公司,下同)12.5 μL(1 ×),ddH2O,总体积25 μL。(2)V3区的PCR扩增体系:引物R534(10 pmol·μL-1)1 μL,引物 F341-GC(10 pmol·μL-1)1 μL,DNA 模板 1 μL,Taq PCR Mastermix 12.5 μL(1 × ),ddH2O,总体积25 μL。
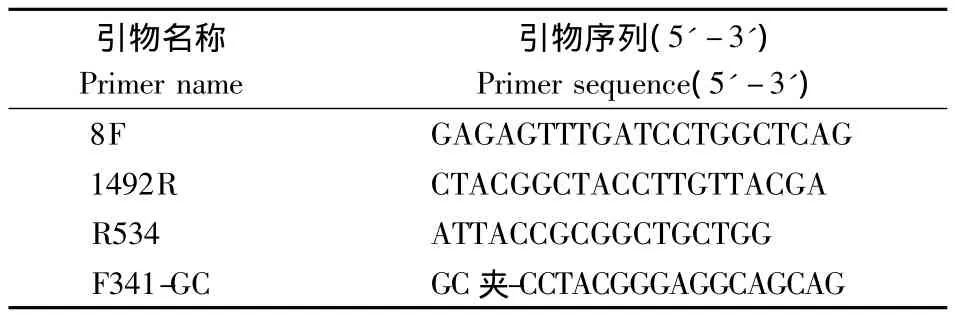
表1 用于PCR扩增的引物Table 1 Primers for PCR amplification
反应程序如下:(1)16S rDNA的PCR扩增反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸 30 s,30个循环;72℃延伸10 min;(2)V3区的PCR扩增反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃延伸10 min。
以上所有PCR产物均用2.0%琼脂糖进行凝胶电泳检测。
1.2.3 茶园根际土壤细菌V3区扩增产物的DGGE分析 变性梯度凝胶电泳:选择聚丙烯酰胺凝胶浓度为8%(丙烯酰胺与甲叉双丙烯酰胺的质量比为37.5∶1),变性梯度范围为35% ~60%(100%变性剂含有7 mol·L-1尿素和40%甲酰胺)。采用Bio-Rad变性梯度凝胶电泳系统进行电泳,DNA扩增产物的上样量为20 μL,电泳缓冲液为1×TAE缓冲液,60℃条件150 V电泳5 h左右。电泳结束后用SYBR Green I染色,弃去浸泡液,再在ddH2O中浸泡冲洗2 min,利用UVP凝胶成像分析系统照相。
DGGE图谱分析:采用Quantity One(Bio-Rad)软件对DGGE条带进行数字化分析并采用UPGMA法进行聚类。DGGE条带中DNA含量与其灰度(范围0~255,0为最小值,255为最大值)呈线性关系,因此,用条带灰度来代替每个DGGE条带的扩增量(Ni)用于计算。每个条带的相对含量pi为该条带的灰度值Ni与该列所有条带灰度值总和N的比值。细菌群落结构多样性指数(H′)和均匀度指数(E)的计算方法为:
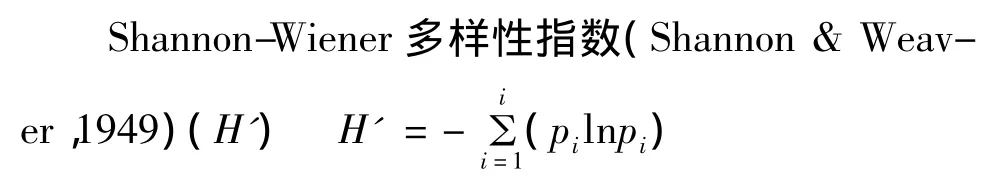
Pielou均匀度指数(Peilou,1977)(E)E=H′/lgS
其中,pi=Ni/N,Ni为样本i的每一单独条带的灰度,N为样本 i所有条带灰度的总和;S为Richness丰富度指数,即DGGE图谱中每一个样本所含的条带数目;采用生态学软件Canoco对茶园根际土壤细菌群落与土壤理化性质进行蒙特卡罗检验,并对茶园根际土壤细菌群落结构与环境变量之间的关系进行RDA分析。
1.2.4 DNA的回收、克隆及测序 在紫外灯下切割DGGE凝胶上不同位置的优势条带,置于20 μL TE buffer中,4℃过夜。取2 μL为DNA模板进行16S rDNA V3可变区域扩增。PCR产物经DGGE后,割胶回收,将其连接到PMD-19T vector(宝生物工程(大连)有限公司),转化到大肠杆菌DH5α,摇床培养,涂板,挑取阳性克隆子,送至上海生物工程技术服务有限公司测序,利用BLAST对测序获得的 DNA 序列进行比对分析(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)。
2 结果与分析
2.1 土壤总DNA的提取及PCR扩增结果
经测定,15个茶园根际土壤微生物总DNA的D260nm/D230nm集中在1.80 ~1.88 之间,D260nm/D280nm集中在1.70~1.75之间。电泳结果显示土壤DNA片段大小约为2.30 kb(图1);经过PCR扩增,得到大小约为1500 bp的16S rDNA片段和230 bp的V3片段(图2~3)。
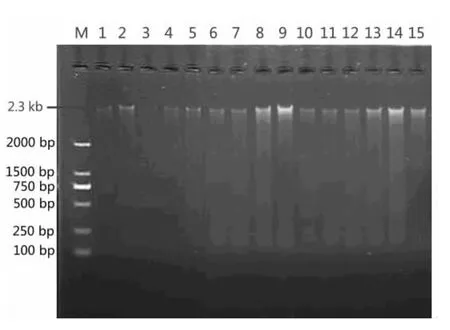
图1 土壤总DNA提取电泳图Fig.1 Electrophoresis profiles of total DNA extracted from soil
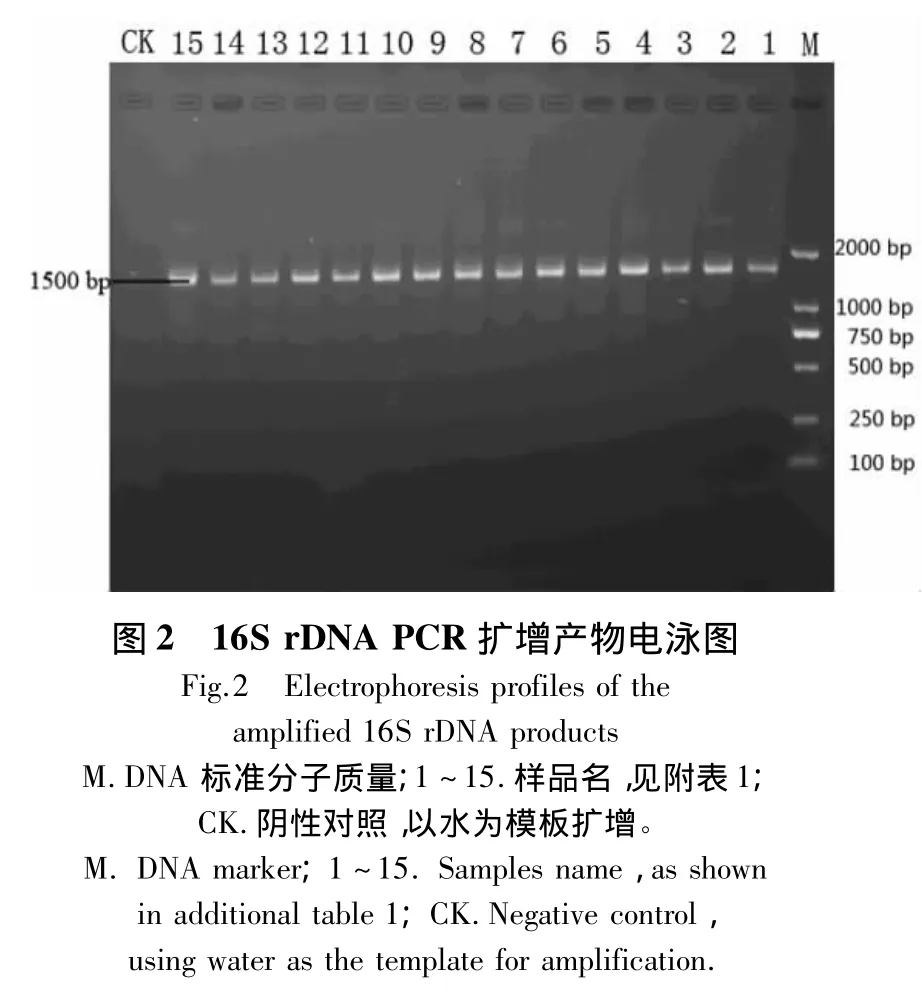
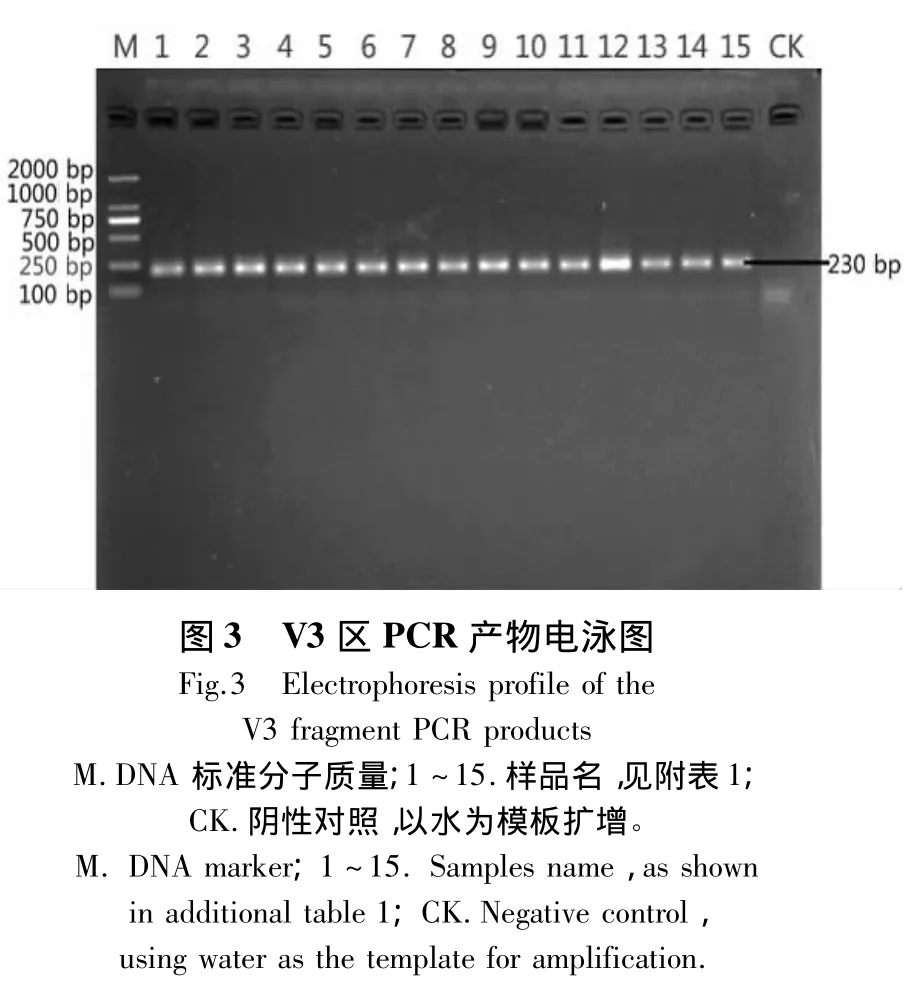
2.2 茶园根际土壤细菌V3区的DGGE图谱
茶园根际土壤细菌V3区的DGGE图谱表明,茶园根际土壤细菌的16S rDNA片段经DGGE分离为若干条带,Quantity One图像软件对DGGE指纹图谱进行分析,不同海拔梯度茶园根际土壤微生物中的DGGE条带数目集中在19~28条。其中,条带数最少的为5号茶园,海拔为600 m;条带数最多的有28条,为9号和11号茶园,海拔均为400 m(图4)。
对DGGE图谱中样本进行聚类分析(图5),15个样本共聚为3大类:处于200 m海拔处的14、15号茶园和300 m海拔处的12、13号茶园聚为一类;处于500 m海拔处的6、7、8号茶园和400 m海拔处的9、10、11号茶园聚为一类;处于760 m 海拔处的1、2、3号茶园和600 m海拔处的4、5号茶园聚为一类(图5)。由此可见,茶园根际土壤细菌群落聚类特征与茶园所处海拔梯度紧密相关。
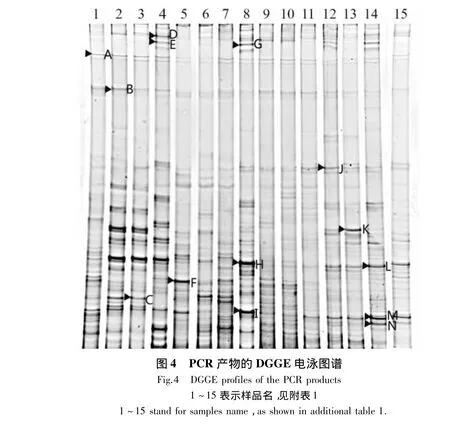

图5 DGGE图谱的聚类分析Fig.5 Clustering analysis of DGGE profiles
在紫外灯照射下,从DGGE胶片上面割下14个强信号的条带(A~N)进行PCR扩增、克隆、测序,并在NCBI中进行BLAST比对。结果可知,14个被测序列与NCBI已知序列的相似度除H外均为100%(表2)。鉴定结果表明,茶园根际土壤优势细菌主要是非可培养细菌,占80%;其余20%经鉴定为可培养细菌,分别隶属于根瘤菌属Rhizobium、苜蓿中华根瘤菌属Sinorhizobium和苍白杆菌属Ochrobactrum,其 登 录 号 分 别 为 JN819573.1、JX133181.1 和 KC252620.1。

表2 测序比对结果Table 2 Alignment of sequences
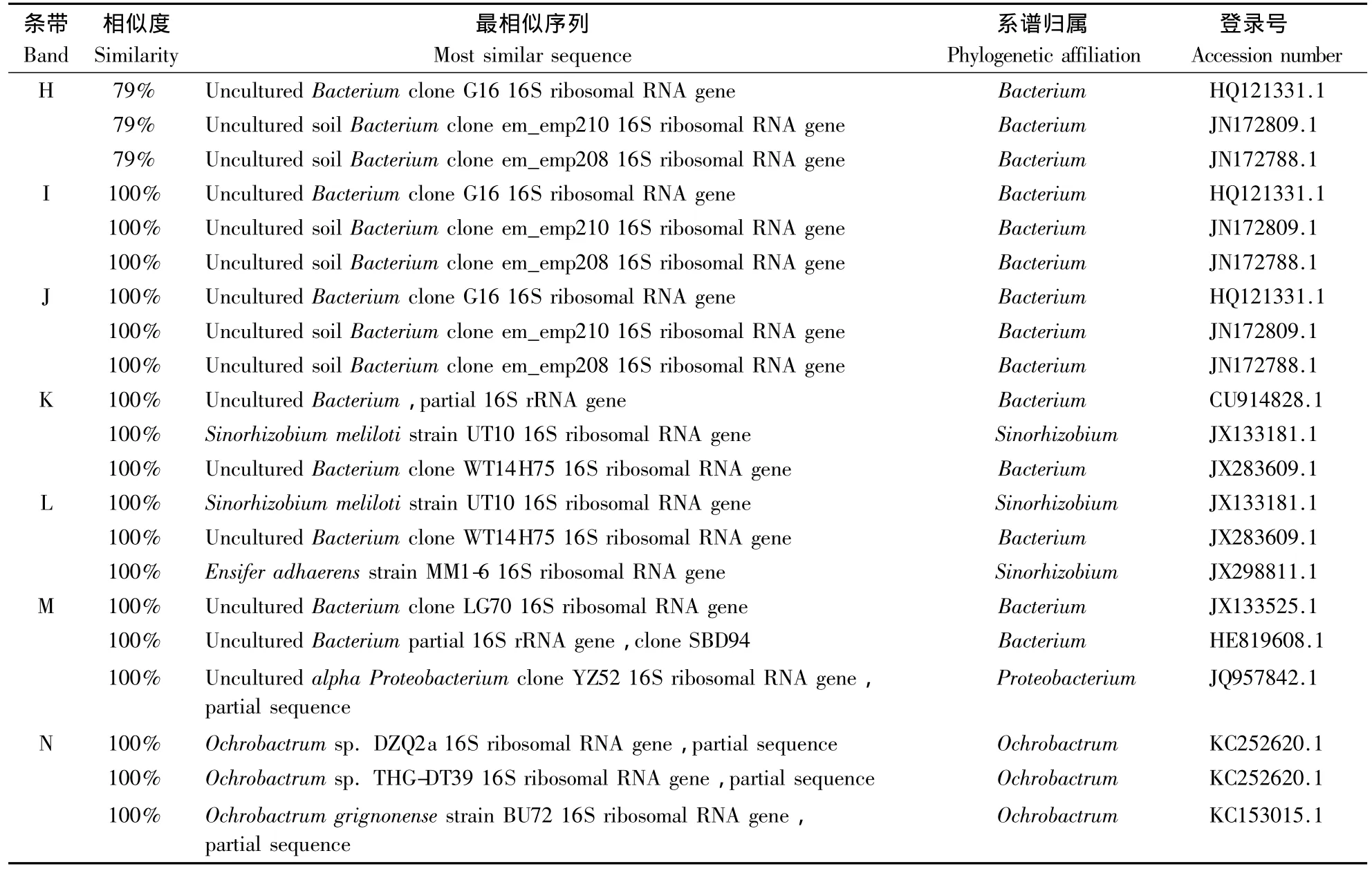
续表2
从茶园根际土壤细菌群落Shannon-Wiener多样性指数分析(表3)结果来看,高海拔的茶园根际土壤细菌群落Shannon-Wiener多样性指数相对较低,低海拔的样本Shannon-Wiener多样性指数相对较高,其中海拔为400 m的3个茶园(9、10、11)根际土壤细菌群落Shannon-Wiener多样性指数和丰富度均较高,分别为 3.27、3.20、3.32 和 28、26、29;均匀度指数也存在类似规律(表3)。

表3 茶园根际土壤细菌群落基因多样性指数Table 3 Genetic diversity index of bacterial communities in the rhizosphere soil of tea plantations
2.3 茶园根际土壤细菌群落的环境特性
研究表明,土壤细菌群落结构组成受环境因素(如土壤pH值,C/N值,有机质等)的影响。生态学上一般采用Canoco软件进行环境变量贡献率分析,本研究利用Canoco对茶园根际土壤细菌群落和土壤理化性质进行蒙特卡罗检验,结果可知,磷(P)在所有环境因子中的贡献率最高,达到10.64%;其次为A-P,解释的变异率为10.47%;其余环境变量对茶园根际细菌群落分布的贡献依次降低(表4)。由此可知,土壤的理化性质中对茶园根际土壤细菌群落按照海拔能够聚类这一结果起主要解释作用的环境变量为P。同时发现,所有环境因子协同作用对茶园根际土壤细菌微生物群落结构的贡献率达到59.60%(表4)。从p值来看,虽然P在所有环境变量中贡献最大,但其p值并未达到显著水平(p<0.05)。由于茶园根际微环境较为复杂,茶树根际土壤营养循环的过程由各种因素共同决定的,从土壤理化性质方面来讲,P起着主导作用,但它与其他环境变量协同作用,在茶园根际这个微域环境中对微生物的群落结构形成具有一定的影响作用。
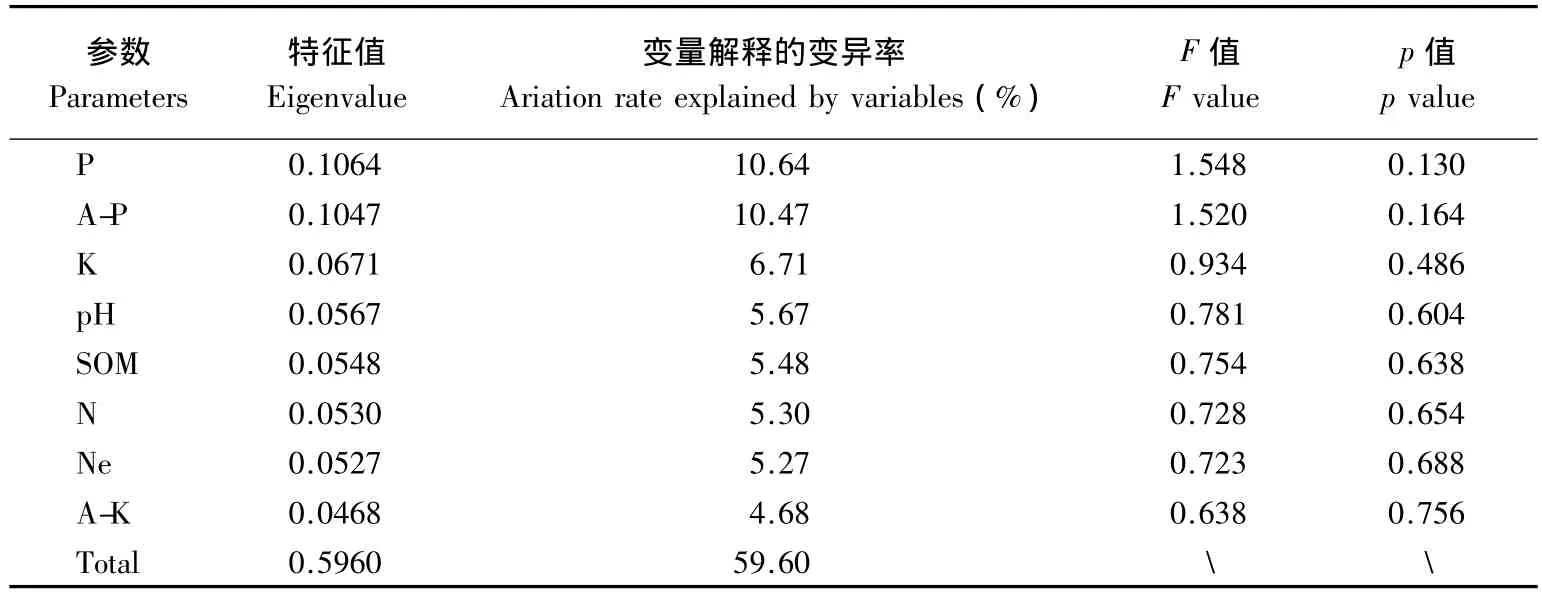
表4 蒙特卡罗检验结果Table 4 Result of Monte Carlo test
对茶园根际土壤细菌群落和环境变量P进行冗余分析(图6),得到各个海拔梯度的茶园根际土壤细菌群落在环境因子P的方向上的分布情况。由分析结果可见,15个茶园根际土壤细菌群落样本在P的方向上按照海拔特征依次聚类,其中海拔600 m的样本4、5聚为一类,海拔500 m的样本6、7、8聚为一类,海拔400 m样本9、10、11聚为一类,海拔为300和200 m 的样本12、13、14、15聚为一类,海拔760 m的样本1、2、3聚为一类(图6)。此结果与DGGE聚类的结果一致,共同说明茶园根际土壤细菌群落结构与海拔梯度密切相关。
3 讨论
近年来,茶园根际土壤微生物的研究及其功能微生物开发利用方面已经取得不少进展。Çakmakç et al.(2010)研究发现茶园土壤中可培养的细菌主要有芽孢杆菌属Bacillus(34.6%)、假单胞菌属Pseudomonas(8.9%)、寡 养 单 胞 菌 属 Stenotrophomonas(6.1%)、类芽孢杆菌属 Paenibacillus(5.9%)和节杆菌属 Arthrobacter(4.8%)。Saikia et al.(2011)已对从茶园根际土壤分离到的25种假单胞菌进行拮抗活性和代谢产物的研究,发现了抗生素2,4-diacetylphloroglucinol(DAPG)和 pyoluteorin(PLT)的编码基因Pf12和Pf373。本研究的试验结果表明,安溪茶园根际细菌中非可培养细菌居多,可培养的细菌较少,主要是根瘤菌、苜蓿中华根瘤菌和人苍白杆菌。有报道表明,苜蓿中华根瘤菌在土壤体系中具有强固氮作用(管凤贞等,2012),人苍白杆菌因其自身耐药性比较强而能够分解土壤中残留的农药(王伟霞等,2010)。因此,从安溪茶园根际土壤中鉴定到的苜蓿中华根瘤菌和人苍白杆菌是否同样具有相应的作用值得进行进一步研究。
茶园根际土壤微生物多样性的研究已有报道,郑雪芳等(2010)利用PLFA生物标记法研究了不同海拔梯度茶园根系土壤微生物群落多样性,得到不同的PLFA在不同海拔梯度茶树根系土壤分布差异明显,其中,高海拔(834 m)茶树根系土壤分布的PLFA种类和数量都最多。聚类分析和冗余分析结果共同表明,茶园根际土壤细菌群落结构与海拔分布紧密相关,中间海拔细菌丰富度相对低海拔和高海拔细菌更高,400 m海拔处Shannon-Wiener多样性指数最高,平均值为3.26,细菌种类最丰富;本研究取样的茶园集中于福建省泉州市安溪县西坪镇和感德镇2个地方,土壤均为红壤,两地区气候条件相似,排除气候差异等的影响,结果分析表明,影响茶树根际微生物群落的主要因素为海拔梯度、肥力状况和土壤本身理化性质。相对于最高海拔760 m和最低海拔200 m,处于中间梯度的400 m海拔梯度,其生态系统比较适宜更多的细菌类群生存。
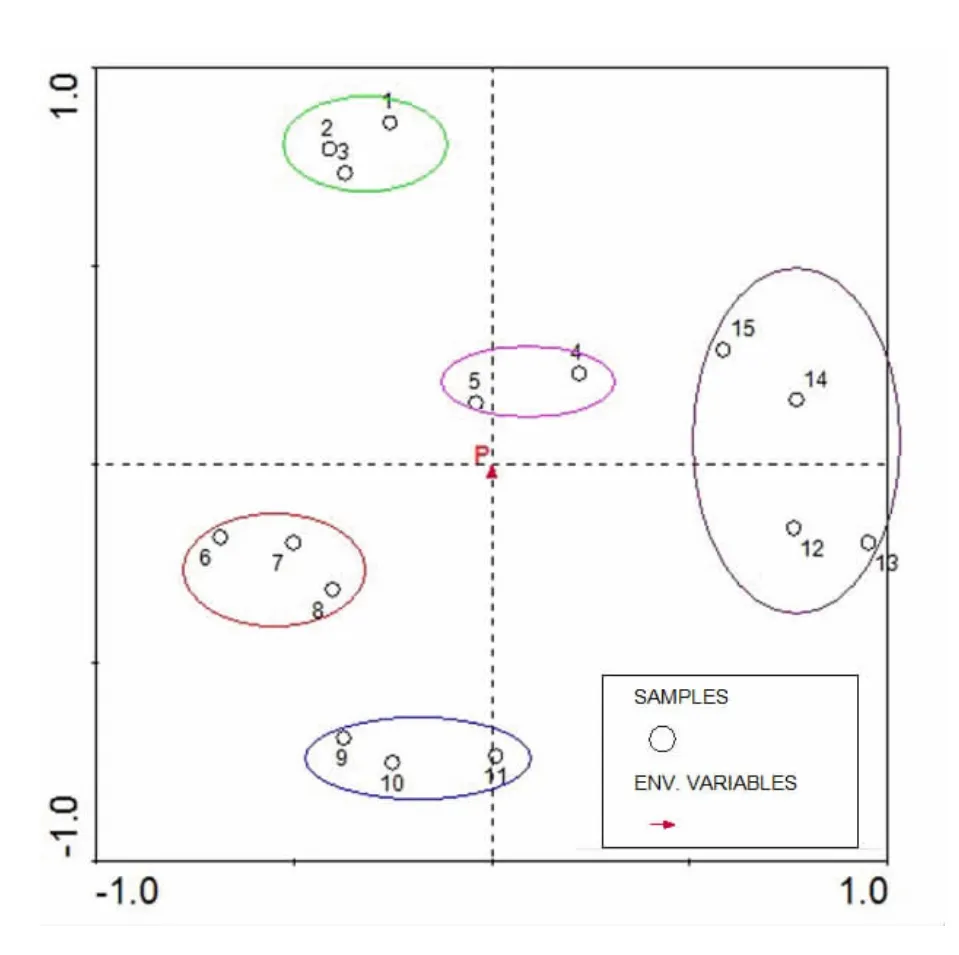
图6 茶园根际土壤细菌群落的RDA分析Fig.6 RDA analysis of bacterial communities in the rhizosphere soil of tea plantations
本研究结果还表明,P是所有环境变量中影响安溪茶园根际细菌群落结构的主要因子,它对该地区茶园细菌群落分布的贡献达到10.64%,所有环境因素协同作用对该地区细菌群落分布的影响占59.6%。而He et al.(2008)也证明P是所有茶园根际土壤环境因子中影响微生物群落分布的关键因子,同时Zheng et al.(2012)发现有机质、速效磷、氮,与土壤中微生物种群分布有一定相关作用。
茶园根际土壤微生物群落结构是一个复杂的有机体,本研究主要明确了细菌群落结构分布与海拔梯度及土壤理化性质的关系,对于茶园根际环境中真菌、放线菌的研究也有待进一步进行,同时对于其他环境因子的研究也尚待深入。
管凤贞,邱宏端,陈济琛,林新坚.2012.根瘤菌菌剂的研究与开发现状.生态学杂志.31(3):755-759.
洪祯瑞,王益福,方月珍,董金甫,李能树.1985.茶树根际微生物区系的研究.茶叶科学,(2):9-16.
胡磊.2010.套种圆叶决明和施肥对茶园土壤固氮微生物群落的影响.福州:福建农林大学.
石锦芹,丁瑞兴,刘友兆,孙玉华.1999.尿素和茶树落叶对土壤的酸化作用.茶叶科学,(1):7-12.
李福荣,周强,史峥贤,王彩丽.2009.信阳毛尖茶树根际微生物群落组成与茶叶质量的关系.安徽农业科学,37(22):65.
王伟霞,李福后,王文锋.2010.微生物在土壤污染中的生物修复作用.北方园艺,(4):1208-1211.
许爱清,李宗军,王远亮,文杰宇.2010.应用 PCR-DGGE技术检测发酵食品和饲料中真菌菌群.食品科学,31(7):317-321.
郑雪芳,苏远科,刘波,蓝江林,杨述省,林营志.2010.不同海拔茶树根系土壤微生物群落多样性分析.中国生态农业学报,18(4):886-871.
Araya R,Tani K,Takagi T,Yamaguchi N and Nasu M.2006.Bacterial activity and community composition in stream water and biofilm from an urban river determined by fluorescent in situ hybridization and DGGE analysis.FEMS Microbiology Ecology,43:111-119.
Braak C J.1988.CANOCO-an extension of DECORANA to analyze species-environment relationships.Plant Ecology,75,159-160.
Çakmakç R,Dönmez M F,Ertürk Y,Erat M,Haznedar A and Sekban R.2010.Diversity and metabolic potential of culturable bacteria from the rhizosphere of Turkish tea grown in acidic soils.Plant and Soil,332:299-318.
Ercolini D.2004.PCR-DGGE fingerprinting:novel strategies for detection of microbes in food.Journal of Microbiological Methods,56:297-314.
Haq Q M R,Sharma G D,Huidrom P and Jan A T.2011.Molecular characterization of endosulfan tolerant Rhizospheric microbes from tea gardens of Silchar assam India.Journal of ExA-Primental Sciences,2(2):12-15
He J Z,Zheng Y,Chen C R,He Y Q and Zhang L M.2008.Microbial composition and diversity of an upland red soil under long-term fertilization treatments as revealed by culturedependent and culture-independent approaches.Journal of Soils and Sediments,8:349-358.
Pielou E C.1975.Ecological Diversity.New York:Wiley.
Robert C P,Casella G and Robert C P.1999.Monte Carlo Statistical Methods(Vol.58).New York:Springer.
Saikia R,Sarma R K,Yadav A and Bora T C.2011.Genetic and functional diversity among the antagonistic potential fluorescent pseudomonads isolated from tea rhizosphere.Current microbiology,62:434-444.
Shannon C E and Weaver W.1949.The Mathematical Theory of Communication.Urbana:University of Illinois Press.
Tachibana N,Yoshikawa S and Ikeda K.1995.Influences of heavy application of nitrogen on soil acidification and root growth in tea[Camellia sinensis]fields.Japanese Journal of Crop Science,64:516-522.
van den Wollenberg A L.1977.Redundancy analysis an alternative for canonical correlation analysis.Psychometrika,42:207-219.
Zheng Y,Tian X F,Shen J P and Zhang L M.2012.Methanotrophic abundance and community fingerprint in pine and tea plantation soils as revealed by molecular methods.African Journal of Biotechnology,11:11807-11814.
Zou X M ,Ruan H H,Fu Y,Yang X D and Sha L Q.2005.Estimating soil labile organic carbon and potential turnover rates using a sequential fumigation-incubation procedure.Soil Biology and Biochemistry,37:1923-1928.
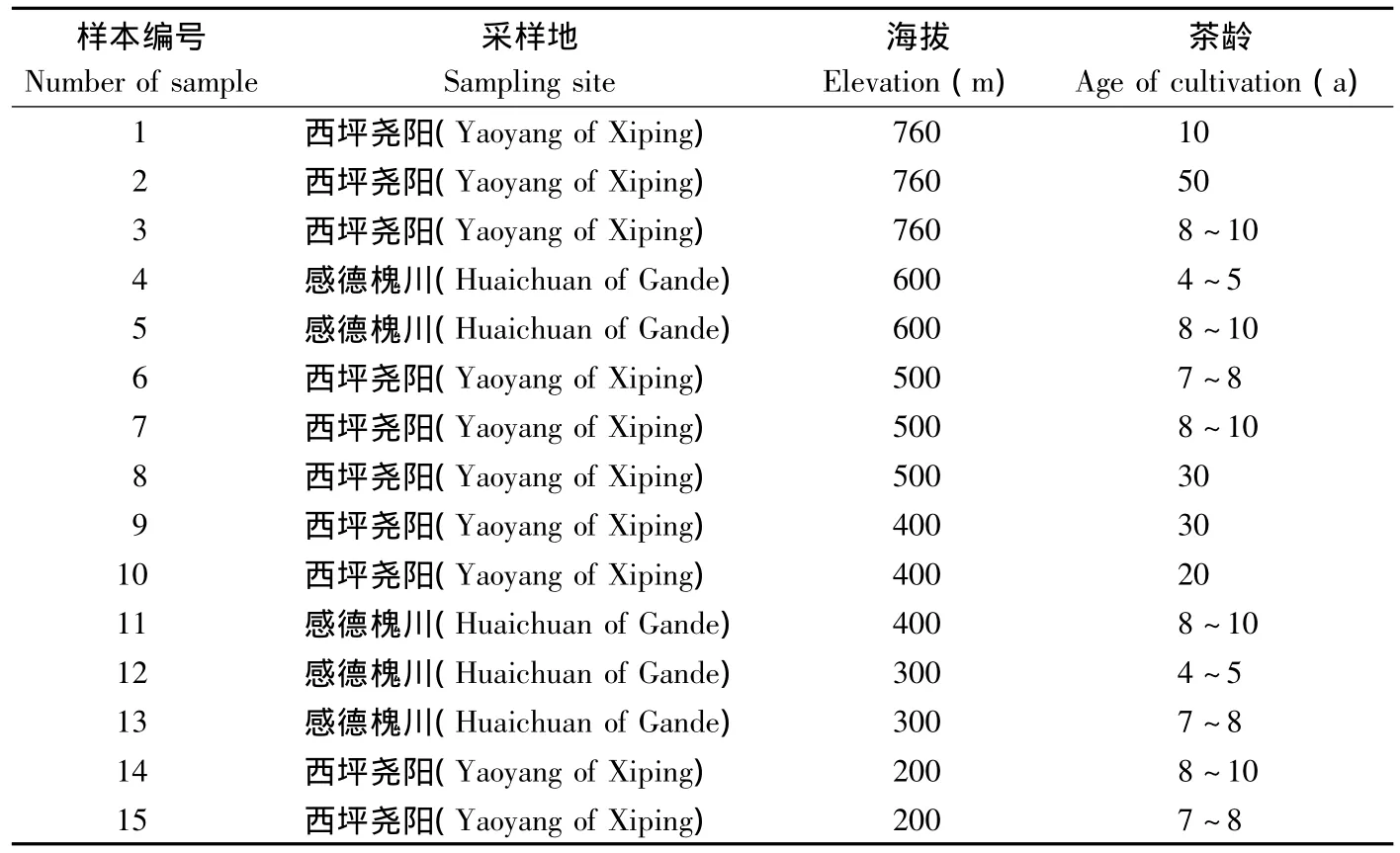
附表1 土壤样本信息Additional table 1 Information of samples
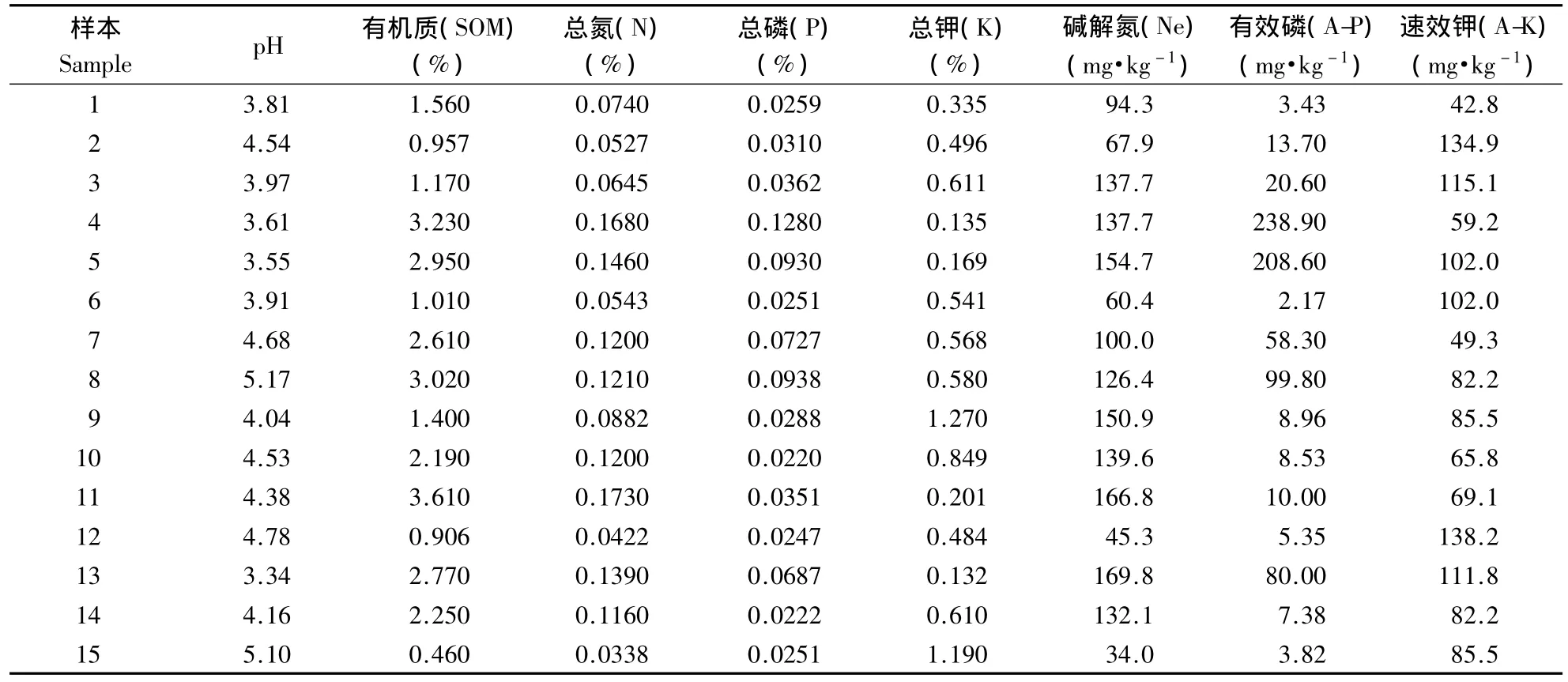
附表2 样本理化性质Additional table 2 The physicochemical properties of samples
