膀胱癌组织HIF-1α与Survivin、Bcl-2表达的关系和意义
2013-10-10刘廷江谷守义王刚
刘廷江 谷守义 王刚
缺氧是恶性肿瘤的一种常见现象,可导致一系列基因的表达发生变化。低氧诱导因子-1α(Hypoixa inducible factor-1α,HIF-1α)在其中发挥着重要调控作用[1,2]。有研究表明,HIF-1α在膀胱癌、食管癌、胃癌等多种恶性肿瘤中表达增高[3-5],但迄今有关HIF-1α在膀胱癌细胞中的作用机制还没有完全阐明。有研究发现,HIF-1α可以通过影响Survivin、Bcl-2等凋亡抑制基因而增强肿瘤细胞的抗凋亡作用[6,7],但有关膀胱癌中HIF-1α与肿瘤细胞凋亡机制的研究尚不多见。因此,本研究检测了HIF-1α、Survivin、Bcl-2在不同膀胱移行细胞癌组织及正常膀胱组织中的表达,对HIF-1α在膀胱癌中的作用和临床意义进行了初步探讨。
1 资料与方法
1.1 一般资料 临床标本取自2009年12月至2012年4月在我科治疗并有病理证实的68例膀胱移行细胞癌患者,其中男51例,女17例;年龄39~78岁,平均年龄(61±11)岁。患者临床病历资料中,肿瘤病理分级:G1 24例、G2 28例、G3 16例;肿瘤分期:Ta~1 28例、T2~4 40例;初发膀胱癌42例,复发26例。另取20例正常膀胱组织(均取自良性前列腺增生行开腹前列腺切除患者)作为对照。
1.2 方法 免疫组织化学染色(SP法)检测HIF-1α、Survivin、Bcl-2蛋白表达。兔抗人HIF-1α、Survivin、Bcl-2多克隆抗体、免疫组化试剂盒均购自美国Santa Cruz公司,按试剂盒说明采用SP法分别对肿瘤组织和正常膀胱组织对HIF-1α、Survivin、Bcl-2蛋白进行免疫组化染色,用PBS代替一抗做阴性对照、已知阳性切片作阳性对照。由两位病理医师双盲阅片进行结果判定。每张切片均随机取400倍光镜视野5个,在每视野中计数100个细胞。HIF-1α、Survivin、Bcl-2均以细胞浆呈黄色认为阳性染色。按肿瘤细胞阳性率和细胞着色强度分别记分。按阳性率记分标准:无阳性细胞为0分,阳性细胞≤10%为1分,11% ~50%为2分,51% ~80%为3分,>80%为4分。按着色强度记分标准:无着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。两种记分相乘结果为0~1为阴性(-),2~3为弱阳性(+),4~7阳性(++),≥8强阳性(+++)。
1.3 统计学分析 应用SAS 8.0统计软件,免疫组化结果以等级资料表示,HIF-1α、Survivin、Bcl-2在肿瘤和正常膀胱组织中的比较、肿瘤病理分期之间的比较、初发癌与复发癌之间的比较采用秩相关检验;HIF-1α、Survivin、Bcl-2在不同肿瘤病理分级之间的关系应用χ2检验;各蛋白质之间的关系分析采用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 膀胱癌和正常膀胱组织中HIF-1α、Survivin、Bcl-2蛋白表达强度 68例膀胱癌组织中HIF-1α、Survivin、Bcl-2蛋白阳性表达率分别为 63.24%(43/68)、73.53%(50/68)、48.53%(33/68);正常膀胱组织3种蛋白表达阳性率分别为5.00%(1/20)、35.00%(7/20)、15.00%(3/20)。经比较,HIF-1α、Survivin、Bcl-2在肿瘤组织中的表达均较正常膀胱组织增强(均P <0.05)。见表1、图1~3。
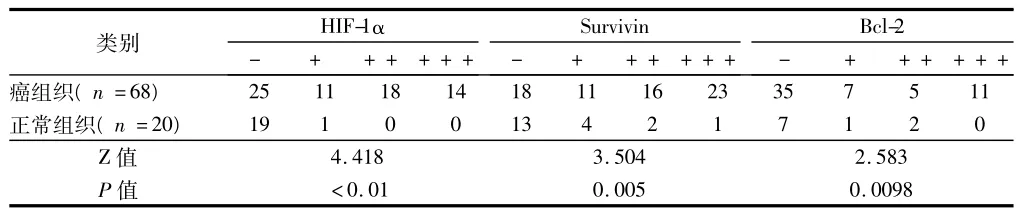
表1 膀胱癌和正常膀胱组织HIF-1α、Survivin、Bcl-2的表达情况例

图1 HIF-1α在膀胱癌组织的阳性表达(SP×200)
图3 Bcl-2在膀胱癌组织的阳性表达(SP×200)
2.2 膀胱癌组织HIF-1α、Survivin、Bcl-2蛋白表达与肿瘤病理分级、分期的关系 膀胱癌组织中HIF-1α在不同分级、分期的肿瘤中表达阳性率分别为:G1 45.83%(11/24)、G2 67.86%(19/28)、G3 81.25%(13/16);Ta~1期阳性率为50.00%(14/28)、T2~4期为72.50%(29/40)。Survivin在不同分级、分期的肿瘤中表达阳性率分别为:G1 54.17%(13/24)、G2 82.14%(23/28)、G3 87.50%(14/16);Ta-1期阳性率为64.29%(18/28)、T2~4期为80.00%(32/40)。Bcl-2在不同分级、分期的肿瘤中表达阳性率分别为:G1 37.50%(9/24)、G2 53.57%(15/28)、G3 56.25%(9/16);Ta~1期阳性率为35.71%(10/28)、T2~4期为57.50%(23/40)。HIF-1α、Survivin、Bcl-2蛋白表达强度均随肿瘤病理分级、分期进展而增强(均P<0.05)。见表2。
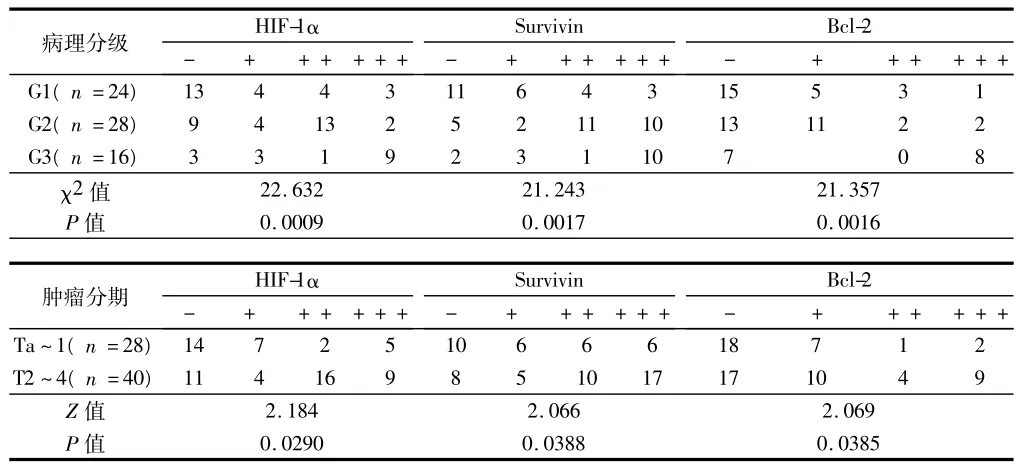
表2 膀胱癌组织HIF-1α、Survivin、Bcl-2表达与肿瘤病理分级、分期的关系 例
2.3 初发膀胱癌组织与复发癌组织中HIF-1α、Survivin、Bcl-2的表达强度 初发膀胱癌组织中HIF-1α、Survivin表达强度均低于复发癌组织(均P<0.05),而Bcl-2在初发膀胱癌组织与复发癌组织中差异无统计学意义(P>0.05)。见表3。
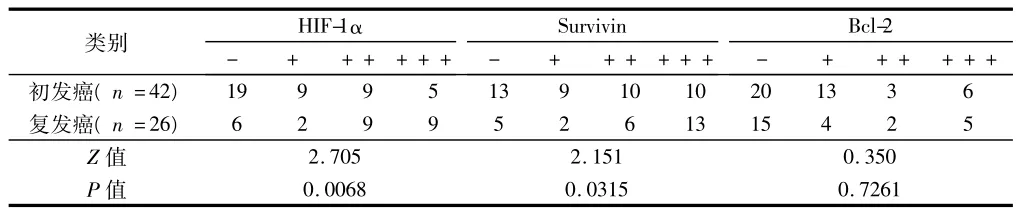
表3 初发和复发膀胱癌HIF-1α、Survivin、Bcl-2的表达情况 例
2.4 膀胱癌和正常膀胱组织中HIF-1α、Survivin、Bcl-2蛋白表达的关系 Spearman等级相关分析显示:膀胱癌组织中3种蛋白之间,HIF-1α与Survivin、HIF-1α与Bcl-2间表达均具有正相关性(r=0.4486,0.3428,P=0.0001,0.0042),Survivin 与Bcl-2之间表达无相关性(r=0.2016,P=0.0992)。
3 讨论
膀胱移行细胞癌是泌尿系统常见恶性肿瘤。虽然近年来有关该病的治疗取得了很大进展,但膀胱癌仍存在易复发的风险。且复发的膀胱癌往往病理分级更高、分期更晚、恶性程度更高,导致进一步转移,甚至危及患者生命[8]。而关于膀胱癌发生进展的机制目前尚未完全明确。寻找与膀胱癌发生发展关系密切的基因对确定肿瘤标志物、了解预后因素、确定生物治疗靶标有重要意义。HIF-1α是近期发现与膀胱癌关系密切的基因之一。恶性肿瘤在生长过程中快速增长,导致肿瘤局部缺氧,研究表明肿瘤体积一旦大于1 mm3,肿瘤就会处于缺氧状态,肿瘤细胞将高表达HIF-1α,促进下游多种基因的表达和转录,使肿瘤细胞适应缺氧的微环境。在前列腺癌、肺癌、肾癌、肝癌等多种恶性肿瘤中均检测到了高度表达的HIF-1α,而在正常组织中 HIF-1α无表达或弱表达[1-5]。本研究显示,HIF-1α在膀胱癌组织中表达与正常膀胱组织比较明显增强,且HIF-1α随病理分级、肿瘤分期进展而表达进一步增强。结果与其他报道[9,10]类似。说明 HIF-1α与膀胱癌发生密切相关,且随肿瘤恶性程度增高而表达增强,提示HIF-1α可能作为膀胱癌肿瘤标志物及复发预测因子。
恶性肿瘤细胞多具有较强的凋亡抵抗能力,这种能力使肿瘤细胞生存能力更强,是导致肿瘤进展的重要原因[11]。肿瘤凋亡抵抗形成过程中多种基因发挥了作用,Survivin、Bcl-2就是近年来受到关注的凋亡抵抗基因。Survivin是目前发现的IAP家族中最小的成员,可通过调控caspases表达直接抑制细胞凋亡[12];Bcl-2则通过线粒体途径影响下游基因而抑制肿瘤细胞凋亡[13]。本结果发现,Survivin、Bcl-2在膀胱癌组织中表达高于正常膀胱组织;Survivin随病理分级、肿瘤分期进展而表达进一步增强;病理分级高的膀胱癌组织的Bcl-2表达更强。这些结果与其他研究报道结果一致[14]。提示Survivin、Bcl-2可能通过调控肿瘤细胞的凋亡而参与了膀胱癌的进展。但本研究也显示,Bcl-2表达在初发癌和复发癌组织中差异并不明显,与其他报道有所不同[15]。我们认为这可能是由于我们的样本量较小造成的,但具体原因还有待于进一步研究。
已有研究证实,缺氧状态可导致恶性肿瘤细胞的凋亡抵抗能力增强,HIF-1α的过表达可导致Survivin、Bcl-2等基因的表达增高[6,7],但这种调控关系是否存在于膀胱癌中报道尚不多见。因此本研究进一步分析了膀胱癌组织中HIF-1α与Survivin、Bcl-2蛋白表达的关系。结果发现,HIF-1α与 Survivin、HIF-1α与Bcl-2蛋白之间均存在正相关关系,提示膀胱癌中HIF-1α可能通过调控Survivin、Bcl-2表达而抑制肿瘤细胞凋亡,从而导致肿瘤的进展。但具体机制和途径尚需体内、体外实验予以证实。
本研究初步证实了HIF-1α、Survivin、Bcl-2在膀胱癌组织中均存在表达增强,HIF-1α可能通过影响Survivin、Bcl-2表达而促进膀胱癌进展。但我们的研究还处于初级阶段,进一步扩大样本量并进行基础研究明确膀胱癌中HIF-1α、Survivin、Bcl-2之间的具体关系并开展针对膀胱癌HIF-1α基因的靶向治疗对膀胱癌治疗进展具有重要意义。
1 Thomas S,Harding MA,Smith SC,etal.CD24 Is an Effector of HIF-1-Driven Primary Tumor Growth and Metastasis.Cancer Res,2012,72:5600-5612.
2 Liu XQ,Xiong MH,etal.Therapeutic Delivery of siRNA Silencing HIF-1 Alpha with Micellar Nanoparticles Inhibits Hypoxic Tumor Growth.Mol Pharm,2012,9:2863-2874.
3 周锦堂,蔡志明,李宁忱,等.缺氧诱导因子lα和葡萄糖转运因子1蛋白在肾癌和膀胱癌组织表达的临床意义.中华医学杂志,2006,86:1970-1974.
4 Takala H,Saarnio J,Wiik H,etal.HIF-1α and VEGF are associated with disease progression in esophageal carcinoma.J Surg Res,2011,167:41-48.
5 Zheng Y,Shi X,Wang M,etal.Theincreased expression of DEC1 gene is related to HIF-1α protein in gastric cancer cell lines.Mol Biol Rep,2012,39:4229-4236.
6 Li G,Xie B,Li X,etal.Down-regulation of survivin and hypoxia-inducible factor-1αbyβ-elemene enhances the radiosensitivity of lung adenocarcinoma xenograft..Cancer Biother Radiopharm,2012,27:56-64.
7 Klymenko T,Brandenburg M,Morrow C,etal.The novel Bcl-2 inhibitor ABT-737 is more effective in hypoxia and is able to reverse hypoxia-induced drug resistance in neuroblastoma cells.Mol Cancer Ther,2011,10:2373-2383.
8 Librenjak D,Novakovi ZS,Milosti K.Carcinoma in situ of urinary bladder:incidence,treatment and clinical outcomes during ten-year followup.Acta Clin Croat,2012,51:201-207.
9 邓建华,白进良,马鹏程,等.谷胱甘肽转硫酶-Pi与缺氧诱导因子-1α在膀胱癌组织中的表达及其意义.癌症,2006,25:190-193.
10 彭晓晖,祖雄兵.缺氧诱导因子-1α和血管内皮生长因子在膀胱癌中的表达及其与微血管密度的关系.中国现代医学杂志,2009,19:2787-2789,2792.
11 Wong JC,Bathina M,Fiscus RR.Cyclic GMP/protein kinase G type-Iα(PKG-Iα)signaling pathway promotes CREB phosphorylation and maintains higher c-IAP1,livin,survivin,and Mcl-1 expression and the inhibition of PKG-Iαkinase activity synergizes with cisplatin in non-small cell lung cancer cells.JCell Biochem,2012,113:3587-3598.
12 McKenzie JA,Grossman D.Role of the apoptotic and mitotic regulator survivin in melanoma.Anticancer Res,2012,32:397-404.
13 Weyhenmeyer B,Murphy AC,Prehn JH,etal.Targeting the anti-apoptotic bcl-2 family members for the treatment of cancer.Exp Oncol,2012,34:192-199.
14 程瑞祥,马志强,杨书文,等.Survivin在膀胱癌中的研究进展.中国全科医学,2008,11:182-184.
15 陈兵海,杨建军,姚茂银.P-gp、MRP、Bcl-2、Bax在膀胱癌中的表达及其意义.东南大学学报(医学版),2007,26:279-282.
