Eu(III)在泥炭上的吸附行为研究
2013-10-10刘峙嵘张思纬文传玺吴振宇
刘峙嵘, 张 寰, 张思纬, 文传玺, 叶 榕, 吴振宇
(1.东华理工大学,江西抚州 344000;2.中核清原环境技术工程有限责任公司,北京 100037)
在稀土元素中,铕的化学性质最活泼,能燃烧成氧化物,与水作用放出氢气。其化合价有+2和+3价,二价盐无色,三价盐粉红色,氧化物近乎白色(宋金如等,2000)。由于其离子半径、化学价态,特别是它的电子组态在基态和电离状态都特别类似Am,因此,在研究极毒的放射性元素Am的化学行为时,都以Eu作为Am的类比物(Wang et al.,2004)。
辽宁具有丰富的泥炭资源,其煤化程度低,富含腐殖酸,是一种天然的有机离子交换剂和吸附剂。研究迟滞或阻止放射性核素从处置单元迁移到周围环境的工程设施或天然物质是一个很重要的课题,因此本实验中选取了辽宁新源的泥炭,作为处理放射性废水的吸附剂。
1 实验材料及实验方法
1.1 主要仪器与试剂
721E型分光光度计(上海光谱仪器有限公司);pH-3C精密酸度计(上海精密科学仪器有限公司);BS110S电子天平(北京赛多利斯天平有限公司);台式离心机(上海安亭科学仪器厂);SHA-C恒温振荡器(常州国华仪器有限公司);JXA-8100电子探针(日本电子公司);BELSORP-mini比表面积和孔径测定仪(日本BEL公司)。
三氧化二铕(分析纯,赣州市德施普新材料有限公司);Eu(III)标准溶液(HCl体系,4.4×10-4mol/L);偶氮胂III(分析纯,成都格雷西亚化学技术有限公司);腐殖酸(成都格雷西亚化学技术有限公司);泥炭(辽宁新源)。
1.2 实验步骤
Eu(III)在泥炭上的吸附分别在25℃,45℃,65℃下进行,一定量的吸附剂悬浮液、电解质溶液(CaCl2溶液、NaCl溶液等)、腐殖质溶液(HA溶液)、Eu(III)溶液依次加入聚乙烯试管中,加入适量去离子水达到试验所需试剂浓度。以微量HCl,NaOH溶液调节混合液pH至所需值。将混合液在一定温度下于振荡器上振荡至吸附-解吸平衡12 h,后以离心机在3 000 rpm转速下离心30 min。取一定体积的上清液,用分光光度法测定上清液中Eu(III)的浓度,以吸附平衡前后体系中核素浓度的差别来计算核素的吸附量。吸附率由下式计算:

式中C0为液相中Eu(III)的浓度(mol/L),Ce为平衡时液相中Eu(III)的浓度(mol/L)。
2 实验结果及讨论
2.1 样品表征
(1)泥炭的SEM表征。图1为泥炭原土的扫描电子显微镜(SEM)图像。由图1可见,泥炭表面形态复杂,存在大量孔隙结构,为吸附提供了大量点位,从而使泥炭具有很好的吸附性能。
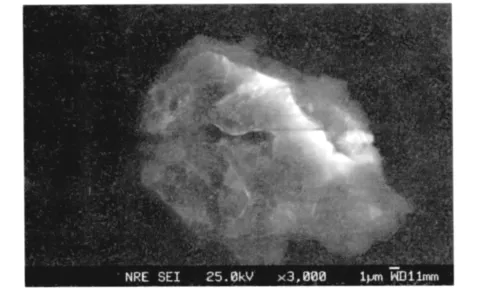
图1 泥炭的扫描电子显微镜图像Fig.1 SEM micrographs of peat
(2)泥炭的电子探针扫描和比表面积测定。通过N2-BET法测定泥炭的比表面积。测定的结果泥炭的比表面积为 1.666 8 m2g-1,平均孔径为2.023 nm。通过泥炭电子探针照片(图2),泥炭表面具有清晰的立体网状结构,根据扩散理论和固液界面吸附理论,金属离子在固体上的吸附速率取决于固体的比表面积(固体上吸附位的多少)、电性及吸附过程的逆过程的强弱。泥炭较大的比表面积可以使金属离子在泥炭上的吸附很快达到平衡。
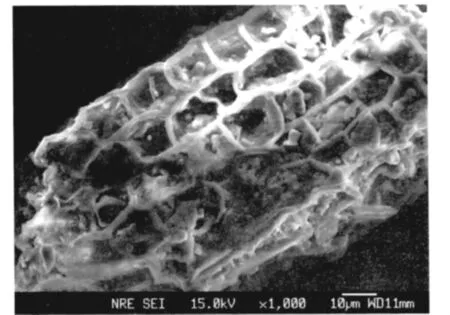
图2 泥炭的电子探针扫描Fig.2 EMPA of peat
2.2 Eu在水溶液中形态
Eu在溶液中的形态是影响吸附最重要的因素之一。Eu在水溶液中的存在形态较为复杂,在不同pH下不同形态所占的比例也是动态变化的。其在水溶液中的主要形态有 Eu3+,Eu(OH)2+,Eu(OH)2+,Eu(OH)3,Eu(OH)4-等,表1中列出了Eu在水溶液中参与的离子反应,以及相应的平衡常数(数据来自 Nagra/Psi Chemical Thermodynamic Data Base),使用 PHREEQC2.15软件进行模型计算,得到Eu在NaCl溶液中的形态分布图(图3)①许江,郭治军,吴王锁.2008.Eu(III)在Na基蒙脱石上的吸附/解吸研究.第二十六届化学会核化学与放射化学分会(天津).。Eu(OH)3的溶解度很大程度上由pH决定,其溶度积为log Kso=17.6,仅当pH>6时,才会产生水解。pH>6时,Eu(III)在水溶液中的形态非常复杂,Eu3+在pH<7时为主要存在形式,在pH>7后开始急剧下降,并在pH>9后完全转化为其他物种;EuOH2+以及Eu(OH)2+在pH≈6时开始出现,在pH=8时达到最大,之后开始减少,在pH约为10.5时消失;Eu(OH)3在 pH≈7.5是出现,在pH=10.5时出现最大值,在pH>10.5后逐渐转化为Eu(OH)4-。当CO2存在时,Eu3+则会与CO2反应生成EuCO3+,Eu(CO3)2+等形式,在 pH约为6时EuCO3+开始出现,当pH约为8时浓度达到最大,同时 Eu(CO3)2+出现,随着 pH的增加,Eu(CO3)2+开始成为Eu(Ⅲ)存在的主要形式。

表1 液相中Eu反应平衡常数Table 1 The reaction equilibrium constant of Eu in liquid phase
2.3 固液比影响

图3 Eu在0.1 mol/L NaCl溶液中的形态分布Fig.3 Speciation of Eu in 0.1 mol/L NaCl as a function of pH a.PCO2=0;b.P=26.65 Pa
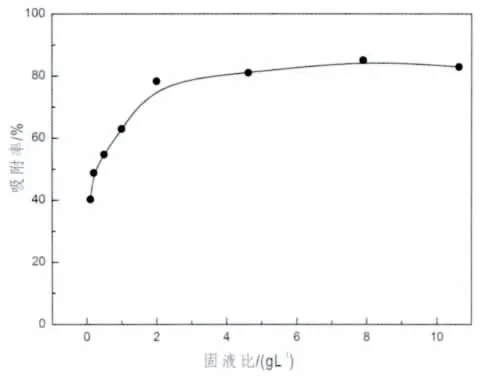
图4 固液比对铕吸附的影响Fig.4 Effect of solid -liquid ratio on the adsorption T=(25±1)℃ pH=(4.00±0.1),CEu(III)initial=5.5 ×10-5mol/L,I=0
图4是以吸附剂浓度(固液比,m/V)为条件的Eu(III)在泥炭上的吸附情况,由图可见,随着泥炭浓度(固液比)的增加,Eu(III)的吸附率增加,m/V为2 g/L时,吸附百分率即达约80%,在这之后,吸附百分率保持平衡。这是因为随着固液比增大,泥炭表面结合的吸附官能团增加,而更多的表面吸附位增大了泥炭的吸附能力(刘峙嵘等,2000)。当固液比进一步增大时,Eu(III)在固相和液相上的分配变化不大,说明随着固液比不断增大,竞争吸附也逐渐趋向平衡(Murali et al.,2002)。在m/V为0.5 g/L时,吸附达到50%左右,为更好地研究其他因素对吸附的影响,在之后的实验中采用m/V为0.5 g/L。
2.4 pH及离子强度对吸附的影响
图5a 为离子强度分别为 0.1 mol/L NaCl,0.01 mol/L NaCl时,pH对Eu(III)在泥炭上的吸附的影响。由图可见,Eu(III)的吸附受pH和离子强度影响极大。不同离子强度下,吸附在pH 2~4范围内吸附从20%急剧上升至80%,pH≈4时,吸附已经基本达到平衡,并且在pH>4时,维持在一个较高的平衡状态。这表明pH对Eu(III)的吸附影响强烈,可用泥炭表面的两性吸附来解释。Peat-OH可以通过质子化作用和去质子化作用变为两性基团(刘峙嵘等,2006):
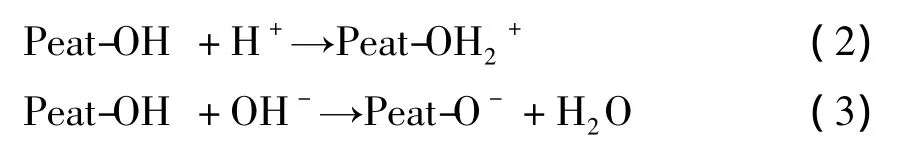
一般说来,在pH<pHpzc(pH电荷中性点),反应2占支配地位,使正电荷聚集在泥炭表面,在pH>pHpzc时,表面羟基则会电离出H+。随着pH的增加,反应3逐步占支配地位,带负电荷的peat-O-数量增大,从而能够吸附更多的Eu(III)。相较于离子强度为0的吸附曲线,在离子强度为0.01 mol/L NaCl时,pH越低,Eu(III)的吸附百分数越低,其原因为,在pH较低时,离子交换为吸附的主要机理,而Na+的存在将会与Eu(III)竞争吸附,从而导致吸附百分数的降低。在pH较高时,内层络合为主要机理,因此Na+所产生的影响相对较弱。
不同阳离子对Eu(III)在泥炭上的吸附影响见图5b。由图可知,在相同浓度下,Na+和Li+由于其离子半径接近,电荷量相同,对吸附的影响基本一致,相比较而言,因为K+水合半径较小,因此K+对吸附的影响较大。在低pH条件下,离子交换或外层络合是吸附的主要形式,阳离子的存在使泥炭表面电负性降低,从而使离子交换能力降低。同时,从 Cl-和 NO3-对吸附的影响结果看,一价阴离子对吸附的影响是相同的(图5c)。内层络合吸附是高pH时吸附的主要形式。不同离子对Eu(III)在泥炭上吸附的影响说明,内层络合受pH影响较大,而离子交换受离子强度的影响较大(Palágyi et al.,2009)。
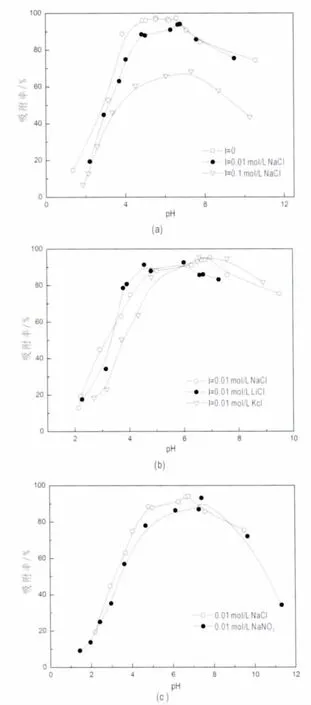
图5 pH及离子强度对铕吸附的影响Fig.5 Effect of pH and ionic strength on the adsorption C(Eu)0=5.5×10-5mol/L;T=(25±1)℃,m/V=0.5 g/L
一个有趣的发现是,在pH>8时吸附水平呈下降趋势,一种解释是与pHpzc有关,当pH>pHpzc时,泥炭表面呈电负性,而根据CO2存在的情况下,Eu(III)的物种分布图,可以看出在pH大于8时Eu(CO3)2-的量逐渐增加,逐渐成为Eu(III)的主要存在形式,二者呈电荷斥力,从而导致Eu(III)吸附量的下降。另一种解释,则是因为泥炭自身结构的问题,泥炭腐殖度较高,泥炭中含有大量呈球形质点的腐殖酸分子(胡金凌等,1999),在高pH情况下,腐殖酸将会对抑制Eu(III)吸附的进行。
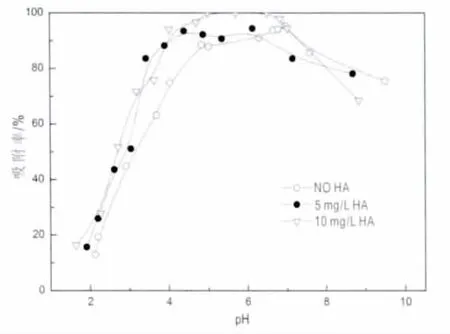
图6 HA对铕吸附的影响Fig.6 Effect of HA on sorption of Eu(III)to peat as a function of pH values
2.5 腐殖酸(HA)对吸附的影响
腐殖质在自然界中广泛存在,是一种对金属离子吸附有很强作用的有机质。金属离子和腐殖酸(HA)强烈的络合特性将会影响放射性核素在吸附剂表面的吸附机理和吸附形态。图6所示为不同浓度HA对泥炭吸附Eu(III)的影响。在低pH的情况下,HA对吸附有一定的促进作用,但并不是很明显,腐殖酸浓度增加,吸附效果也只是略微上升。之所以起到促进作用,是因为在酸性条件下,带负电的腐殖质很容易吸附在泥炭表面,提供更多的官能团包括羟基和酚与Eu(III)络合,但是促进作用并不明显的原因为泥炭自身腐殖度已经相当高,HA的存在并不会对其有较大的改变。必须注意的是,达到平衡一段时间后,在高pH的情况下,HA溶解度的增加将会降低Eu(III)在泥炭上的吸附。随着pH的增加,带负电的HA很难吸附在带负电的泥炭表面。水溶液中残留的HA将会形成可溶性络合物(如 HA-Eu(III)),这些络合物会与 Eu(III)竞争吸附位点,从而使高pH的情况下吸附水平下降。这个结果也许可以和图5中不存在HA,高pH水平的情况下,Eu(III)在泥炭上的吸附量下降相互印证。
2.6 吸附等温线
Eu(III)在泥炭上 25 ℃ (298.15K),45 ℃(318.15K),65 ℃ (338.15K)的吸附等温线见图7,吸附等温线位置最高为238.15 K,最低的为298.15 K。表明高温有利于Eu(III)在泥炭上的吸附。
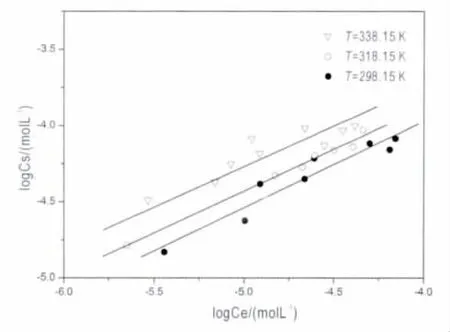
图7 三个温度下的Freundlich铕吸附等温线Fig.7 Freundlich isotherms for Eu(III)sorption on Ca-bentonite at three different temperatures

式中Ce为Eu(III)在液相的平衡浓度(mol/L);Cs为平衡时泥炭吸附Eu(III)的量(mol/g);Cm为平衡时最大吸附容量(mol/g);Kd为吸附反应平衡常数;a和 n为 Freundlich常数(Shahwan et al.,2004)。
根据实验结果,用Freundlich模型模拟体系的吸附等温线,并建立固相Eu(III)吸附量(Cs)与液相Eu(III)的浓度(Ce)之间的关系。随着温度升高,分配系数Kd随之增大,说明Eu(III)更多的由溶液向吸附剂迁移。
其中,由式
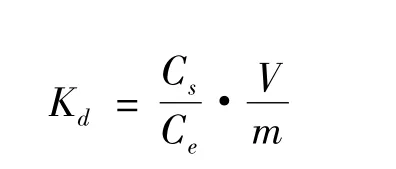
可计算得到三条吸附等温线下得Kd值。再通过实验,Eu(III)在peat上吸附的热力学函数由下式计算(Yang et al.,2009;Fanet al.,2010):
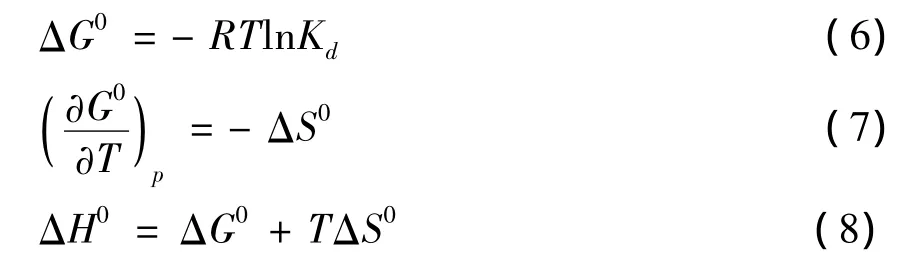
式中,R 为理想气体常数(8.314 5 J mol-1K-1),T为开氏温标温度(K)。上述热力学函数经计算后列于表2。
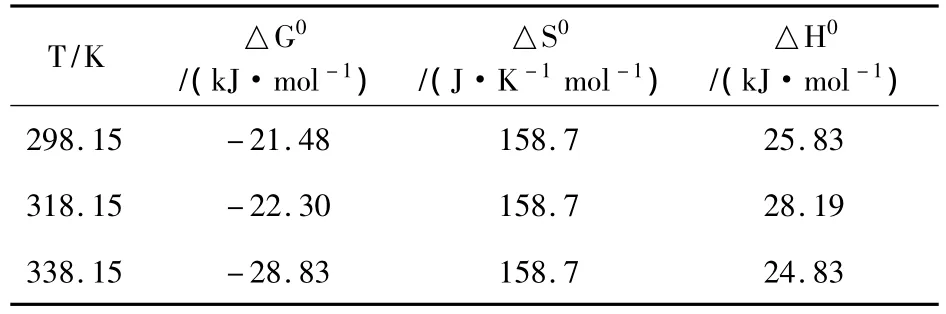
表2 Eu(III)在泥炭上吸附热力学函数值Table 2 Values of thermodynamic parameters for Eu(III)sorption on peat
由计算结果可知,三个温度下的标准焓变(△H0)都为正值,说明整个吸附过程都是吸热过程。这说明Eu(III)很好地溶于水中,其水合外鞘在吸附于泥炭之前就被破坏,这就是为什么脱水过程需要能量而且随着温度升高达到平衡时间缩短的原因。这一能量超过了阳离子吸附于吸附剂表面所释放的热量。此种理论表明去溶剂化过程所吸收的热量在相当的范围内高于吸附热。在338.15 K(45℃)时的△H0值是三个温度中最小的,这说明随着温度的升高,反应逐步趋向平衡,并且温度的影响变得越来越小了。在实验条件下,吸附是一个自发过程,因为反应的吉布斯自由能变(△G0)是负值。随着温度升高,△G0的绝对值变得更大,并且如所预想的一样对吸附更有加强。在高温下,阳离子更容易去溶剂化,因此更容易被吸附。吸附过程的熵都为正值,反映出在溶液中存在泥炭对Eu(III)吸引力,并且在吸附剂上存在结构的改变(Humelnicu et al.,2006)。
3 结论
(1)Eu(III)在泥炭上的吸附受pH影响较大,在pH<4时,吸附随pH的升高而增强,且在pH>4后基本维持不变。
(2)离子强度对吸附过程有着一定的影响,离子强度的增加会抑制吸附的进行,K+的影响大于Na+和Li+,一价阴离子的影响较为一致。
(3)在较低pH时,HA的存在能够促进泥炭对Eu(III)的吸附,而在高pH下,HA却对吸附起抑制作用。
(4)由热力学函数计算结果,可见Eu(III)在泥炭上的吸附是吸热且自发的过程。
胡金凌,林彬,王艳华,等.1999.用泥炭从溶液中吸附铜、锌、铅离子[J].沈阳化工学院学报,13(2):132-138.
刘峙嵘,康文,王作举,等.2000.R-519树脂吸附铼的性能研究[J].华东地质学院学报,23(4):286-288.
刘峙嵘,韦鹏,王云,等.2006.泥煤对稀土元素铈、镝、铕的吸附性能研究[J].中国矿业,15(3):62-66.
宋金如,龚治湘,余锴纯.2000.P507萃淋树脂吸附稀土的性能研究及应用[J].华东地质学院学报,23(4):351-355.
Fan Q H,Zhang M L,Zhang Y Y,et al.2010.Sorption of Eu(III)and Am(III)on attapulgite:effect of pH,ionic strength and fulvic acid[J].Radiochimica Acta,98(1):19-25.
Humelnicu D,Drochioiu G,Sturza M I,et al.2006.Kinetic and thermodynamic aspects of U(VI)and Th(IV)sorption on a zeolitic volcanic tuff[J].Journal of Radioanalytical and Nuclear Chemistry,270(3):637-640.
Murali M S,Mathur J N.2002.Sorption characteristics of Am(III),Sr(II)and Cs(I)on bentonite and granite[J].Journal of Radioanalytical and Nuclear Chemistry,254(1):129-136.
PalágyiŠ,Vodi?kováH,Landa J,et al.2009.Migration and sorption of137Cs and152,154Eu in crushed crystalline rocks under dynamic conditions[J].Journal of Radioanalytical and Nuclear Chemistry,279(2):431-441.
Shahwan T,Erten H N.2004.Temperature effects in barium sorption on natural kaolinite and chlorite-illite clays[J].Journal of Radioanalytical and Nuclear Chemistry,260(1):43-48.
Wang X K,Chen Y X,Wu Y C.2004.Diffusion of Eu(III)in compacted bentonite-effect of pH,solution concentration and humic acid[J].Applied Radiation and Isotopes,60(6):963-969.
Yang S T,Li J X,Lu Y,et al.2009.Sorption of Ni(II)on GMZ bentonite:Effects of pH,ionic strength,foreign ions,humic acid and temperature[J].Applied Radiation and Isotopes,67(9):1600-1608.
