乳酸菌素对兔离体回肠运动的影响
2013-10-10詹生威
詹生威
(大田县畜牧兽医水产中心,福建 三明 366100)
目前由于大量应用和滥用抗生素,造成了动物肠道菌群严重失调,多种抗药菌株大量出现,造成动物体对各种疾病的抵抗力降低,同时,因抗生素的大量应用,造成畜产品中残留增加、环境的污染。因而,抗生素等药物的大量应用造成的弊端已成为畜牧业可持续发展的一个严峻的问题。乳酸杆菌等益生素菌株的分离成功,使我们对于抗生素问题的解决充满了希望,大量的试验结果表明,乳酸菌素对动物体具有免疫增强、营养、抗御病原体的侵害等作用[1]。
乳酸菌素与动物的关系十分密切。应用乳酸菌素的发酵机理和生物学特性所制成的发酵饲料,由于风味独特,营养全面,易于消化,原料广泛,以及对肠道腐败菌和病原菌独特的抑制作用,使它成为我国饲料行业发展的又一新趋势[2]。仔猪在出生24h内空肠、回肠、盲肠和直肠就定植了分歧杆菌、大肠杆菌、乳酸杆菌、消化球菌、类杆菌、肠球菌、真杆菌和酵母菌等,其中前5种占优势[3]。当仔猪处于应激状态如断奶转群、饲料突变、环境温度、卫生等的影响及长期使用抗菌药物时,这种菌群动态平衡被打破,可能造成有害菌大量增殖,导致腹泻等疾病的发生。乳酸菌素能降低胃肠道pH[4,5],使乳酸菌素在肠道中大量增殖并产生的代谢产物,可以控制病原菌在胃肠道中繁殖,减轻下痢的困扰[6,7]。本试验旨在为乳酸菌素在畜牧生产上的应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 试剂
1.1.1.1 台氏液(Tyrode液)[8](现配现用)
用电子天平准确称取NaCl8g,KCl0.2g,CaCl20.2g,NaHCO31.0g,MgCl20.1g,NaH2PO40.05g,葡萄糖1.0g,配制时先用蒸馏水将上述各种成分分别溶解后,再逐一混合,CaCl2最后加入混合,再加蒸馏水至1000mL。葡萄糖临用前加入,以免细菌生长。
1.1.1.2 乳酸菌素溶液
乳酸菌素(麦仑厦门生物有限公司),用电子天平准确称量1g乳酸菌素,加入配好的500mL台式液中,充分溶解搅拌制得2000ppm的乳酸菌素备用。
1.1.1.3 肾上腺素与新斯的明溶液
分别购买福州海王福药制药有限公司生产的肾上腺素和上海信宜金朱药业有限公司生产的新斯的明各一盒。
1.1.2 试验仪器
生物机能实验系统(成都泰盟科技有限公司生产,BL-420E+),恒温平滑肌槽(成都泰盟科技有限公司生产,HW-400S),肌张力换能器(北京航天医学研究所生产,JH-2)。
1.1.3 试验动物
健康家兔4只(2~3kg),购自福建农林大学,共取回肠8段。
1.2 试验方法
1.2.1 离体回肠的制备
将购回的健康家兔禁食12h,试验时用注射空气法给家兔进行耳缘静脉空气注射,待其死亡后,立即剖开腹腔沿肠系膜缘分离取出回肠,并用台氏液洗净肠内容物,制成约3cm长的肠管数段,立即放入盛有4℃台氏液的小烧杯中,备用。取一段回肠,置入含20mL、38℃台氏液的HW-400S恒温平滑肌槽中,从槽底持续通入空气以供给肠管足够的氧。将回肠段下端固定在金属小钩上,上端用丝线系住轻轻地挂在张力换能器的金属片上,张力换能器输出端与BL-420E+生物信号采集处理系统的输入接口连接,记录回肠段张力的变化。水浴温度38℃,每15min更换1次台氏液。
1.2.2 试验步骤
1.2.2.1 试验分为对照组、5个试验剂量乳酸菌素组,共6组。采用累加方法于恒温平滑肌槽浴管内,依次加入配制好的乳酸菌素溶液0.2mL,组成5个试验剂量乳酸菌素组。浴管内含20mL台氏液,因此直接作用于离体回肠的乳酸菌素浓度分别为20ppm(试验A组)、40ppm(试验B组)、60ppm(试验C组)、80ppm(试验D组)和100ppm(试验E组)。
1.2.2.2 于恒温平滑肌槽浴管内,分别加入0.01%肾上腺素溶液0.2mL,0.01%新斯的明溶液0.2mL。
1.2.2.3 试验开始前,先使回肠标本在lg静止张力下平衡15min。观察正常情况下离体肠管的自主收缩情况5min,然后向浴管中逐次加入乳酸菌素溶液,分别记录在不同浓度下离体回肠平滑肌的收缩情况(张力及频率的变化)。在试验过程中,台氏液的温度始终保持在(38±0.5)℃,并注意恒速和不间断通入空气。
1.2.3 统计学分析
试验采用单因素方差分析[9]。数据结果采用SPSS1 1.5统计软件包分析,结果用表示。
2 结果与分析
2.1 乳酸菌素对兔离体回肠收缩运动的影响
离体回肠在1g张力下,台氏液中静置15min后,回肠平滑肌呈现规则的抛物线曲线运动,分别添加不同浓度乳酸菌素溶液对离体回肠收缩曲线的影响,见图1~6。

图1 一般状态下兔回肠收缩运动
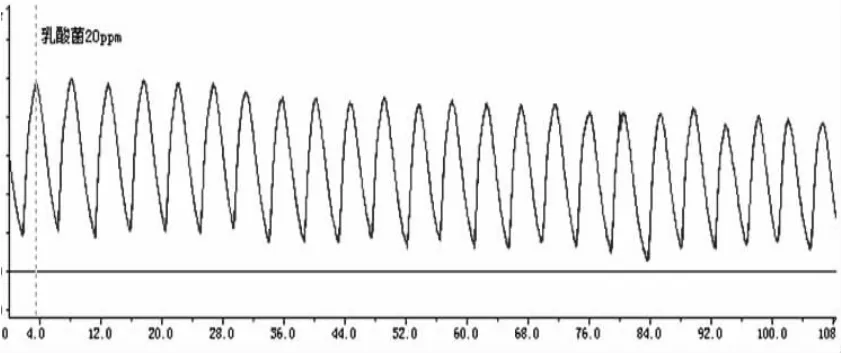
图2 20ppm乳酸菌素对回肠收缩运动的影响
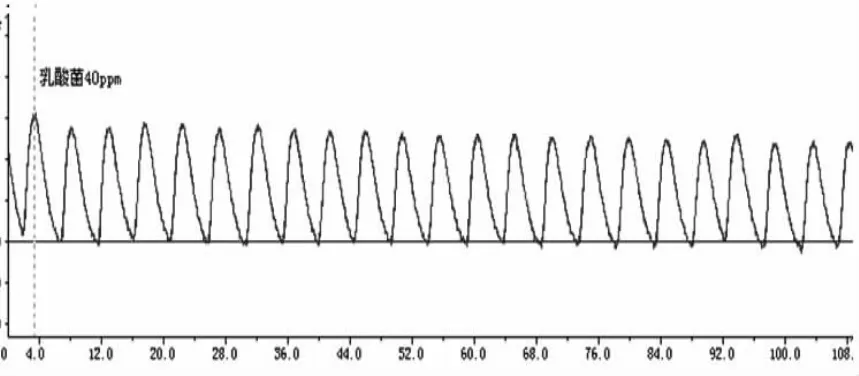
图3 40ppm乳酸菌素对回肠收缩运动的影响
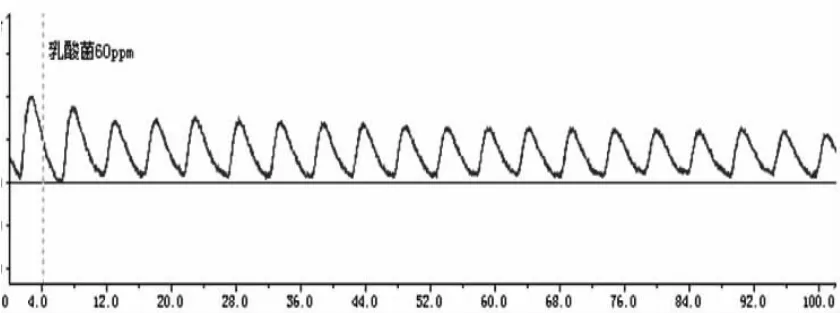
图4 60ppm乳酸菌素对回肠收缩运动的影响

图5 80ppm乳酸菌素对回肠收缩运动的影响
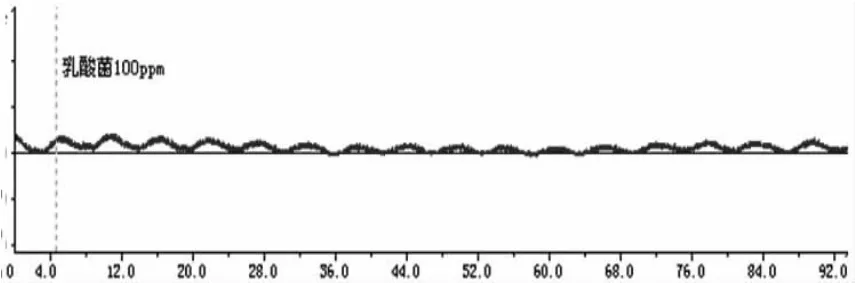
图6 100ppm乳酸菌素对回肠收缩运动的影响
从图1~6可看出,回肠在不同浓度的乳酸菌素溶液中,收缩张力呈递减的趋势;频率也略有减缓。
2.1.1 乳酸菌素溶液对兔离体回肠收缩张力的影响
乳酸菌素溶液对离体兔回肠收缩活动的影响见表1和图7,结果表明:试验A组、试验B组、试验C组、试验D组和试验E组的兔回肠平滑肌的收缩张力均显著地低于对照组(P<0.05),除试验C组与试验D组及试验D组与试验E组之间差异不显著(P>0.05)外,其余各试验组间差异均显著(P<0.05)。

表1 乳酸菌素溶液对兔离体回肠平滑肌收缩活动的影响

图7 乳酸菌素溶液对兔离体回肠收缩张力的影响
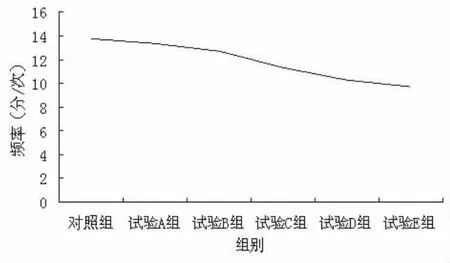
图8 乳酸菌素溶液对兔离体回肠收缩频率的影响
2.1.2 乳酸菌素溶液对兔离体回肠收缩频率的影响
乳酸菌素溶液对离体兔回肠生理收缩频率的影响见表1和图8,结果表明:试验A组、试验B组、试验C组、试验D组和试验E组的兔回肠平滑肌的收缩频率均显著低于对照组(P<0.05),但除试验A组与试验E组差异显著(P<0.05)外,其余各试验组间差异均不显著(P>0.05)。
2.2 肾上腺素与新斯的明对兔离体回肠收缩活动的影响
离体回肠在1g张力下,台氏液中静置15min后,回肠平滑肌呈现规则的抛物线曲线运动,分别将离体回肠置于肾上腺素与新斯的明中对离体回肠收缩曲线的影响,见图9、图10。

图9 肾上腺素对回肠收缩运动的影响
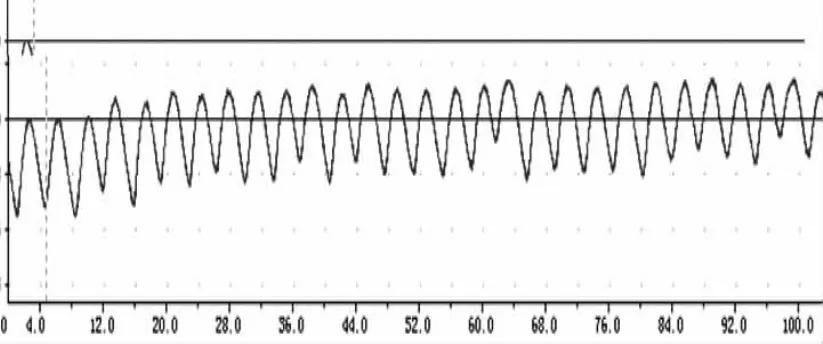
图10 新斯的明对回肠收缩运动的影响
由图9、图10可看出新斯的明对兔回肠有增强其收缩幅度及频率的作用,肾上腺素对兔回肠有降低其收缩幅度及频率的作用。
3 讨论
肠道除了作为吸收营养物质的重要组织外,还具有保护机体免受外来病原菌和有害物质的损害的屏障作用。肠致病菌黏附于肠上皮细胞后可以使肠黏膜细胞刷状缘绒毛局部变性,胞膜形成杯状结构,而乳酸菌素具有维持肠黏膜的完整性的作用[10]。乳酸菌素作为一类食品级的对人体健康有益的菌群,其提高机体免疫功能等重要作用已得到较为充分的肯定。有研究资料表明,乳酸菌素的细胞壁肽聚糖和胞外多糖能促进体外脾淋巴细胞的增殖活化,提高巨噬细胸吞噬异物的能力,增加体外NK细胞的活性[11]。
乳酸菌素是微生态制剂,能调节胃肠道正常菌群、维持微生态平衡,从而改善肠道功能;提高食物的消化率和生物效价;降低血清胆固醇,控制内毒素;抑制肠道内腐败菌生长;提高机体免疫力乳酸菌素通过酵解产生有机酸特殊酶系等[12]。细胞表面成分等物质具有生理功能,可刺激组织发育。对机体的营养状态、生理功能、细胞感染、毒性反应、免疫反应、肿瘤发生、衰老过程和应激反应等产生作用。肠道内有益菌是防止致病菌入侵的屏障基础,厌氧菌与黏膜上皮结合紧密,形成生物膜,使外来菌没有吸附位置而被排出。若厌氧菌与黏膜上皮的结合位点特异性不强时,可结合部分致病菌,正常菌在数目上保持优势可将结合位点竞争过来[13]。
菌群在肠道内的定植是通过细菌的黏附作用来实现的。乳酸菌素进人肠道能否黏附于宿主某段肠道的粘膜细胞表面,形成稳定的优势菌群,是决定这种益生素实际效果的重要因素[14]。目前益生菌的选择大多着眼于益生菌的代谢产物乳酸和细菌素可以较好的抑制病原菌的生长方面,而忽视了乳酸菌素主要在动物肠道后段起作用,黏附作用是其作用机制中最重要的一种,许多体外试验也表明乳酸菌素可以抑制病原菌对动物肠粘膜细胞的黏附。
本试验结果表明,与对照组相比,乳酸菌素能显著减少回肠平滑肌的张力及肠道蠕动的频率。现已证明,胃肠运动的调节由交感神经、副交感神经系统控制。目前研究认为胃肠道上主要存在胆碱能M受体、肾上腺素α和β受体、组胺受体、5-HT受体及多种胃肠激素受体。乙酰胆碱是平滑肌内兴奋传递的化学物质,能激动M胆碱能受体,兴奋胃肠道,从而增加肠管的收缩幅度和张力,而CaCl2是通过释放细胞内的Ca而引起肠管平滑肌痉挛。本试验可能是拮抗乙酰胆碱和CaCl2,所致回肠平滑肌抑制的作用,表明乳酸菌素对肠管的抑制作用可能由胆碱受体介导,或直接作用于肠道平滑肌,具有钙拮抗作用[15]。乳酸菌素能抑制肠道的蠕动,增加了肠道对内容物的吸收时间,从而使吸收更加充分,同时抑制肠道蠕动又能对动物的下痢有一定的抑制作用。
[1]闫磊,王毳,曾庆祝,等.双歧杆菌的功能特性及其应用前景[J]现代食品科技,2006,93(3):81~83.
[2]林述成,彭风清,彭万仁.乳酸茵和乳酸饲料[J].川北教育学院学报,1996,6(23):47~48.
[3]崔赢佩.猪肠道菌群对其发育的影响[J].养殖天地,2008(10):35~36.
[4]刘金萍,王士长.植物乳杆菌N3发酵断奶仔猪料对饲料pH值及菌群的影响[J].饲料工业,2009,30(17):18~19.
[5]吴惠芬,毛胜勇,姚文.猪源乳酸菌产乳酸及其抑菌特性研究[J]微生物学通报,2005,32(1):79~80.
[6]程宝生.乳酸在养殖业上的应用[J].饲料饲草,2006(6):18~19.
[7]陈炜.断奶仔猪易患腹泻原因分析及防治措施[J].养殖与饲料,2009(12),18~20.
[8]徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,1982:562.
[9]明道绪.生物统计.附实验设计[M].北京:中国农业出版社,2002:112~116.
[10]Adams.1999.The safety of lactic acid bacteria [J].Journal of-Biotechnology,68:171~178.
[11]陈壁锋,黄俊明,黄建康,等.活性乳酸菌素乳饮品对免疫调节功能的影响[J].广州食品工业科技,2006(77):30~32.
[12]Gill H S.1998.Stimulation.of the immune system by lacticcultures[J].International Dairy Science,8:535~544.
[13]姜旭德,游进,王春华.乳酸菌在畜牧业的应用[J].畜牧兽医科技信息,2007(8):28~29.
[14]王文梅,许丽,王秋菊.乳酸菌素对动物肠道的黏附作用研究进展[J].东北农业大学学报,2009,4(12):120~124.
[15]阿孜古力·吾司曼,古丽仙·胡加,买尔旦·马合木提,等.沙枣水提物对豚鼠离体回肠平滑肌运动的影响[J].新疆医科大学学报,2009,32(5):562~564.
