增加一反应物浓度,另一反应物的转化率一定增大吗?
2013-10-09胡建树
胡建树
(江西省南康中学 江西 南康 341400)
很多人都认为增加一反应物的浓度,另一反应物的转化率一定增大,而自身的转化率却降低。在平时的教学中,也有老师明确指出:增加一反应物浓度,平衡向正反应方向移动,另一反应物的转化率必然增大,学生也就深信不疑的接受这一规律。该解释听起来似乎合情合理,经仔细推敲发现,这一规律是片面的,不准确的,甚至是错误的。下面以实例进行剖析。
题目:在一定温度和压强的密闭容器中加入一定量的 N2和 H2,使反应 N2(g)+3H2(g)⇌2NH3(g) 达到平衡。保持容器内的温度和压强不变,向平衡体系中加入少量的N2,再次达到平衡时H2的转化率如何变化,说明理由。
一、数据分析
假设反应达到平衡时N2、H2和NH3的物质的量各为a mol、b mol、c mol。为计算和书写方便,设该温度和压强下的摩尔体积为 Vm=1 mol·L-1。
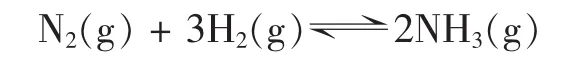
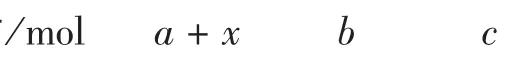
二、理论探讨
在恒温恒压下,增加一种反应物的浓度,为何另一反应物的转化率可能增大,也可能减小或不变呢,我们可以用勒夏特列原理来分析(如果改变影响平衡的多个条件,应分别分析,综合判断)。
当加入少量N2时,要保持恒温恒压,体积必然增大,导致H2和NH3浓度同等倍数减小。根据勒夏特列原理:(1)加入少量N2,N2浓度增大,平衡向正反应方向移动;(2)H2和NH3的浓度同等倍数减小,它们共同影响着平衡移动的方向:H2浓度减小使平衡向逆反应方向移动,NH3浓度减小使平衡向正反应方向移动,因H2的化学计量数大于NH3的化学计量数,所以H2浓度的变化对化学平衡的移动占主要因素,故H2和NH3的浓度同等倍数减小使平衡向逆反应方向移动。综合(1)和(2)两个相反结论:加入少量N2,平衡可能向正反应方向移动,也可能向逆反应方向移动或不移动,从而导致H2的转化率可能增大,也可能减小或不变。
由此,也可以根据勒夏特列原理快速判断平衡移动的方向及另一反应物的转化率变化情况。
在恒温恒压的密闭容器中进行如下反应:aA(g)+bB(g)c⇌C(g)+dD(g),反应达到平衡,保持容器内的温度和压强不变,加入少量A(g),反应物B(g)的转化率如何变化。
根据勒夏特列原理:(1)加入少量A,A浓度增大,平衡向正反应方向移动;
(2)B、C和D的浓度同等倍数减小,B浓度减小导致平衡向逆反应方向移动,C和D浓度减小导致平衡向正反应方向移动,这三种物质浓度减小共同影响着平衡的移动。至于平衡如何移动,就要看B、C、D它们的化学计量数的关系:
①当b=c+d时,B、C和D的浓度同等倍数减小,共同影响的结果是平衡不移动。再结合(1),原平衡必然向正反应方向移动,从而B(g)的转化率增大;
②当b<c+d时,B、C和D的浓度同等倍数减小共同影响的结果是平衡向正反应方向移动,再结合(1),原平衡一定向正反应方向移动,从而B(g)的转化率增大;
③当b>c+d时,B、C和D的浓度同等倍数减小共同影响的结果是平衡向逆反应方向移动,再结合(1),平衡可能向正反应方向移动,也可能向逆反应方向移动或不移动,从而导致B(g)的转化率可能增大,也可能减小或不变。
若上题中“向平衡体系中加入少量的N2”改为“加入少量的H2”,则N2的转化率如何变化?
根据勒夏特列原理:(1)加入少量H2,H2浓度增大,平衡向正反应方向移动;
(2)N2和NH3的浓度同等倍数减小,因N2的化学计量数1<NH3的化学计量数2,N2和NH3的浓度同等倍数减小,共同影响的结果是平衡向正反应方向移动,再结合(1),原平衡一定向正反应方向移动,从而N2的转化率一定增大。
根据数据分析得出同样的结果,本文从略。
三、结论和反思
综上所述,增加一种反应物的浓度,另一反应物的转化率不一定增大,应根据情况作具体分析:(1)在恒温恒容的密闭容器中增加一反应物的浓度,另一反应物的转化率一定增大;(2)在恒温恒压的密闭容器中增加一反应物的浓度,另一反应物的转化率可能增大,也可能减小或不变。
所以在分析问题时,我们可以设置问题情景,利用学生的认知冲突来提高学生的问题处理能力。在学习理论和规律时,应该辩证的对待,不能完全依赖惯性思维,它常常会将我们带入误区。
参考资料
[1] 姚志红.剖析因平衡移动导致体积分数的变化[J].中学化学教学参考,2007,(4):35
