应用生物反应器培养猪传染性胃肠炎病毒
2013-10-09邱文英方鹏飞胥燕芳潘华柱郝伟伟
邱文英,方鹏飞,胥燕芳,潘华柱,徐 静,郝伟伟
(四川省华派生物制药有限公司,四川简阳 641400)
猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)为冠状病毒科冠状病毒属成员,有囊膜,具多形性,病毒的成熟发生于细胞浆中[1]。该病毒可引发猪传染性胃肠炎(Transmissible gastroenteritis,TGE),猪感染后主要出现严重呕吐、腹泻和脱水等特征。
目前疫苗用TGEV的培养多采用ST传代细胞[2],而传统的ST细胞培养方式多采用克氏瓶及转瓶,该方法存在病毒生产率低、生产成本高、劳动强度大等缺点,因此克氏瓶及转瓶培养技术已不能完全满足现代生物疫苗生产的要求。1967年Wezel首次成功的应用DEAE Sephadex A50作载体实现兔原代细胞、人二倍体细胞等的悬浮培养[3],此后世界各国都陆续投入到细胞的微载体培养研究。应用生物反应器系统和微载体培养贴壁细胞具有高比表面积、细胞产量高,便于监测、控制和取样,生产规模容易放大,不易染菌等优点[4]。同时,生物反应器可减少生产人员,提高生产效率,无论人用还是兽用疫苗领域均在开展生物反应器制备疫苗的生产工艺摸索[5-6]。
研究使用7 L生物反应器进行TGEV的培养,旨在进行生物反应器培养TGEV工艺的摸索,为进一步使用大容积生物反应器进行TGEV的培养奠定基础。
1 材料与方法
1.1 种毒 TGEV由四川省华派生物制药有限公司分离及保存。
1.2 ST细胞 中国典型培养物保藏中心。
1.3 生物反应器及微载体 7 L生物反应器,广州齐志生物设备有限公司,微载体CytodexⅠ,GE公司。1.4 血清及试剂 新生牛血清,杭州市四季青生物工程材料研究所,MEM,宜兴市赛尔生物科技有限公司,胰酶,Gibco公司。
1.5 ST细胞在生物反应器上的培养 将微载体加入至 7 L生物反应器中(2012001,3 g/L;2012002,6 g/L;2012003,9 g/L),并将消化后的 ST细胞加入至反应器中。将细胞培养条件设置为:培养温度,37℃;pH值7.2;溶氧为50%空气饱和度;搅拌速度40 r/min;培养体积4 L。每批均采用灌流方式进行培养,根据细胞生长状况调节灌流速度。每日取样使用胰酶进行细胞的消化,以确定细胞生长密度。
1.6 TGEV在生物反应器上的培养 待微载体上的细胞长满至单层后,将培养基更换为细胞维持液,接种TGEV毒种,培养体积为5 L。采用灌流方式进行培养,细胞开始出现病变后,每隔3 h取样进行TCID50的测定,细胞病变至80%时收获病毒液。
1.7 TGEV在转瓶上的培养 将消化后的ST细胞加入至15 L转瓶中,放至37℃进行培养。待细胞长满至单层后,倾弃培养液,加入1.2 L细胞培养液,并加入TGEV液。每隔3 h取样进行TCID50的测定,当细胞病变至80%时收获病毒液。
1.8 TCID50测定 将样品用培养液作10倍系列稀释,取 10-5、10-6、10-7、10-8稀释度接种至 ST 单层细胞中。120 h后观察结果,计算病毒的TCID50。
2 结果
2.1 ST细胞在生物反应器上的培养 经过72 h的培养,细胞长满至单层。接种细胞至微载体后6 h细胞贴壁,三次培养细胞的最高密度分别为2.14×106个/mL,1.83 ×106个/mL,2.02 ×106个/mL(图1)。3批培养细胞的种子细胞数量不同,但采用相同的参数进行控制,3批细胞的最大细胞密度及达到最大细胞密度的时间有所不同。这表明细胞种子量对细胞生长及细胞密度有重要的影响,这与王建超[6]和李平忠[8]报道的使用生物反应器进行Vero细胞的培养结果一致。
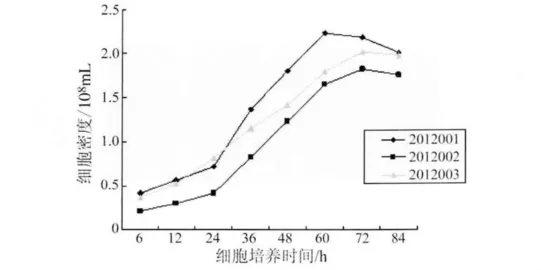
图1 生物反应器中ST细胞生长情况
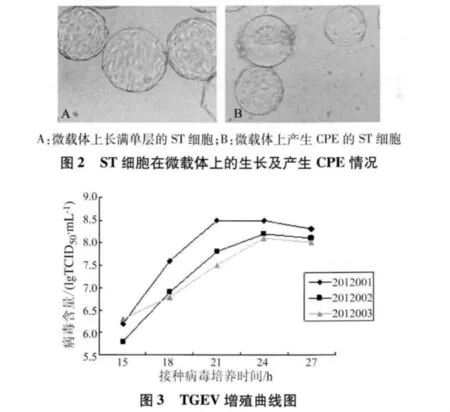
2.2 TGEV在生物反应器上的培养 3次使用生物反应器培养TGEV的过程中,接种病毒15 h左右,ST细胞病变开始出现病变,接种21~24 h细胞病变至60% ~70%,此时TGEV含量达到最高,均大于108.0TCID50/mL,接种病毒27 h左右后细胞病变达到80%左右,TCID50略有下降,但TGEV含量仍大于108.0TCID50/mL(见图3)。3次培养均收获5 L病毒液。
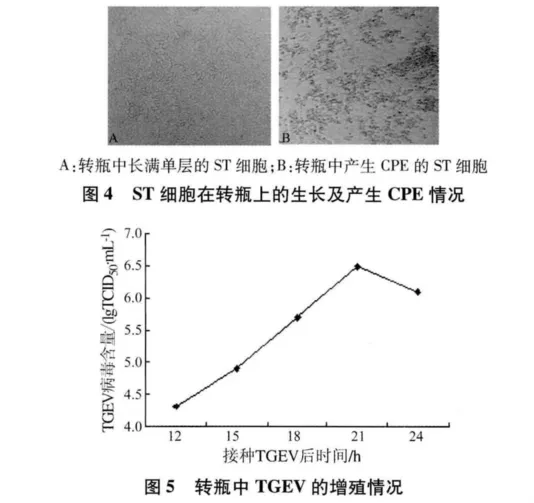
2.3 TGEV在转瓶上的培养 接种TGEV后12 h时细胞开始出现病变,此时测定病毒含量为104.3TCID50/mL,21 h左右时细胞病变达到80%左右,测定病毒含量为106.5TCID50/mL,病毒含量最高,24 h后病毒含量开始下降(见图5)。每个转瓶收获1.2 L病毒液。
3 讨论
60年代起中国开始出现TGE的报道,近些年来有进一步流行的趋势,尤其是冬季和早春寒冷季节常呈地方性暴发流行,TGEV仍是现今引起仔猪发病和死亡的主要原因之一,给养猪业造成极大困扰[9,10]。目前对于 TGEV仍缺乏有效的临床治疗药物,采用疫苗免疫接种是主要的预防措施。在培养细胞制备弱毒疫苗时,传统方式一般采用转瓶培养TGEV,但转瓶培养过程中pH值、营养液成分随时间而发生变化,这可能是造成病毒含量不能进一步提高的原因。生物反应器能较好地控制温度、溶氧及pH值等,使病毒在更加稳定的环境中进行增殖,加之连续进行的灌流培养,使营养物质不断得到补充,代谢废物不断移出,使培养环境相对稳定,因而细胞密度和病毒的产量都大大提高。
正是由于生物反应器较转瓶培养的优越性,生物反应器系统得到广泛研究,以便应用于人用及兽用疫苗生产中,如狂犬病病毒[6],甲型肝炎病毒[11],圆环病毒[12]等,均在研究中取得了较为理想的结果。本试验采用生物反应器及微载体系统进行TGEV的培养,培养的TGEV含量明显高于转瓶培养。试验中使用7 L的生物反应器可一次性生产收获5 L病毒液,所得TGEV抗原约相当于132个转瓶培养所得到得抗原。同时,7 L生物反应器可作为更大体积生物反应器的种子罐,因此试验也为使用更大体积的生物反应器培养TGEV奠定了一定基础。
生物反应器通常采用全封闭管道化操作及全自动化监控,可以有效降低细胞的污染率及人为因素造成的影响,另外生物反应器容积较大,可使终端产品更加均一,同时结合后期纯化工艺,不但产品产量明显提高,而且产品的质量更加稳定,生物反应器的大规模使用将成为一种必然趋势。
[1] 陈溥言.兽医传染性病学[M].北京:中国农业出版社,2006,225-228.
[2] 斯特劳,阿莱尔,蒙加林,等.猪病学[M].北京:中国农业大学出版社,2000,316 -319.
[3] 何孔旺,林继煌,还红华,等.猪传染性胃肠炎病毒弱毒株STc3细胞培养特性及致病性研究[J].中国兽医科技,2001,31(8):8-9.
[4] Van Wezel.Growth of cell strains and primary cells onmicrocarriers[J].Nature,1967,216:64 -65.
[5] Perrin P,Madhusudana S,Gontier- Jallet C,et al.An experimental rabies vaccine produced with a new BHK-21 suspension cell culture process:use of serum free medium and perfusion reactor system[J].Vaccine,1995,13(13):1244 -1250.
[6] 李平忠,沈 伟,余 芬,等.用微载体培养Vero细胞制备狂犬疫苗[J].第三军医大学学报,2006,28(23):2374 -2376.
[7] 石 岗,王宏俊,孙惠玲.利用生物反应器和Vero细胞培养鸡传染性法氏囊病病毒的研究[J].中国农业科学,2002,35(9):1134-1138.
[8] 王建超,周 燕,华 平,等.应用生物反应器和微载体培养Vero细胞生产猪流行性腹泻病毒的研究[J].畜牧兽医学报,2003,34(6):573 -376.
[9] Sirinarumitr T,Siddell S,Grahare F,et al.Porcine transmissible gastroenteritis virus induced apoptosis in swine testes cell cultures[J].Archives of Virology,1998,143(12):2471 - 2485.
[10] Jones T,Shenk T.Transmissible gastroenteristis virus of pigs[J].Veterinary Record,1997,141(16):427 -428.
[11]孙明波,李国良,李卫东,等.应用生物反应器培养Vero细胞制备甲肝病毒[J].第三军医大学学报,2003,25(4):740-741.
[12]何锡忠,李春华,倪建平,等.用微载体系统培养PK15细胞生产猪圆环病毒[J].上海农业学报,2010,26(4):149 -151.
