一氧化氮抑制甘氨鹅脱氧胆酸诱导A549细胞凋亡的实验研究*
2013-09-26胡章雪赵锦宁
荔 蕊,胡章雪,赵锦宁,汪 丽,刘 蕾,史 源
(第三军医大学大坪医院野战外科研究所儿科,重庆 400042)
新生儿呼吸窘迫综合征(neonate respiratory distress syndrome,NRDS)是一类重要的新生儿疾病,病死率高。近年来,国内外多家NICU报道足月儿与近足月儿NRDS患病率增加,且具备不同于早产儿NRDS的临床特征[1-3]。妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy,ICP)母亲所分娩之足月新生儿患NRDS的发病率显著增加[4-5],机制不清楚。肺泡Ⅱ型上皮细胞(alveolar type 2epithelium cell,AECⅡ)是合成与分泌肺表面活性物质(pulmonary surfactant,PS)的主要场所,AECⅡ凋亡增加将导致PS持续分泌不足,肺泡塌陷、萎缩,继而发生NRDS。作者的前期研究发现:胆酸的主要成分之一甘氨鹅脱氧胆酸(glycochenodeoxycholate,GCDC)对AECⅡ具有诱导凋亡和坏死的作用,而且可显著减少AECⅡ中肺泡表面活性物质的合成。NO是一种可溶性气体,可由L-精氨酸在一氧化氮合酶催化下产生。在病理状态下,诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)是 NO大量生成的关键酶,具有重要意义。iNOS/NO与低浓度外源性NO对于细胞凋亡具有抑制作用,临床多中心研究发现,对严重呼吸衰竭的新生儿使用NO吸入治疗,显著降低了外源性PS和高频机械通气的使用率[6]。机械通气初期开始使用NO吸入治疗效果明显好于呼吸衰竭严重时再使用[7]。上述临床现象强烈提示NO具备降低肺动脉高压之外的其他治疗作用,联系到项目组发现NRDS中AECⅡ的凋亡对呼吸衰竭的重要影响,以及NO可能具备抗GCDC诱导AECⅡ凋亡的作用,NO极有可能通过抑制AECⅡ凋亡而产生了对NRDS的上述治疗作用。本研究拟通过细胞试验检测甘氨鹅脱氧胆酸诱导A549细胞凋亡模型中一氧化氮合酶的表达变化,以及外源性NO对细胞凋亡的抑制作用。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肺癌上皮细胞株A549细胞购自上海中科院细胞所。
1.1.2 仪器与试剂 PRMI 1640培养基 (美国GIBCO公司);小牛血清 (美国GM公司);甘氨鹅脱氧胆酸盐 (sigma公司);胰酶细胞消化液 (碧云天生物技术研究所);caspase-3试剂盒(南京凯基生物科技发展有限公司);一氧化氮合酶抗体及一氧化氮供体SNAP(美国Sigma公司)。
1.2 方法 (1)细胞与细胞培养从液氮罐中取出存有A549细胞的冻存管,放于37℃温水中,用镊子住轻轻摇动使其迅速融化。1000~2 000r/min,3~5min离心。在无菌操作台中采用75%的乙醇彻底擦拭冻存管,然后打开冻存管,注意动作要轻柔。用1mL枪头将上清液去除,加入1mL预热的细胞培养液将细胞吹散开,转移至25cm2培养瓶中。补充4mL的RPMI 1640培养基,并且添加10%的胎牛血清。倒置显微镜下观察,37℃、5%CO2培养。24h后,更换新的培养液。细胞复苏后常规传代培养。待细胞呈对数期生长后用于实验。(2)甘氨鹅脱氧胆酸诱导经典的凋亡途径,采用荧光免疫实验。在24孔板中放入小玻片,进行细胞爬片,将细胞分为两组,一组加入200μmol/L GCDC,一组做空白对照。先使用caspase-3染色试剂盒对caspase-3染色荧光倒置下呈红色,再DAPT染细胞核荧光倒置显微镜下呈蓝色。分别拍照后,重合在一起,显紫红色为依赖caspase-3途径的细胞凋亡。(3)细胞凋亡采用caspase-3检测试剂盒进行检测采用蛋白印迹法(Western Blot)方法检测一氧化氮合酶表达水平,NO供体SNAP与胆酸共处理A549细胞以判断其对细胞凋亡的作用。收集细胞,PBS洗涤,抽提细胞裂解液,蛋白定量,SDS-PAGE电泳,聚偏二氟乙烯(PVDF)膜转移,5%脱脂奶粉封闭,室温静置1.5~2 h,caspase-3多抗室温反应1~2h,TBS(含0.05%Tween 20的TBS)洗3次,5~10min/次,HRP标记的羊抗鼠IgG室温反应1~2h,TBS-T洗3次,5~10min/次,NBT/BCIP显色。
2 结 果
2.1 GCDC诱导A549细胞凋亡 为了进一步确定甘氨鹅脱氧胆酸能否诱导经典的凋亡途径,进行了荧光免疫实验。结果显示,甘氨鹅脱氧胆酸处理后的A549出现了明显的凋亡。使用caspase-3染色试剂盒对caspase-3染色呈红色,DAPT染细胞核呈蓝色,图1中上图为200μmol/L GCDC处理组,下图为空白对照组,结果证明GCDC可诱导A549细胞依赖caspase-3途径凋亡。见图1。
2.2 GCDC抑制A549中iNOS表达 不同浓度GCDC处理A549后,细胞中iNOS的蛋白表达水平明显降低,且具有浓度依赖性。实验证明,GCDC可抑制iNOS在细胞中的表达水平,当GCDC浓度达到1 000μmol/L时,iNOS表达明显受到抑制,GCDC浓度与抑制iNOS程度正相关。见图2。
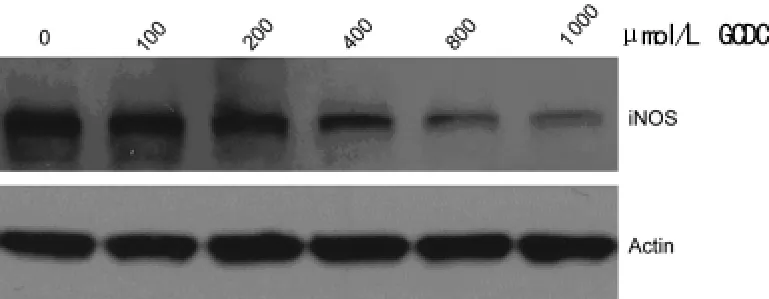
图2 GCDC处理AECⅡ后iNOS的表达变化情况
2.3 外源性NO抑制GCDC诱导的A549凋亡 以NO供体SNAP(0~1mmol/L)单独处理 AECⅡ时,细胞不发生凋亡;GCDC可诱导AECⅡ凋亡,但用SNAP和GCDC共处理AECⅡ后则降低了细胞的凋亡程度。见图3。

图3 NO供体SNAP与对GCDC诱导AECⅡ凋亡的影响
3 讨 论
ICP主要临床表现为皮肤瘙痒、黄疸及肝功能异常,可导致孕妇和胎儿的并发症。ICP主要危害胎儿,可致胎儿宫内窘迫、流产、死胎等,增高围产儿发病率和死亡率。ICP最常发生在孕晚期,但在妊娠期间也可以随时发病。ICP对孕妇的影响不大,但是对胎儿有很大影响,有研究显示与正常妊娠相比,ICP患者脐带血孕激素重硫酸化代谢产物含量高,胎儿类固醇硫酸盐水平合成量降低,使胎儿类固醇合成功能受损。1883年就报道了ICP,描述ICP为妊娠期间复发性黄疸,分娩后消失。很多研究证实激素在ICP治病机制中起着重要作用。ICP最常见于经产妇,在经产妇与初产妇的发病率分别为20.0%和4.7%。ICP通常发生于怀孕的后3个月,为雌激素水平的高峰时期有ICP家族史的妇女,服用避孕药后也会出现ICP的临床症状。黄体酮及代谢产物也可能是发病机制,Bacq等[8]做了临床实验,12例先兆早产患者有11例有服用过天然孕激素治疗。
NRDS又称为肺透明膜病(hyaline membrane disease,HMD),是由PS缺乏而导致,以出生后不久便出现呼吸窘迫呈进行性加重的综合征,是新生儿重症监护室常见的危急重症,发病率及病死率高[9],临床症状以呼吸急促困难、呻吟为主要表现。PS是由AECⅡ合成分泌的磷脂蛋白复合物,胎儿在18~20周AECⅡ已经能够分泌少量的PS转移至肺泡表面,随胎龄增长,PS的合成分泌量增高,所以本病易发生于早产儿,胎龄越小,发病率越高,足月儿与近足月儿(胎龄大于或等于35周)的发病率是较低的[3]。近年来,国内外多家NICU报道足月儿与近足月儿NRDS患病率增加,且具备不同于早产儿NRDS的临床特征[1-2,10],所以早产并不是PS分泌不足致NRDS的主要原因。围生期窒息、前置胎盘、胎盘早剥及孕妇低血压致胎儿血容量下降等均能诱发胎儿的呼吸窘迫症。最新的研究表明,母亲患有ICP时,胎儿NRDS发病概率显著增高。
胆汁酸对孕妇和胎儿的毒性作用,妊娠中晚期胎儿和母体合成的胆汁酸都是通过胎盘转运的,Ding等[11]发现胆汁酸可能损害细胞器从而导致多核细胞生理功能失常,影响胎盘合成和转运功能。孕妇胆汁酸升高,可导致胎盘绒毛间隙狭窄,胎盘灌注量减少;胆汁酸有浓度依赖性血管收缩作用,高浓度胆汁酸使绒毛血管痉挛,从而导致胎盘灌注不足,发生胎儿窘迫。胆汁酸通过胎盘进入胎儿体内后,其细胞毒作用破坏线粒体膜产生氧自由基,从而导致胎儿的氧利用障碍[12]。胆酸盐可刺激肠蠕动,但是胆酸过高,便会造成羊水胎粪污染。各种炎症细胞在肺内积聚、黏附、激活同时释放大量的活性氧和蛋白酶,直接或间接引起胎儿的肺损伤,从而增加新生儿窒息,及吸入性肺炎的概率,患NRDS的风险明显升高[13]。
本实验通过研究一氧化氮抑制甘氨鹅脱氧胆酸诱导A549细胞凋亡,为预防和治疗NRDS寻找新的治疗方法和药物靶点,从而降低NRDS的发生率。
[1]Engle MA.Surfactant-replacement therapy for respiratory distress in the preterm and term neonate[J].Pediatrics,2008,121(2):419-432.
[2]Chen A,Shi LP,Zheng JY.Clinical characteristics and outcomes of respiratory distress syndrome in term and late-preterm neonates[J].Zhonghua Er Ke Za Zhi,2008,46(9):654-657.
[3]Moya F,Sinha S,D′Agostino RB.Surfactant-replacement therapy for respiratory distress syndrome in the preterm and term neonate:congratulations and corrections[J].Pediatrics,2008,121(6):1290-1291.
[4]Zecca E,De Luca D,Marras M.Intrahepatic cholestasis of pregnancy and neonatal respiratory distress syndrome[J].Pediatrics,2006,117(5):1669-1672.
[5]Liu J,Shi Y,Dong JY,et al.Clinical characteristics,diagnosis and management of respiratory distress syndrome in full-term neonates[J].Chin Med J(Engl),2010,123(19):2640-2644.
[6]Wang YF,Liu CQ,Gao XR,et al.Collaborative study group for neonatal respiratory diseases.effects of inhaled nitric oxide in neonatal hypoxemic respiratory failure from a multicenter controlled trial[J].Chin Med J(Engl),2011,124(8):1156-1163.
[7]González A,Fabres J,D′Apremont I,et al.Randomized controlled trial of early compared with delayed use of inhaled nitric oxide in newborns with a moderate respiratory failure and pulmonary hypertension[J].J Perinatol,2010,30(6):420-424.
[8]Bacq Y,Myara A,Brechot MC,et al.Serum cinjugated bile acid peofile during intrahepatic of pregnancy[J].J Hepatol,1995,22(1):66-70.
[9]Rojas MA,Lozano JM,Rojas MX,et al.Very early surfactant without mandatory ventilation in premature infants treated with early continuous positive airway pressure:a randomized,controlled trial[J].Pediatrics,2009,123(1):137-142.
[10]St Clair C,Norwitz ER,Woensdregt K.The probability of neonatal respiratory distress syndrome as a function of gestational age and lecithin/sphingomyelin ratio[J].Am J Perinatol,2008,25(8):473-480.
[11]Ding YL,Tang LL.Tereological study on syncitial cell of humal placenta and deteminations of tatal bile acid in cord blood of intrahepatic cholestasis of preguan[J].Zhonghua Fu Chan Ke Za Zhi,2005,40(7):453-456.
[12]Reyes H.The spect rumof liver and gast rointestinal diseaseseen in cholestasisof pregnancy[J].Gastroenterol Clin North Am,1992,21(4):905-910.
[13]Enrico Z,Daniele DL,Marco M,et al.Intrahepatic cholestasis ofpregnancy and neonatal respiratory distress syndrome[J].Pediatrics,2006,117(10):1669-1672.
