酵母双杂交系统在痘病毒与宿主相互作用中的研究进展
2013-09-26汪园园郝文波罗树红
汪园园,郝文波,罗树红
痘病毒为病毒颗粒中最大的一类DNA病毒,结构复杂,呈砖形或椭圆形,大小为(300~450)nm×170nm×260nm[1]。痘病毒编码3种类型的基因:早期基因、中期基因和晚期基因[2]。痘病毒的基因组序列分析提供了痘病毒基因组的大量信息,发现了很多新的基因,部分基因编码蛋白在痘病毒复制、感染、致病及传播过程中具有关键作用,但这些基因的确切功能不明。近年来,各痘病毒蛋白之间以及痘病毒蛋白与宿主细胞蛋白之间的相互作用受到了广泛的关注。利用现代分析生物学技术,通过对病毒蛋白之间及病毒蛋白及宿主蛋白之间的相互作用的系统研究,为病毒与宿主相互作用的分子机制的阐明,及在此基础上的痘病防控提供了理论基础。其 中,酵 母 双 杂 交 系 统 (yeast two-hybrid,Y2H)是研究蛋白质之间相互作用的重要工具,该技术可以发现新蛋白之间的相互作用,确定蛋白相互作用的区域,从而为研究各蛋白质的生物学功能以及蛋白质之间相互作用的分子机制奠定基础。本文综述了酵母双杂交系统在痘病毒蛋白之间及病毒-宿主相互作用的研究现状。
1 酵母双杂交系统
1.1 酵母双杂交系统原理 1986年,巴斯德实验室[3]发现一种酵母细胞转录活化因子Gal4模块,Gal4结合一个特殊的DNA序列:上游激活区 (upstream activation domain,UAS),在半乳糖存在时会激活转录。Gal4模块分为两个不同功能区:N-末端区域可以结合UAS,为DNA结合区(Binding domain,BD);C-末端区域在半乳糖存在时能激活转录,为转录激活区(Activation domain,AD)。两个区域如果分开,各自均不具有转录活性,但如果两个区域经非共价键重新组合,Gal4又可恢复转录活性。Field和Song[4]受到此启发,发明了酵母双杂交系统。他们将已知基因(诱饵基因)构建在含有BD的质粒载体上,靶基因(捕获基因或含有目的基因的cDNA文库)构建在含有AD质粒载体上,共表达于酵母细胞中,如果BD结合的诱饵蛋白和AD结合的靶蛋白或文库中某些cDNA编码蛋白相互作用,则AD和BD在空间上接近,形成有完整功能的转录因子,启动下游报告基因的表达。经典的酵母双杂交系统由诱饵蛋白,靶蛋白(文库蛋白)和带报告基因及多种选择标记的酵母细胞组成。目前,经典的酵母双杂交系统已扩展到利用不同的DNA-结合蛋白、诱饵蛋白[5-6]、转录激活因子[7]和不同的报告基因[8](HIS3,ADE2,MEL1,AUR1-C)来筛选相互作用的蛋白,然后通过营养缺陷及颜色反应筛选出与诱饵蛋白相互作用的蛋白(图1)。
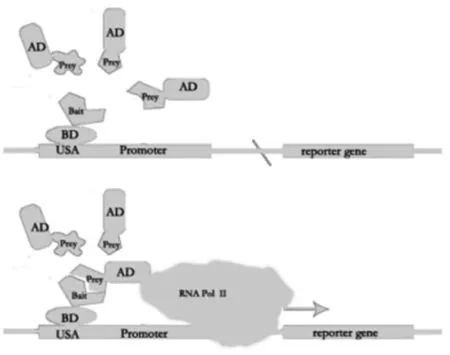
图1 酵母双杂交系统基本原理Fig.1 The yeast two-hybrid principle
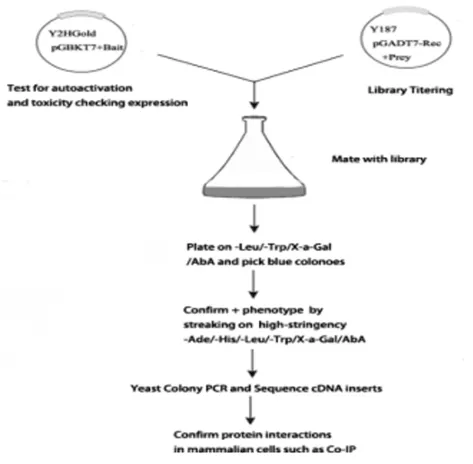
图2 酵母双杂交系统的技术路线Fig.2 Technology roadmap of yeast two-hybrid system
1.2 酵母双杂交系统技术路线 利用酵母双杂交系统筛选cDNA文库,鉴定出与诱饵蛋白相互作用的蛋白为例,其技术流程为:①诱饵载体的构建。将编码诱饵蛋白的基因与诱饵载体pGBKT7相连接,将构建好的载体转化到酵母菌株Y2HGold中,经毒性和自激活实验验证为阴性后,可用于筛选文库;②构建一定库容量的cDNA文库。将cDNA与质粒pGADT7-Rec共转化至酵母菌株Y187中,cDNA序列整合到载体上,完成cDNA文库的构建;③筛选文库。将含有诱饵蛋白载体(Y2Hgold)和靶蛋白载体(Y187)的酵母菌株融合后,在酵母细胞中表达BD-诱饵蛋白和AD-靶蛋白,若诱饵蛋白与靶蛋白有相互作用,则形成完整功能的转录激活因子,启动下游报告基因,通过报告基因的表达与否,筛选出相互作用的蛋白(图2),然后进行其他实验的验证。
2 酵母双杂交系统在研究痘病毒中的作用
2.1 痘病毒蛋白之间的相互作用 痘病毒生活周期复杂,且病毒编码的蛋白之间存在相互作用(protein-protein interactions,PPIs)。有些蛋白可组装成一个功能基团,如牛痘病毒(vaccinia virus,VACV)蛋 白 质 复 合 体 (entry-fusion complex,EFC)[9]。痘病毒蛋白之间的相互作用,参与许多重要的生化途径,如蛋白质的磷酸化和去磷酸化在痘病毒不同的生活周期中起不同作用。假如我们知道其中的一种蛋白参与DNA复制、转录、病毒结构、逃避宿主免疫等活动,就可以推测与其相互作用的未知蛋白的功能。Mccraith S[10]等采用酵母双杂交系统对牛痘病毒编码的蛋白之间的相互作用进行研究。在酵母细胞中,表达226种牛痘病毒开放阅读框(open reading frames ORFs),发现了37种特异性相互作用的蛋白,其中28种是先前未知的。可以将这些相互作用蛋白组分为5组,包括参与DNA复制、DNA转录、病毒结构形态的形成,病毒-宿主之间的作用以及一些功能未知的作用组,由此也可以推测一些未知蛋白的作用。在牛痘病毒基因组编码蛋白范围内筛选相互作用蛋白时,某些蛋白之间的相互作用揭示了一些我们以前没有注意的蛋白质,例 如,A2.5H 与 E1OR 之间 的 相 互 作 用[11]。Senkevich T G[11]证明 A2.5H 与 E1OR 在病毒的形态形成中有重要作用,还有一些蛋白在以往的研究中显示相互作用,但是在酵母双杂交系统中却没有检测到[12]。Ishii K[13]在 Mccraith S的研究基础上确定A20R与H5R、D5R、D4R存在相互作用,其中,A20R的氨基酸残基1~25、26~76和201~251分别与D4R、H5R、D5R存在相互作用。Dellis[14]利用酵母双杂交系统检测痘病毒具有调节痘病毒晚期基因表达的蛋白A1L、A2L、G8R与H5R蛋白之间的相互作用,结果验证了G8R与自身及A1L的相互作用,并且观察到A1L和H5R的自身相互作用及A2L与 G8R,A2L与 H5R,H5R与G8R的相互作用。J1R与病毒的形态发生有关,Chiu W L[15]等应用酵母双杂交技术发现,J1R在牛痘病毒感染后,可以与自身发生相互作用,其N-端序列(1-77)和 C-端序列(84-153)结合,影响病毒的组装。Johnston S C[16]应用酵母双杂交技术,检测到痘病毒蛋白F12(氨基酸351~458)和A36(氨基酸91~111)存在相互作用。用 GST pull-down进一步验证,F12和A36是细胞内折叠病毒体(intracellular enveloped virions,IEV)-特异的病毒蛋白,它们的相互作用发生在IEV形成之后,且F12有可能是在IEV释放时起作用。这些转录因子在相互作用较为复杂,通过鉴定这些转录因子的结合顺序,进而可以推测它们的具体作用机制。
2.2 痘病毒蛋白与宿主蛋白之间的相互作用 病毒的生活周期依赖宿主蛋白的表达,病毒感染始于病毒侵入被感染的细胞中,在这一过程中,同样有多种蛋白质之间的相互作用。在病毒致病的过程中,病毒编码的蛋白质与宿主细胞内蛋白质之间的相互作用起着重要的作用,寻找与病毒蛋白质相互作用的宿主蛋白将有助于阐明不同病毒致病的分子机制。研究这些复杂的蛋白间相互作用引起的功能特性,对细胞凋亡、细胞周期调控、细胞骨架信息和先天性免疫应答等的机制研究有很重要的意义,同时有利于进一步研发阻断这一过程的活性物质,从而达到治疗疾病的目的。
痘病毒属基因组高度保守,如在痘苗病毒(VACV)中,超过90%的主要ORFs有高度的的相似性,但也有一些基因只在特定的病毒成员中表达。Mohamed R[17]应用酵母双杂交系统鉴定出天花病毒(VARV)中与人体细胞蛋白相互作用的蛋白。采用VARV-特异的14种ORFs(D8L,C18L,A27L,A39L,B4L,B9R,B10R,B11R,B14L,B19R,B20R,B22R,G1R和G2R)作为诱饵,用来筛选4种人不同组织的cDNA文库(扁桃体,乳腺癌,前列腺癌,脾脏)。在14种 VARV蛋白中,只有3种ORFs(B22R,G1R,G2R)编码蛋白与人组织蛋白存在相互作用[17]。在研究中,Mohamed R 确定了VARV G1R分别与 NF-кB1和Skp1A之间的联系,并且进一步证明了在瞬时感染的细胞中,VARV G1R(正痘病毒属相关的家族成员)具有抑制NF-кB信号通路的作用[17]。
Zhang L[18]等利用酵母双杂交系统技术对牛痘病毒和人蛋白的相互作用进行了系统研究。采用33种牛痘病毒蛋白作为诱饵,用来筛选4种人类不同组织的cDNA文库(扁桃体,乳腺癌,前列腺癌,脾脏),得到109种新的牛痘病毒-人蛋白相互作用组,采用GST pull-down进行验证,得到17种牛痘病毒蛋白和酵母双杂交系统筛选所得结果一致。这些数据为探索未知的信号通路,如病毒的复制,宿主趋向性及治病机理提供了新的线索。
痘病毒蛋白与宿主细胞蛋白之间的作用对于病毒入侵细胞具有重要作用[19]。痘病毒的基因组较大,相对其他的病毒来说,可以编码大量蛋白,部分蛋白已被证明有明确的靶点可以控制重要的代谢过程[20-22]。然而,大多数蛋白质之间的相互作用,在感染的细胞中,其功能并不明确,因此研究这些痘病毒蛋白与宿主蛋白相互作用具有重要意义。如,牛痘病毒在其宿主范围决定蛋白CP77缺失的时候不能感染中国仓鼠卵巢细胞。Y2H分析结果提示,CP77(1~234)和HMG20A具有相互作用,进一步的研究证明,在病毒复制中,CP77能促进HMG20A与病毒基因组的分离[23]。Sharp T V[24]应用酵母双杂交技术发现牛痘病毒的另一个宿主范围基因,E3L,基因产物为pE3,与蛋白激酶(protein kinase,PKR)有直接的相互作用。PKR中具有调节作用的氨基端1~99区,与pE3结合形成非活性二聚体,竞争性实验表明,pE3通过与PKR的羧基端367~523区结合,阻断了PKR与翻译起始因子(eIF2a)之间的相互作用。病毒感染后,在细胞质中,E3L结合dsRNA,从而抑制并阻断dsRNA的PKR和2′-5′-寡腺苷酸合成酶的活性[25-27]。Rogan S,利用酵母双杂交系统,推测细胞核蛋白SUMO-1(又名PIC-1,sentrin或 GMP-1)和细胞质核糖体蛋白分别与E3结合发挥作用,但是缺乏对其功能的深入研究[28]。另外,Sperling K M[29]应用酵母双杂交系统鉴定了与MVA编码的68KANK蛋白发生相互作用的蛋白,99%的阳性结果分析都是细胞Skep1(泛素连接酶复合物中的组成成分)。68KANK包含一个 C-末端 F-box-like区,已有文献证明它与Skep1结合。Mohan K V[30]应用酵母双杂交系统,以VACV中的神经毒力因子N1L筛选人脑cDNA文库,发现N1L的C末端227个氨基酸与人脑细胞基底膜相关硫酸软骨素蛋白多糖(bamacan)存在相互作用,这种相互作用在病毒感染的N1L哺乳动物细胞中得到证实。进一步研究表明,这种病毒蛋白之间的相互作用,可促进病毒生长,并可能影响VACV在神经细胞中的毒力[30]。Lin Y C[31]应用Y2H检测与VACV连接酶(A50R基因)相互作用的宿主蛋白,筛选到了拓扑异构酶Ⅱ,应用Co-IP方法证实,在感染的细胞中,天然的连接酶和Flag-标记的重组蛋白与拓扑异构酶Ⅱ形成复合体,这种相互作用很好的解释了依托泊苷和米托蒽醌对痘病毒复制的抑制作用及突变发生后的耐药性。
除了牛痘病毒基因组,酵母双杂交系统也用于筛选粘液瘤病毒(MYXV)中的一些基因编码蛋白与宿主蛋白之间的相互作用。MYXV中 M-T5,M148,M149和M150都包含有一个PRANC区,与细胞F-box区结构相似,且都编码ANK重复序列,ANK重复序列与Skep1存在相互作用[32]。MT5的N-末端ANK重复区在与Akt发生相互作用时起作用,而C-末端PRANC/F-box区与Skep1存在相互作用,但之前已经确定与M-T5相结合的蛋白即cullin-1[33]和 Akt[34]在酵母双杂交系统中却未筛选到,在宿主SCF(Skep1,culling,F-box-con-taining复合物)泛素连接酶复合物中,M-T5通过Skep1与cullin-1相互作用,形成M-T5的相互作用图谱,为进一步了解病毒在复制中的具体机制提供了基础。
在接触传染性软疣病毒中的研究中,Chen N[35]应用酵母双杂交系统发现 MC013L与糖皮质激素和维他命D受体有相互作用。糖皮质激素具有潜在的抑制细胞周期的作用,维他命D具有促进细胞终末分化的作用,因此,推测MC013L可能通过抑制感染细胞的分化促进细胞复制。Bertin J 应用酵母双杂交系统发现MC159蛋白可与FADD相互作用,而且,MC159抑制由Fas和TNFR1引起的凋亡。
3 酵母双杂交系统的优势和不足
3.1 酵母双杂交系统的优势 目前,酵母双杂交系统在研究蛋白质之间的相互作用中有大范围的应用。对于一些病毒蛋白在复杂的生命过程中不能明确其潜在靶点,酵母双杂交技术就是一种很有利的方法,Mohan K V[30]应用酵母双杂交技术得到VACV中的神经毒力因子N1L相互作用的蛋白。酵母双杂交技术的主要优势为:简单快速、敏感并适用于高通量;在高等的真核细胞中检测,直接通过重组转录因子作用的激活,在培养基中显色及或通过其营养缺陷进行筛选,无须进行蛋白纯化;通过构建一定库容量的文库,筛选与诱饵蛋白相互作用的蛋白,如Zhang L[18]以33种牛痘病毒蛋白为诱饵筛选4种人类不同组织的cDNA文库。
3.2 局限性与改进发展 酵母双杂交技术的缺陷在于:一方面存在大量的假阳性结果,也就是蛋白质之间的相互作用在酵母细胞中是非特异性的[37]。因此,确定酵母双杂交系统所得到的结果,还必须与其他的研究蛋白质之间相互作用的方法(如:表面等离子体共振,免疫共沉淀等)相结合。比如,Zhang L[18]在酵母双杂交技术筛选文库后,又对这些相互作用组进行GST pull-down实验验证,发现其一致率为63%。另一方面,酵母双杂交技术也存在假阴性结果,如在 Mccraith S[10]的研究中,痘病毒中37种相互作用组,是病毒生命周期中的一小部分,若使用其他酵母双杂交系统,如,不依赖于细胞核转运的系统,这一相互作用组数量将会增加。尽管有这些缺陷,利用酵母双杂交技术得到的结果,为发现新的病毒-病毒或病毒-宿主蛋白之间的相互作用,提供了很多有意义的线索。并且,研究人员在经典的酵母双杂交原理基础上创建了很多新的方法和系统以弥补这些缺陷。近年来,以Y2H基本原理为基础的酵母双杂交系统衍生系统几乎可以应用于细胞蛋白组学。
4 总结与展望
到目前为止,酵母双杂交系统仍然是研究痘病毒与机体相互作用的主要手段之一,今后利用酵母双杂交及其改良系统对痘病毒的研究主要集中于以下几点:①确定痘病毒的具体功能蛋白与机体的多种蛋白相互作用,进而构建与痘病毒某一蛋白的机体反应蛋白网络,组建体外机体的作用蛋白系统;②根据确定的痘病毒执行类似功能的一组蛋白,进行群体蛋白与机体细胞蛋白反应的筛选,获得机体对痘病毒某一生理功能的作用和拮抗蛋白群;③利用机体的某一特殊蛋白为诱饵,反向筛选痘病毒的功能蛋白群,从而为防控痘病毒病提供理论基础。相信随着研究的深入,酵母双杂交系统在痘病毒研究中的应用会更加广泛,也会为人类防控痘病毒病发挥应有的作用。
[1]Cyrklaff M,Risco C,Fernandez JJ,etal.Cryo-electron tomography of vaccinia virus[J].Proc Natl Acad Sci U S A,2005,102(8):2772-2777.DOI:10.1073/pnas.0409825102
[2]Assarsson E,Greenbaum JA,Sundstrom M,etal.Kinetic analysis of a complete poxvirus transcriptome reveals an immediateearly class of genes[J].Proc Natl Acad Sci U S A,2008,105(6):2140-2145.DOI:10.1073/pnas.0711573105
[3]Keegan L,Gill G,Ptashne M.Separation of DNA binding from the transcription-activating function of a eukaryotic regulatory protein[J].Science,1986,231(4739):699-704.DOI:10.1126/science.3080805
[4]Fields S,Song O.A novel genetic system to detect protein-protein interactions[J].Nature,1989,340(6230):245-246.DOI:10.1038/340245a0
[5]Serebriiskii I,Khazak V,Golemis EA.A two-hybrid dual bait system to discriminate specificity of protein interactions[J].J Biol Chem,1999,274(24):17080-17087.DOI:1074/jbc.274.24.17080
[6]Serebriiskii IG,Mitina OV,Chernoff J,etal.Two-hybrid dual bait system to discriminate specificity of protein interactions in small GTPases[J].Methods Enzymol,2001,332:277-300.DOI:10.1016/S0076-6879(01)32210-3
[7]Licitra EJ,Liu JO.A three-hybrid system for detecting small ligand-protein receptor interactions[J].Proc Natl Acad Sci U S A,1996,93(23):12817-12821.
[8]Durfee T,Becherer K,Chen PL,etal.The retinoblastoma protein associates with the protein phosphatase type 1catalytic subunit[J].Genes Dev,1993,7(4):555-569.DOI:10.1101/gad.7.4.555
[9]Moss B.Poxvirus entry and membrane fusion[J].Virology,2006,344(1):48-54.DOI:10.1016/j.virol.2005.09.037
[10]Mccraith S,Holtzman T,Moss B,etal.Genome-wide analysis of vaccinia virus protein-protein interactions[J].Proc Natl Acad Sci U S A,2000,97(9):4879-4884.DOI:10.1073/pnas.080078197
[11]Senkevich TG,White CL,Weisberg A,etal.Expression of the vaccinia virus A2.5Lredox protein is required for virion morphogenesis[J].Virology,2002,300(2):296-303.DOI:10.1006/viro.2002.1608
[12]Condit RC,Moussatche N,Traktman P.In a nutshell:struc-ture and assembly of the vaccinia virionJ .Adv Virus Res 2006,66:31-124.DOI:10.1016/S0065-3527(06)66002-8
[13]Ishii K,Moss B.Mapping interaction sites of the A20Rprotein component of the vaccinia virus DNA replication complex[J].Virology,2002,303(2):232-239.DOI:10.1006/viro.2002.1721
[14]Dellis S,Strickland KC,Mccrary WJ,etal.Protein interactions among the vaccinia virus late transcription factors[J].Virology,2004,329(2):328-336.DOI:10.1016/j.virol.2004.08.017
[15]Chiu WL,Szajner P,Moss B,etal.Effects of a temperature sensitivity mutation in the J1Rprotein component of a complex required for vaccinia virus assembly[J].J Virol,2005,79(13):8046-8056.DOI:10.1128/JVI.79.13.8046-8056
[16]Johnston SC,Ward BM.Vaccinia virus protein F12associates with intracellular enveloped virions through an interaction with A36[J].J Virol,2009,83(4):1708-1717.DOI:10.1128/JVI.01364-08
[17]Mohamed MR,Rahman MM,Lanchbury JS,etal.Proteomic screening of variola virus reveals a unique NF-kappaB inhibitor that is highly conserved among pathogenic orthopoxviruses[J].Proc Natl Acad Sci U S A,2009,106(22):9045-9050.DOI:10.1073/pnas.0900452106
[18]Zhang L,Villa NY,Rahman MM,etal.Analysis of vaccinia virus-host protein-protein interactions:validations of yeast twohybrid screenings[J].J Proteome Res,2009,8(9):4311-4318.DOI:10.1021/pr900491n
[19]Mcfadden G.Poxvirus tropism[J].Nat Rev Microbiol,2005,3(3):201-213.DOI:10.1038/nrmicro1099
[20]Everett H,Mcfadden G.Poxviruses and apoptosis:a time to die[J].Curr Opin Microbiol,2002,5(4):395-402.DOI:10.1016/S1369-5274(02)00340-5
[21]Seet BT,Johnston JB,Brunetti CR,etal.Poxviruses and immune evasion[J].Annu Rev Immunol,2003,21:377-423.DOI:10.1146/annurev.immunol.21.120601.141049
[22]Zhang L,Villa NY,Mcfadden G.Interplay between poxviruses and the cellular ubiquitin/ubiquitin-like pathways[J].FEBS Lett,2009,583(4):607-614.DOI:10.1016/j.febslet.2009.01.023
[23]Hsiao JC,Chao CC,Young MJ,etal.A poxvirus host range protein,CP77,binds to a cellular protein,HMG20A,and regulates its dissociation from the vaccinia virus genome in CHOK1cells[J].J Virol,2006,80(15):7714-7728.DOI:10.1128/JVI.00207-06
[24]Sharp TV,Moonan F,Romashko A,etal.The vaccinia virus E3Lgene product interacts with both the regulatory and the substrate binding regions of PKR:implications for PKR autoregulation[J].Virology,1998,250(2):302-315.DOI:10.1006/viro.1998.9365
[25]Chang HW,Watson JC,Jacobs BL.The E3Lgene of vaccinia virus encodes an inhibitor of the interferon-induced,doublestranded RNA-dependent protein kinase[J].Proc Natl Acad Sci U S A,1992,89(11):4825-4829.
[26]Chang HW,Jacobs BL.Identification of a conserved motif that is necessary for binding of the vaccinia virus E3Lgene products to double-stranded RNA[J].Virology,1993,194(2):537-547.DOI:10.1006/viro.1993.1292
[27]Rivas C,Gil J,Melkova Z,etal.Vaccinia virus E3Lprotein is an inhibitor of the interferon (i.f.n.)-induced 2-5Asynthetase enzyme[J].Virology,1998,243(2):406-414.DOI:10.1006/viro.1998.9072
[28]Rogan S,Heaphy S.The vaccinia virus E3Lprotein interacts with SUMO-1and ribosomal protein L23ain a yeast two hybrid assay[J].Virus Genes,2000,21(3):193-195.
[29]Sperling KM,Schwantes A,Schnierle BS,etal.The highly conserved orthopoxvirus 68kankyrin-like protein is part of a cellular SCF ubiquitin ligase complex[J].Virology,2008,374(2):234-239.DOI:10.1016/j.virol.2008.02.018
[30]Mohan KV,Zhang CX,Atreya CD.The proteoglycan bamacan is a host cellular ligand of vaccinia virus neurovirulence factor N1L[J].J Neurovirol,2009,15(3):229-237.DOI:10.1080/13550280902913636
[31]Lin YC,Li J,Irwin CR,etal.Vaccinia virus DNA ligase recruits cellular topoisomerase II to sites of viral replication and assembly[J].J Virol,2008,82(12):5922-5932.DOI:10.1128/JVI.02723-07
[32]Werden SJ,Lanchbury J,Shattuck D,etal.The myxoma virus m-t5ankyrin repeat host range protein is a novel adaptor that coordinately links the cellular signaling pathways mediated by Akt and Skp1in virus-infected cells[J].J Virol,2009,83(23):12068-12083.DOI:10.1128/JVI.00963-09
[33]Johnston JB,Wang G,Barrett JW,etal.Myxoma virus M-T5 protects infected cells from the stress of cell cycle arrest through its interaction with host cell cullin-1[J].J Virol,2005,79(16):10750-10763.DOI:10.1128/JVI.79.16.10750-10763.2005
[34]Wang G,Barrett JW,Stanford M,etal.Infection of human cancer cells with myxoma virus requires Akt activation via interaction with a viral ankyrin-repeat host range factor[J].Proc Natl Acad Sci U S A,2006,103(12):4640-4645.DOI:10.1073/pnas.0509341103
[35]Chen N,Baudino T,Macdonald PN,etal.Selective inhibition of nuclear steroid receptor function by aprotein from a human tumorigenic poxvirus[J].Virology,2000,274(1):17-25.DOI:10.1006/viro.2000.0410
[36]Bertin J,Armstrong RC,Ottilie S,etal.Death effector domain-containing herpesvirus and poxvirus proteins inhibit both Fas-and TNFR1-induced apoptosis[J].Proc Natl Acad Sci U S A,1997,94(4):1172-1176.
[37]Cusick ME,Klitgord N,Vidal M,etal.Interactome:gateway into systems biology[J].Hum Mol Genet,2005,2:R171-R181.DOI:10.1093/hmg/ddi335
