调节血脂治疗的药学监护
2013-09-26张石革
张石革
(北京大学第四临床医学院,北京积水潭医院,北京 100035)
高脂血症(hyperlipidemia)又称血脂异常(dyslipoproteinemia),是指血脂代谢发生紊乱、脂肪代谢或转运异常,血浆中一种或几种脂质水平异常,包括血浆总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白(LDL)等水平过高或高密度脂蛋白(HDL)水平过低等。
1 血脂的代谢与血脂异常
血脂是血浆中所含的脂类,包括胆固醇(CH)、TG、磷 脂(phospholipid,PL)和游离脂肪酸(free fatty acid,FFA)等。其中CH又分为胆固醇酯(cholesterol esterase,CE) 和 游 离 胆 固 醇 (free cholesterol,FC),两者相加为 TC。血脂与载脂蛋白(apolipoprotein,Apo)相结合,形成脂蛋白溶于血浆进行转运与代谢。脂蛋白按其组成、密度和特性(组成、颗粒大小、分子量、水合密度、电荷等)等差异,利用电泳和超速离心法可将血脂蛋白分成乳糜微粒(CM)、极低密度脂蛋白胆固醇(VLDL-C)、低密度脂蛋白胆固醇(LDL-C)、中密度脂蛋白胆固醇(IDL-C)和高密度脂蛋白胆固醇(HDL-C)等。
1.1 人体血脂的来源路径
脂肪是由甘油和脂肪酸所组成的TG,其中脂肪酸因结构的不同,可分为饱和脂肪酸和不饱和脂肪酸;不饱和脂肪酸又分为单不饱和脂肪酸及多不饱和脂肪酸。脂肪的来源包括:①食物中摄入的脂肪经胆汁乳化成小颗粒,胰腺和小肠内分泌脂肪酶将脂肪酸水解为FFA和甘油单酯,甘油单酯和长链脂肪酸在小肠细胞重新合成TG,肝脏、脂肪组织和小肠是主要合成场所,并与PL、CH和蛋白形成CM,由淋巴系统进入血循环并运送到肝外组织储存和利用。②体内脂肪酸一是机体自身合成,二是食物供给。特别是某些不饱和脂肪酸,人体不能合成,称为必需脂肪酸,如亚油酸、α-亚麻酸。③CH几乎在全身各组织均可合成,肝脏是主要场所,合成主要在胞液及内质网中进行,β-羟-β-甲戊二酸单酰辅酶A (HMG-CoA)还原酶是CH合成限速酶。多种因素对CH的调节主要是通过对此酶活性的影响来实现的。肝脏合成的CH除进入血循环中,还通过胆汁分泌进入肠道。来源于肝脏的CH与食物中CH一起,通过小肠绒毛上皮细胞刷状缘上一个独特的协助转运的载体蛋白(NPC1L1)家族,重新吸收进入血液[1]。
1.2 血脂异常的危险
血脂蛋白异常与急性冠脉综合征(acute coronary syndrome,ACS)和心脑血管疾病的发病或死亡率有极为密切的关系。据2005年世界卫生组织(WHO)统计显示:心脑血管疾病已成为中国第一死因,血脂异常总体患病人数超过2亿[2]。大量研究已证实血脂异常尤其是LDL-C升高,是加速动脉血管壁粥样硬化(冠状动脉、大脑中动脉、颈内动脉、椎-基底动脉)发生和发展最危险(易患)因素;也是血栓形成而致心肌梗死、脑卒中等缺血事件的始动因素[3]。在血管壁由血脂沉积所形成的不稳定型纤维斑块(易损斑块),其特点是脂质坏死中心大,纤维帽脆薄,并有大量炎症细胞,属于富含脂质的软性斑块。易损斑块栓帽破裂后,局部血小板发生异常聚集而促使血栓形成,可导致ACS、不稳定型心绞痛(unstable angina pectoris,UAP)、脑卒中(stroke)、急性心肌梗死(AMI),其中次全堵塞血管腔表现为非ST段抬高心肌梗死(NSTEMI)、完全堵塞管腔表现为ST段抬高心肌梗死(STEMI);而稳定型斑块由于斑块体积增加,使动脉管腔狭窄,阻塞管腔超过70%,导致缺血缺氧而发生稳定型心绞痛、脑血栓(血栓性梗死)。
1.3 血脂异常药物治疗的获益
高脂血症主要依靠药物和非药物治疗(多吃蔬菜、水果、谷物,少吃动物脂肪,坚持体力劳动和合理运动,增加肝内脂肪的分解和消耗),调节血脂的药物治疗不仅有效降低TC、TG及LDL-C水平,还能减少血管内皮过氧化[4],稳定或缩小动脉粥样脂质斑块,减少脑卒中和心血管事件的发生[5]。同时可改善胰岛β细胞功能,降低血清胰岛素,增加脂联素,抗氧化应激,改善胰岛素抵抗状态,减轻糖尿病并发症和炎症[6]。调节血脂药已从单一的调脂效应转变为一类新型抗动脉粥样硬化药,焕发青春迈入新的里程碑[7]。
来自14项他汀类治疗研究的90 056例患者,评估他汀类药治疗后LDL-C的降幅与主要冠脉事件和血管事件发病率的相关性。结果显示,LDL-C的降幅与1年的主要冠脉事件和血管事件发病率密切相关。总体而言,LDL-C每降低1 mmol/L,主要冠脉事件的发生率可显著降低23%(RR 为 0.77,95%CI=0.74~0.80,P < 0.000 1),而主要心血管事件(MACE)可显著降低21%(RR为 0.79,95%CI=0.77~0.81)[8]。
2012年8月发表的《欧洲心血管疾病防治指南》明确建议:对所有ACS者,一旦入院,无论其血脂水平如何,均应即给予负荷剂量的他汀类药,并按维持剂量稳定一定时期(一般用4~6周后再予以评估是否继续给药),即可极大降低MACE[6]。
2 药师在调节血脂药物治疗中宜注意监护下列问题
2.1 关注血脂异常的分型
临床上按血浆中各种脂蛋白增高的情况,将高脂血症一般分为五型六类。根据WHO的分类,各类型血脂异常的特点及发生机制见表1。
根据2007年《中国成人血脂异常防治指南》,对血脂异常患者开始调脂治疗的TC和LDL-C值及其目标值见表2。
2.2 调节血脂的药物治疗监护
2.2.1 针对血脂异常的类型选药 作为饮食治疗的补充,可使用调节血脂药,调节血脂药品种很多,效果各异。但就其作用机制而言,不外乎干扰脂质代谢过程中某一或几个环节,如减少脂质吸收,加速脂质的分解或排泄,干扰肝内脂蛋白合成或阻止脂蛋白从肝内传送进入血浆,增加脂蛋白从血浆中清除的速度等。但迄今为止,尚无1种药对所有脂质紊乱均有效,对脂质和脂蛋白的调节均有一定侧重。调节血脂药选用参考见表3。
2.2.2 提倡不同作用途径调节血脂药的联合治疗血脂异常多为混合性血脂增高,单一途径药物治疗往往难以奏效,主要缘于:①目前临床应用的调节血脂药没有全效药,作用仅侧重一二种脂蛋白,在降低LPL、富含 TG脂蛋白、升高 HDL、降低餐后血脂、改善LDL-C大小的特性和预防脂蛋白氧化等需要二三类不同作用机制药物互补,相得益彰。②他汀类药有“逃逸”现象,剂量加倍,降脂效果仅提高6%[10],如单纯增加瑞舒伐他汀剂量(10mg/d加倍)的降脂效果(降低LDL-C≤70mg/dL)达标率仅为21.5%,但瑞舒伐他汀+依折麦布10 mg/d达标率却提高至53.7%[11]。③人体对脂肪吸收有代偿(负反馈平衡)作用,过分抑制肝脏合成却提高小肠再吸收,肝脏合成CH 1 000 mg/d,胆汁内CH 1 000 mg/d;膳食中日摄入CH 3 000 mg/d,因此,需要多途径、全方位阻断CH的合成与吸收。
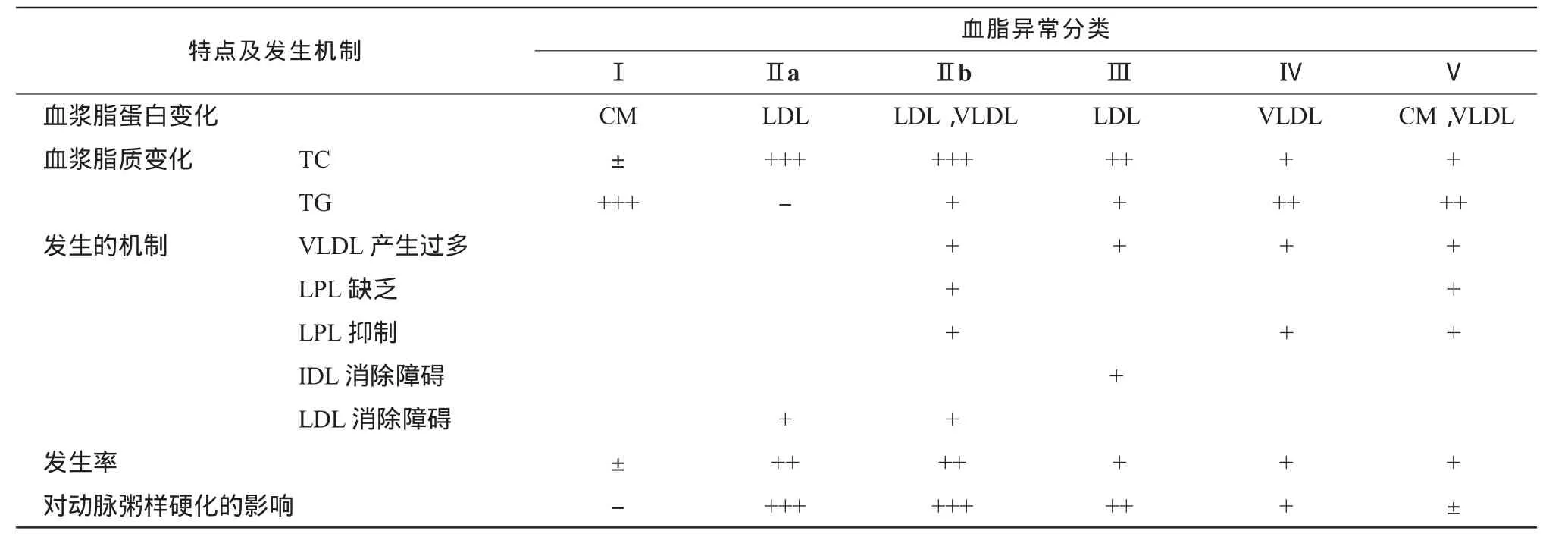
表1 各类血脂异常的特点及发生机制

表2 血脂异常患者开始调脂治疗的TC和LDL-C值及其目标值
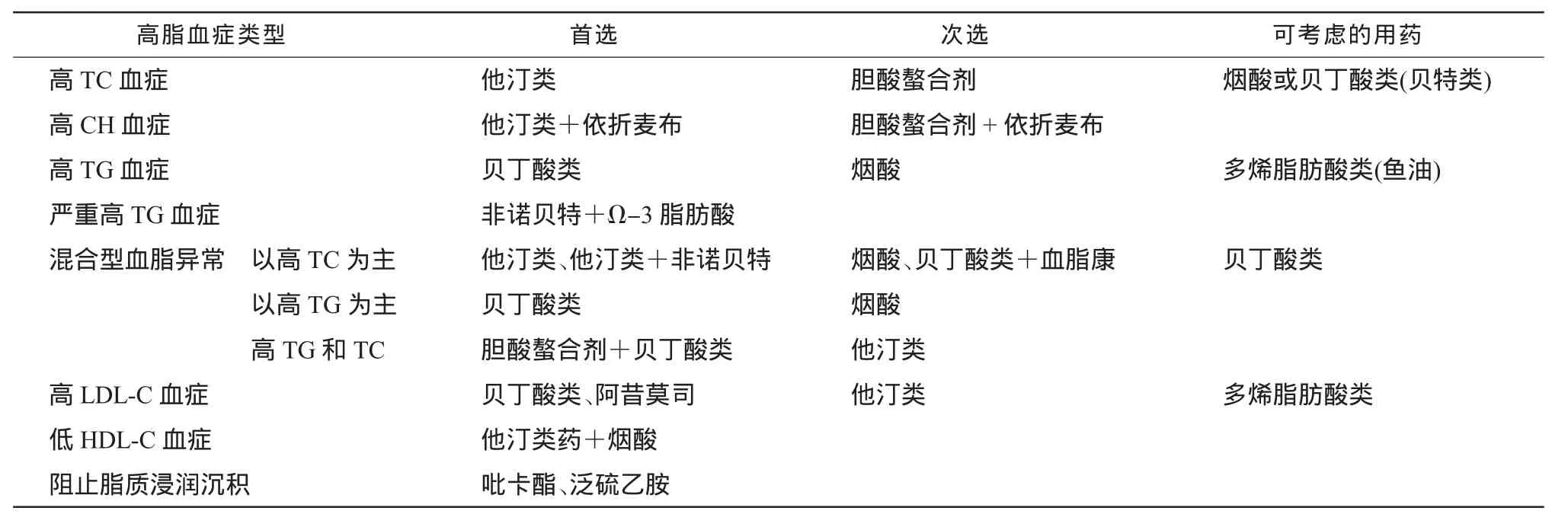
表3 调节血脂药的选用或联合用药参考[9]
对常规剂量他汀类药治疗后CH水平仍不能达标者,不适于或不耐受他汀类药治疗者,可应用依折麦布联合治疗;严重高CH血症者可直接联合应用依折麦布+中小剂量他汀类药治疗;以TG升高为主要表现的混合型血脂异常者,可联合应用非诺贝特+依折麦布;慢性肾病可联合应用依折麦布+中小剂量他汀类药改善心血管病预后。两类药联用效果较好(他汀类显著抑制肝脏合成CH,依折麦布抑制肠道CH吸收,二者协同可更加显著地降低血浆LDL-C),即“单药剂量加倍,不如两药合理搭配”。
1项名为EASEGO研究[12]对于辛伐他汀20 mg/d或阿托伐他汀10 mg/d单药治疗LDL-C未达标者(367例冠心病或2型糖尿病者),比较他汀类药剂量加倍和联合治疗2种方案的疗效。第1层患者的初始治疗药为辛伐他汀20 mg/d,第2层患者则为阿托伐他汀10 mg/d。两层患者中,其中一部分患者继续原他汀类药治疗,但剂量加倍,而另一部分则改用原剂量他汀类药+依折麦布10 mg联合治疗。结果与他汀类药剂量加倍的方案相比,联合治疗组LDL-C达标率显著更高(联合治疗组有67%患者LDL-C低于2.5 mmol/L,而接受辛伐他汀40 mg/d或阿托伐他汀20 mg/d组仅26%),并获得额外的 LDL-C降幅(17.6%),同时联合他汀类药治疗也改善了TC、TC与HDL-C的比值及Apo B水平。可见依折麦布与他汀类药联合治疗无论在降低LDL-C效果方面,还是提高LDL-C达标率上,均优于他汀类剂量加倍。INCROSS研究[13]将618例高危且他汀类单药治疗未达标者,进入6周的筛选期,随机分为2层:第1层患者接受普通剂量的他汀治疗,包括阿托伐他汀 10 mg/d,辛伐他汀 20 mg/d,普伐他汀 40 mg/d,氟伐他汀80 mg/d;另外1层患者则接受较大剂量的他汀治疗,包括瑞舒伐他汀5 mg/d,阿托伐他汀20 mg/d,辛伐他汀 40 mg/d。筛选期之后,没有达标的患者随机分为2组,1组接受瑞舒伐他汀10 mg治疗,另外1组则接受依折麦布10 mg+辛伐他汀20 mg治疗,疗程均为6周。结果发现,联合治疗组LDL-C降幅为27%,而瑞舒伐他汀10 mg组仅有16.9%,联合治疗组比单一治疗组LDL-C进一步下降达10%,并使其他血脂指标得到进一步改善[13]。EASE研究[14]对3 030例他汀类药治疗后LDL-C未达标者+依折麦布或安慰剂治疗。结果显示,依折麦布+他汀类药联合治疗可使 LDL-C进一步降低(25.8%vs.2.7%),LDL-C达标率进一步提高(71.0%vs.20.6%),TG进一步降低(-12.8 mg/dL vs.-1.6 mg/dL)。
2.2.3.关注各药的不良反应、禁忌证和药物相互作用 如瑞舒伐他汀不能与葡萄柚汁合用,以免因血浆药物浓度升高而出现不良反应[15];且用药期间不宜服用可降低内源性类固醇激素或活性的药物(螺内酯、西咪替丁)。依折麦布若与胆酸螯合剂联合应用时,应在用后者前至少2 h服用。
2.2.4 规避烟酸所致的血管、皮肤等反应 烟酸(nicotin acid)属水溶性 B族维生素,当用量超过作为维生素作用的剂量时,具有明显的降脂作用。可抑制VLDL分泌,减少LDL-C生成。
2.2.4.1 烟酸具有强烈的扩张血管作用,初始服用或剂量增大后可致恶心、呕吐、腹泻、发热、瘙痒、皮肤干燥、面部潮红等;大剂量可引起血糖升高、尿酸增加、肝功能异常。为缓解由前列腺素介导的这一效应,可应用小剂量的缓释制剂,或服药前30 min合用阿司匹林300 mg可以减轻,或每日服用 1次布洛芬200 mg[9]。
2.2.4.2 服用烟酸的患者,约有1/5人会发生高尿酸血症,有时甚至可发展为痛风,如出现血尿酸水平升高,痛风性关节炎时应即停药。
2.2.4.3 烟酸对有活动消化性溃疡、烟酸过敏者、严重的或原因未明的肝功能损害、动脉出血、儿童、妊娠及哺乳期妇女禁用。对有肝病史者慎用。患有原发高CH血症(Ⅰ或Ⅱ型)的妇女在服用烟酸过程中怀孕,应停止服用。烟酸可经乳汁排泄,哺乳期妇女应暂停哺乳。
2.2.4.4 与他汀类药联合应用应谨慎,治疗期间应定期监测肝功能和肌磷酸激酶(CK)。
2.2.4.5 烟酸可升高天冬氨酸氨基转移酶(AST),丙氨酸氨基转移酶(ALT)和碱性磷酸酶(ALP)水平,但不会引起肝毒性,患有黄疸性肝炎、肝胆疾病、糖尿病或消化道溃疡者,服用期间应该严格监控肝功能和血糖,以免出现严重不良反应。同时为避免烟酸所致的严重不良反应(气促、皮肤潮红、红斑、瘙痒、哮喘等),应尽量选服烟酸缓释片。
2.2.4.6 摄入乙醇可增加烟酸所致的皮肤潮红和瘙痒等不良反应,用药期间应避免饮酒。
2.2.5 定期监测血脂或安全指标,尤其是肌毒性调节血脂药的不良反应主要为胃肠道(腹痛、腹泻)和呼吸道(咽喉炎、流感样不适)、头痛、疼痛、疲乏等症状。但调节血脂药所致的肝毒性和肌毒性是不可轻视的。在服用他汀类药发生肌毒性(肌病、肌痛和横纹肌溶解症)的机制有:①药物作用于线粒体某些环节,使甲-羟戊酸盐缺乏,因而细胞合成泛癸利酮发生障碍,能量受到抑制,导致细胞能量耗竭死亡[16]。②改变胞膜脂质组成,影响胞膜的通透性和稳定性,并影响胞膜上的钠-钾通道,导致细胞损伤。③抑制HMG-CoA还原酶和下游甲羟戊酸通路。④增高肌细胞内钙浓度,使氯通道失活[17]。⑤联合应用属于肝酶抑制剂的药品,如干扰CYP3A4(洛伐他汀、普伐他汀、辛伐他汀、阿托伐他汀)、CYP2C8(洛伐他汀)、CYP2C9(氟伐他汀、瑞舒伐他汀)、CYP2CA19(瑞舒伐他汀)的代谢,使药物在体内蓄积,发生肌毒性,一般出现肌毒性症状时间在服药后24 h至6个月不等。因此,在用药期间必须监测肌损伤指标,其中CK作为骨骼肌和心肌疾病最为敏感的指标,其增高与骨骼肌、心肌受损的程度基本一致,故动态测定CK变化有助于病情的观察和预后估计。
3 在用药期间药师应注意监护
3.1 在用药期间肝功能 AST、ALT、血钙、ALP、CK、肌红蛋白(Mb)水平,如血清AST和ALT高于正常上限3倍(120 U),CK高于正常值10倍(250~2 000 U/L)以上,Mb 高于正常值 3 倍(70 ng/mL),并有弥散性的肌软弱、肌触痛、肌无力、跛行、赤褐色尿等情况时应考虑为肌病,若出现肌病后继续用药,则可进展为急性肾衰竭和横纹肌溶解症,须立即停药治疗,并对异常指标应跟踪观察。
3.2 以中等剂量他汀类和贝丁酸类药联合应用,肌病的发生率较低,剂量不宜过大,不宜在同一时间服用。或于晨起服用贝丁酸类药而晚上服用他汀类药;或隔日分别交替服用[9]。
3.3 应用他汀类药初始宜从小剂量起,并将肌病的危险性告知患者,关注及时报告所发生的肌痛、触痛或肌无力。
3.4 对有横纹肌炎继发肾衰竭的危险因素(严重急性感染、大手术、创伤、严重的代谢、内分泌和电解质紊乱、癫痫)者,应及时停用他汀类药。
3.5 肌病早期应大量补液,通过迅速将肌血球素清除出肾脏来预防病情的恶化,并应用利尿剂甘露醇、呋塞米帮助快速清除肾的肌血球素,以碳酸氢钠维持尿道碱性,有助于阻止肌血球素分裂成有毒化合物,并给以肌苷、泛癸利酮。
长期服用调节血脂药者中有2%可发生肝损伤,主要表现为肝脏AST和ALT升高,但为功能性、一过性、可逆性的反应,停药后多可恢复,主要机制为肝脂肪动力学结果,美国最新指南中,不宜要求定期监测肝功能指标,缘于定期监测并非可以预防肝脏毒性[17-18]。
4 掌握调节血脂药的适宜服用时间
人体70%~80%CH由肝脏合成,因此是形成高脂血症的主要原因。肝脏合成CH主要在夜间进行,合成峰时在凌晨2:00-3:00时,主要缘于:①CH合成酶系统在夜间合成增加。②雄、雌激素于夜间分泌增加,促进TG升高,使肝脏分泌LDL-C速度加快。③α-唾液淀粉酶活性最高。
4.1 服用他汀类调节血脂药宜在晚餐或睡前服用疗效更好,其缘于:
4.1.1 血浆药物峰浓度与达峰时间(2~3 h)与脂肪合成峰时同步。
4.1.2 他汀类药可抑制CH的合成,药物效应也体现出相应的昼夜节律,夜间服用效果好。
4.1.3 药品不良反应较小。
4.1.4 联合使用他汀类及贝丁酸类药者发生肌痛、横纹肌溶解症的危险性增加,特别是老年糖尿病患者使用阿托伐他汀、普伐他汀与1种贝丁酸类联合治疗横纹肌溶解症发生率由0.44%增至5.98%,而西立伐他汀与贝丁酸类联合治疗肌溶解症发生率由5.34%增至10.35%。因此,参考两类药物的血浆达峰时间,见表4。
规避同时服用而致的血浆峰期同步,以减少不良反应,可于晨起服用贝丁酸类药而晚上服用他汀类药,或隔日分别交替服用[9]。

表4 两类调节血脂药的血浆达峰时间和血浆半衰期
[1] Large V,Peroni O,Letexier D,et al.Metabolism of lipids in human white adipocyte[J].Diabetes Metab,2004,30(4):299-309.
[2] 孙忠实.药物基因组学与抗血小板药的个体化使用[J].中国医院用药评价与分析,2011,11(10):866-867.
[3] Nicholls SJ,Ballantyne CM,Barter PJ,et al.Effect of two intensive statin regimens on progression of coronary disease[J].N Engl J Med,2011,365(22):2078-2087.
[4] Molander L,Lovheim H,Norman T,et al.Lower systolic blood pressure is associated with greater mortality in people aged 85 and older[J].J Am Geriatr Soc,2008,56(10):1853-1859.
[5] Heart Protection Study Collaborative Group,Bulbulia R,Bowman L.Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20536 high-risk individuals: a randomised controlled trial[J].Lancet,2011,378(9808):2013-2020.
[6] Waters DD,Ho JE,DeMicco DA,et al.Predictors of new-onset diabetes in patients treated with atorvastatin results from 3 large randomized clinical trials[J].J Am Coll Cardiol,2011,57 (14):1535-1545.
[7] Perk J,De Backer G,Gohlke H,et al.European guidelines on cardiovascular disease prevention in clinical practice(version 2012).The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice(constituted by representatives of nine societies and by invited experts)[J].Eur Heart J,2012,33(13):1635-1701.
[8] Baigent C,Keech A, Kearney PM,et al.Efficacy and safety of cholesterol-lowering treatment:prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins[J].Lancet,2005,366(9493):1267-1278.
[9]李大魁,张石革.国家执业药师资格考试应试指南——药学综合知识与技能[M].北京:中国医药科技出版社,2011:136-137.
[10] Stein EA.Managing dyslipidemia in the high-risk patient[J].Am J Cardiol,2002,89(5A):50C-57C.
[11] Bays HE,Davidson MH,Massad R,et al.Safety and efficacy of ezetimibe added on to rosuvastatin 5 or 10 mg versus up-titration of rosuvastatin in patients with hypercholesterolemia(the ACTE Study)[J].Am J Cardiol,2011,108(4):523-530.
[12] Roeters van Lennep HW,Liem AH,Dunselman PH,et al.The efficacy of statin monotherapy uptitration versus switching to ezetimibe/simvastatin:results of the EASEGO study[J].Curr Med Res Opin,2008,24(3):685-694.
[13] Farnier M,Averna M,Missault L,et al.Lipid-altering efficacy of ezetimibe/simvastatin 10/20 mg compared with rosuvastatin 10 mg in high-risk hypercholesterolaemic patients inadequately controlled with prior statin monotherapy-The IN-CROSS study[J].Int J Clin Pract,2009,63(4):547-559.
[14] Pearson TA,Denke MA,Mcbride PE,et al.A community-based,randomized trial of ezetimibe added to statin therapy to attain NCEP ATP III goals for LDL cholesterol in hypercholesterolemic patients:the ezetimibe add-on to statin for effectiveness (EASE)trial[J].Mayo Clin Proc,2005,80(5):587-595.
[15] Bailey DG,Dresser G,Arnold JM,et al.Grapefruit-medication interactions:forbiddan fruit or avoidable consequences?[J].CMAJ,2013,185(4):309-316.
[16] Larsen S,Stride N,Hey-Mogensen M,et al.Simvastatin Effects on Skeletal Muscle:relation to decreased mitochondrial Function and glucose intolerance[J].J Am Coll Cardiol,2013,61 (1):44-53.
[17] Tandra S,Vuppalanchi R.Use of statine in patients with liver disease[J].Curr Treat Opions Cardiovasc Med,2009,11(4):272-278.
[18] 刘丽萍.他汀类药在脂肪肝治疗中的应用与肝脏安全性[J].中国医院用药评价与分析,2013,13(2):187-189.
