抗栓中药血栓心脉宁片对血管内皮细胞全基因表达谱的影响
2013-09-24刘建伟张晓天赛景影王鑫磊王槐栋
刘建伟,张晓天,张 超,赛景影,王鑫磊,王槐栋,王 放
血栓性疾病因其较高的发病率及致死率成为严重危害人类健康的疾病之一[1]。中药具有多靶点、多环节,且不良反应小等优势,在预防血栓形成、治疗血栓性疾病等方面具有良好的效果[2-4]。抗栓中药如血栓心脉宁(XXT)具有活血化瘀,扩张血管,抑制血小板聚集,降低血黏度,降低血脂,改善局部和全身血液循环及防治血栓的功效[3]。国内外已出现不少将基因芯片技术应用到中药药理机制研究中的报道[5]。这为抗栓中药的抗栓分子药理机制的研究开辟出了新的发展前景。利用高密度基因芯片检测中药给药前后基因表达谱的差异是开展中药分子药理研究的主要思路。
本研究观察人脐静脉内皮细胞(HUVEC)给药前后的基因表达谱差异,探索抗栓中药XXT对HUVEC的作用,为抗栓中药的药物研发和国际化应用提供理论依据。
1 材料与方法
1.1 试剂及仪器 HUVEC来自吉林大学白求恩医学院病原生物学实验室冻存;血栓心脉宁片购自吉林华康药业股份有限公司,国药准字Z20030145,产品批号:110601;IMDM培养基购自HyClone;总RNA快速提取试剂盒购自BioTeke;NucleoSpin RNA clean-up试剂盒购自 Macherey-Nagel;晶芯®cRNA扩增标记试剂盒购自CapitalBio;35KHuman Genome Array购自CapitalBio;PrimeScript®RRT reagent Kit购自 TaKaRa;SYBR®RPremix Ex Taq TM 购自 TaKaRa;双通道激光扫描仪购自CapitalBio;ABI 7300型荧光定量 PCR仪购自 Applied Biosystems。
1.2 细胞培养及实验分组 HUVEC细胞用含15%胎牛血清的IMDM培养液在37℃、95%氧、5%二氧化碳条件下培养,待细胞长满瓶底后,采用0.25%胰蛋白酶消化细胞,每2d~3d传代一次。实验分为正常对照组及XXT给药组。正常对照组加入含2%血清的IMDM培养液,XXT给药组给予终浓度为2.5mg/mL XXT的含2%血清IMDM培养液培养24h。
1.3 总RNA提取 采用总RNA快速提取试剂盒提取正常对照组及XXT给药组HUVEC的总RNA,并进一步采用NucleoSpin®RNA clean-up试剂盒对总RNA进行过柱纯化,最后用紫外分光光度计定量,甲醛变性胶电泳质检。
1.4 RNA荧光标记与杂交 RNA反转录合成1st-strand cDNA及2nd-strand cDNA,再以cDNA为模板合成cRNA,随机引物反转录,cDNA用KLENOW酶标记。标记的DNA溶于80μL杂交液中,于42℃杂交过夜,芯片洗涤后即可用于扫描。1.5 芯片扫描与分析 芯片采用LuxScan 10KA双通道激光扫描仪进行扫描,并用LuxScan 3.0软件分析,片间校正,片内归一化,根据信号强度和图像质量对基因进行标记,筛选差异表达基因。
1.6 差异表达基因的Real Time-PCR验证 对芯片结果筛选出的可能与药物抗血栓作用相关的差异表达基因血红素氧化酶(HMOX1)、RHOT1、集落刺激因子2(CSF2)和 ANXA8进行Real Time-PCR验证。引物合成均在上海生工生物工程技术有限公司合成。详见表1。

表1 引物序列合成
1.7 统计学处理 芯片数据进行标准化处理,去除偏移较大的荧光信号,采集信号强度(cy3或cy5)大于800的基因。芯片数据分析采用博奥公司提供的数据软件包进行t检验,并用MAS3.0进行pathway分析。
2 结 果
2.1 总RNA提取 正常对照组及XXT给药组HUVEC提取总RNA后,经琼脂糖凝胶甲醛变性电泳显示三条清晰的总特征条带:28s、18s、5s,且28s、18s两条带亮度比接近于2∶1,5s条带较暗,紫外分光光度仪测定:A260/A280值1.8~2.0之间,表明总RNA提取质量较好,未明显分解。
2.2 差异表达基因的筛选及生物学信息分析 比较芯片cy5和cy3的Ratio值并结合各生物学重复Ratio的均值筛选出表达基因,XXT给药组与正常对照组相比,有2 130个基因差异表达,其中790条基因出现显著表达上调,1 340条基因出现显著表达下调。经MAS对所得到的差异表达基因进行功能分析,发现多种基因与细胞的凋亡调控、氧化应激反应、炎性反应及抗凝因子等相关的基因。详见表2、表3。

表2 XXT处理HUVEC后表达上调的基因

表3 XXT处理HUVEC后表达下调的基因
2.3 Real Time-PCR结果 选取 HMOX1、RHOT1、CSF2及ANXA8等参与细胞凋亡、氧化应激反应及抗凝血等基因进行Real Time-PCR验证,验证结果与基因芯片结果一致。详见表4、图1。

表4 芯片差异表达基因的选取
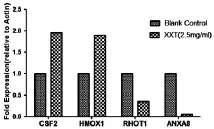
图1 Real Time-PCR验证结果
3 讨 论
血栓性疾病并发性疾病主要包括急性心肌梗死、脑血栓、肺静脉栓塞、动脉血栓和缺血性休克等,心脑血管疾病死亡者居各类死因之首[6]。
血管内皮细胞损伤与多种心血管疾病如动脉粥样硬化、高血压、血栓形成等密切相关[7]。目前,HUVEC在某些方面具有与动脉血管内皮生物学特征相似的优点而成为体外实验研究的重要研究对象[8-10]。
中药能促进细胞释放血管活性物质、促进内皮细胞增殖及减少细胞凋亡等方面保护血管内皮细胞[11,12]。近年来,随着生物信息学技术的迅猛发展,利用高密度的基因芯片检测中药给药前后基因表达谱的差异逐渐成为中药分子药理研究的主要思路[5]。Wen等[13]对中药复方制剂四物汤抗乳腺癌的作用机制及药物关联图谱进行了研究,利用基因芯片分析经四物汤处理前后MCF-7癌细胞株基因表达谱的变化,结果发现四物汤的细胞毒作用是通过多种分子机制来实现的,其中Nrf2信号传导通路起到了重要作用,与HMOX1,GCLC,GCLM,SLC7A11和NQO1等基因的表达上调有关。Wang等[14]利用基因芯片分析传统中药PHY906及CPT-11抗结肠癌的作用机制,结果发现PHY906可通过多种途径抑制肿瘤生长。
本实验利用基因芯片技术经筛查并验证抗栓中药作用于血管内皮细胞的分子作用靶点。研究发现,XXT作用内皮细胞24 h后,基因芯片分析筛选出差异表达大于1.5倍的基因2 130个,其中上调基因689个,下调基因1 399个,包括转录调节、炎症反应、免疫反应、细胞黏附、抗凋亡、信号转导等相关基因,说明XXT对HUVEC的保护作用是一个多基因、多途径的复杂过程,它包含了多种基因的相互作用及其调控蛋白的差异。上调基因中ANXA5、CSF2、HMOX1、CLCF1及 NRG1等基因参与细胞凋亡的负调控作用;ANXA5、TFPI、TFPI 2等基因具有抗凝功能;GCLM、FOS、HMOX1、PPP1R15B等基因参与调节氧化应激反应;CSF2、FOS、CXCL 1、CXCL2及 CXCL3等基因参与调节炎性反应;CITED2等基因可调节血管内皮的生成。XXT可通过上调此类基因的表达量来抑制HUVEC凋亡及氧化应激反应、促进血管内皮新生、抵抗血液凝固,保护内皮细胞,防治血栓形成。下调基因中,AKTIP、RHOT1等基因参与调节细胞凋亡;DHRS3、CRYZ等基因参与氧化还原酶的代谢作用;ANXA8、F8等基因参与调控体液水平。XXT可通过下调此类基因的表达量来抑制HUVEC凋亡、调节氧化还原代谢过程及体液水平等来达到抗血栓的作用。药物作用涉及细胞凋亡、氨基酸代谢及生物合成、Toll样受体、Jak-STAT等信号传导通路。提示XXT主要通过调节凋亡、炎症反应、抗凝学等基因及相关传导通路来发挥抗血栓作用。
为进一步验证基因芯片结果的可靠性,本研究对部分参与细胞氧化损伤反应、细胞凋亡及抗凝血等相关的差异表达基因中的上调基因CSF2、HMOX1及下调基因RHOT1、ANXA8进行验证,其结果与基因芯片的检测结果一致。其中CSF2也被称为及粒细胞-巨噬细胞集落刺激因子(GM-CSF),PK13/Akt信号转导途径,凋亡相关蛋白Bcl-2和Bax及一氧化氮都是其重要的下游因子,CSF2能够刺激多能干细胞和早期红细胞的增殖和分化,加速血管新生[15,16]。本研究中,XXT使CSF2的基因表达上调,推测该药可能通过抑制细胞凋亡,舒张血管来达到保护血管内皮细胞的作用。HMOX-1是血红素氧化的限速酶,可被创伤应激、内毒素、缺氧等因素诱导,产生铁蛋白、胆红素、CO等产物,通过抑制血管收缩等作用保护组织细胞,还可通过鸟苷酸环化酶活化P38有丝分裂原活化MAPK信号转导途径,激活蛋白C系统,在血栓形成过程中起抗凝作用。HMOX-1还有防止血管平滑肌细胞过度增生、抗血小板聚集、抗凋亡、诱导血管内皮细胞中抗凝血酶的合成等作用[17,18]。推测XXT可能通过上调该基因达到防治血栓的作用。RHOT1属于线粒体Rho GTPases家族成员之一,目前研究发现RHOT1参与线粒体的稳态及细胞凋亡[19,20]。本研究中,XXT诱导RHOT1表达下调,推测药物通过抑制细胞凋亡发挥抗栓作用。Annexin A8(ANAX8)是Annexin家族蛋白成员之一,是一类钙离子依赖的磷脂结合蛋白,在细胞生长、维生素D及胞外分泌等信号传导途径中起到了重要作用[21,22]。本研究中XXT可使ANAX8表达下调,推测XXT可通过调节细胞生长及内皮细胞分泌的细胞因子含量来发挥其药物作用。
[1] 刘龙涛,史大卓,陈可冀.心血管血栓性疾病“瘀毒”致病临床表征初探[J].世界中医药,2012,7(2):152-154.
[2] 张晓天,李敏,胡亚,等.血栓心脉宁片抑制急性血瘀大鼠血栓形成的研究[J].中西医结合心脑血管病杂志,2012,10(1):78-79.
[3] 崔黎明,张晓天,胡亚,等.血栓心脉宁片对急性血瘀大鼠血浆GMP-140及vWF的影响[J].中西医结合心脑血管病杂志,2012,10(1):76-77.
[4] 李敏,赵学忠,于水,等.血栓心脉宁片对大鼠肠系膜微循环障碍的改善作用[J].中国老年学杂志,2011,31(24):4868-4869.
[5] Efferth T,Miyachi H,Bartsch H,Pharmacogenomics of a traditional Japanese herbal medicine(Kampo)for cancer therapy[J].Cancer Genomics Proteomies,2007,4(2):81-91.
[6] 杨翠玲.心脑血管病的预防与治疗探讨[J].中国现代药物应用,2010,4(3):226-227.
[7] 吴旭彤,朱萱萱,李七一,等.中药对血管内皮细胞损伤的保护作用的研究进展[J].中华中医药学刊,2011,29(12):2648-2650.
[8] Liu J,Mak TC,Banigesh A,et al.Aldolase B knockdown prevents high glucose-induced methylglyoxal overproduction and cellular dysfunction in endothelial cells[J].Plos One,2012,7(7):e41495.
[9] Zhao H,Zhai M,Yi T,et al.Globular adiponectin protects human umbilical vein endothelial cells against apoptosis through adiponectin receptor 1/adenosinemonophosphate-activated protein kinase pathway[J].Chin Med J(Engl),2011,124(16):2540-2547.
[10] Li CJ,Guo SF,Shi TM.Culture supernatants of breast cancer cell line MDA-MB-231treated with parthenolide inhibit the proliferation,migration,and lumen formation capacity of human umbilical vein endothelial cells[J].Chin Med J(Engl),2012,125(12):2195-2199.
[11] Xu MG,Wang JM,Chen L,et al.Berberine-induced mobilization of circulating endothelial progenitor cells improves human small artery elasticity[J].J Hum Hypertens,2008,22(6):389-393.
[12] Ji KT,Chai JD,Xing C,et al.Danshen protects endothelial progenitor cells from oxidized low-density lipoprotein induced impairment[J].J Zhejiang Univ SciB,2010,11(8):618-626.
[13] Wen Z,Wang Z,Wang S,et al.Discovery of molecular mechanisms of traditional Chinese medicinal formula Si-Wu-Tang using gene expression microarray and connectivity map[J].Plos One,2011,6(3):e18278.
[14] Wang E,Bussom S,Chen J,et al.Interaction of a traditional Chinese medicine (PHY906)and CPT-11on the inflammatory process in the tumor microenvironment[J].BMC Med Genomics,2011,11(4):38.
[15] Sun Y,Guo QM,Liu DL,et al.In vivo expression of Toll-like receptor 2,Toll-like receptor 4,CSF2and LY64in Chinese chronic periodontitis patients[J].Oral Dis,2010,16(4):343-350.
[16] Teleron AA,Carlson B,Young PP.Blood donor white blood cell reduction filters as a source of human peripheral blood-derived endothelial progenitor cells[J].Transfusion,2005,45(1):21-25.
[17] Dulak J,Deshane J,Jozkowicz A,et al.Heme oxygenase-1and carbon monoxide in vascular pathobiology:Focus on angiogenesis[J].Circulation,2008,117(2):231- 241.
[18] Mustafa S,Weltermann A,Fritsche R,et al.Genetic variation in heme oxygenase 1 (HMOX1)and the risk of recurrent venous thromboembolism[J].J Vasc Surg,2008,47(3):566-570.
[19] Jiang H,He C,Geng S,et al.RhoT1and Smad4Are correlated with lymph node metastasis and overall survival in pancreatic cancer[J].Plos One,2012,7(7):e42234.
[20] Fransson S,Ruusala A,Aspenström P,et al.The atypical Rho GTPases miro-1and miro-2have essential roles in mitochondrial trafficking[J].Biochem Biophys Res Commun,2006,344(2):500-510.
[21] Karanjawala ZE,Illei PB,Ashfaq R,et al.New markers of pancreatic cancer identified through differential gene expression analyses:Claudin 18and annexin A8[J].Am J Surg Pathol,2008,32(2):188-196.
[22] White AH,Watson RE,Newman B,et al.AnnexinⅧis differentially expressed by chondrocytes in the mammalian growth plate during endochondral ossification and in osteoarthritic cartilage[J].J Bone Miner Res,2002,17(10):1851-1858.
