2007年~2010年H9N2亚型禽流感病毒分离株对SPF鸡的致病特性研究
2013-09-23王守春卢春晓王晓红徐守振王建琳李海英郭妍妍毕玉海尹燕博
王守春,张 毅,卢春晓,王晓红,徐守振,王建琳,李海英,周 顺,王 光,郭妍妍,毕玉海,尹燕博
(1.青岛农业大学动物科技学院,山东 青岛266109;2.中国兽医药品监察所,北京 海淀100081;3.青岛即墨市畜牧兽医局,山东 青岛266200;4.中国科学院 微生物研究所,北京 海淀100101)
H9N2亚型禽流感病毒在1966年的美国威斯康辛州一个火鸡养殖场中首次被分离到,目前已在全世界范围内广泛地流行。该亚型禽流感病毒在我国1994年首次被报道,现今已成为我国禽类养殖中,危害较大的一种传染病。H9N2病毒为低致病性禽流感病毒,在养殖环境下可引起家禽呼吸困难、腹泻、产蛋下降等症状,当继发细菌感染时可引起较高的死亡率;而在试验状态下,H9N2亚型禽流感病毒通常不能引起SPF鸡明显的症状和组织病变[1-3]。我们统计分析了本实验室2007年~2010年间分离的H9N2亚型禽流感病毒的鸡胚平均死亡时间(MDT),发现2008年下半年以来,部分H9N2病毒分离株的MDT显著地小于早期分离的毒株,数据说明这些毒株对SPF鸡胚的致病力更强。而这些毒株对SPF鸡的致病性是否增强,还不得而知,为了研究这些H9N2分离株对SPF鸡的致病特性,我们选择了MDT在60.5~96.3h之间的9株H9N2亚型病毒,测定了这些毒株的致病指数(IVPI),以及在SPF鸡体内的复制和排毒情况。试验结果表明,2008年以后分离的一部分H9N2亚型病毒增强了对SPF鸡的致病性。
1 材料与方法
1.1 病毒的分离与鉴定 9株病毒均由本实验室采集拭子或病料,通过接种10日龄SPF鸡胚分离,并经HI和NI试验鉴定病毒的亚型。
1.2 病毒的鸡胚半数感染量(EID50)及鸡胚平均致死时间(MDT)的测定 用无菌PBS对病毒进行连续10倍稀释,按照OIE规定的方法[4],接种10日龄SPF鸡胚测定病毒的EID50及 MDT,并利用Reed-Mueneh法进行计算[5]。
1.3 病毒的鸡静脉接种致病指数(IVPI)测定 将病毒液用无菌PBS作10倍稀释,按每只鸡0.1mL的剂量,翅下静脉接种10只6周龄SPF鸡,观察症状及死亡情况,并记录发病时间与死亡时间,连续观察10d,按照OIE规定的方法计算IVPI[4]。
1.4 SPF鸡人工感染排毒试验 将病毒液用无菌的PBS稀释至107EID50/mL,静脉接种6周龄SPF鸡,每组13只,每只0.2mL,病毒接种后第3天,第5天和第7天采集7只攻毒鸡的喉头及泄殖腔拭子,采集的拭子做无菌处理后,接种SPF鸡胚,每个拭子接种5枚,37℃孵育72h,测定鸡胚尿囊液的HA效价,同一拭子接种的3枚鸡胚中之一HA效价大于24即判定为病毒分离阳性。
1.5 感染鸡的病毒组织脏器分布及载量 病毒接种后第3天和第5天每组各剖检3只鸡,取气管、肺、肾、脑和十二指肠,然后称量各个组织脏器的重量,加10倍体积的PBS,无菌研磨匀浆,3 000r/min离心10min,取上清液接种10日龄SPF鸡胚测定各组织脏器中的病毒载量。
2 结果
2.1 H9N2分离株对鸡胚的致病力 9株H9N2亚型禽流感病毒EID50,半数致死量(ELD50),MDT测定结果见表1。
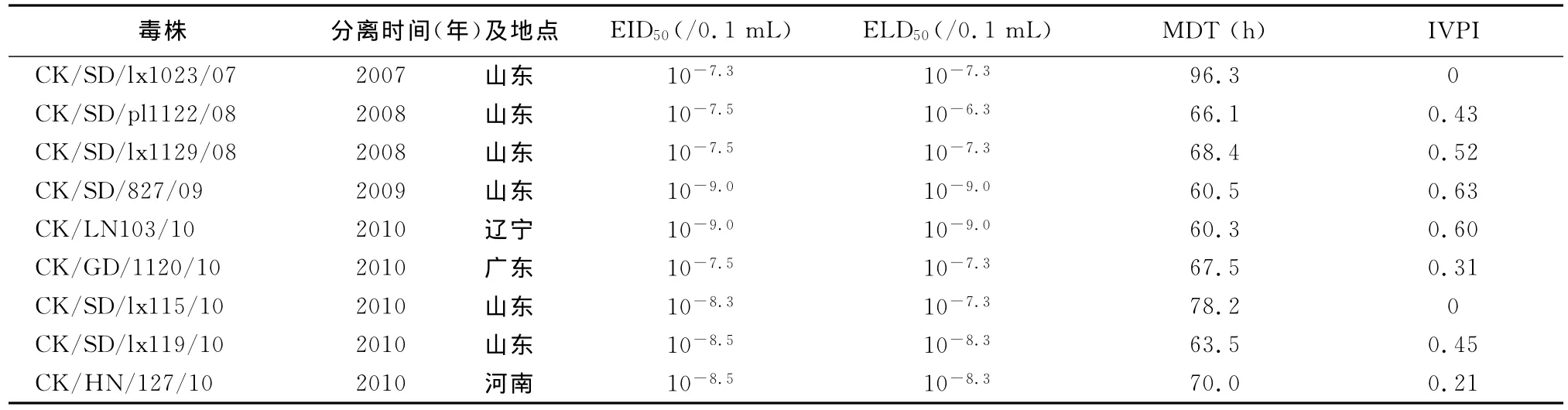
表1 EID50,ELD50,MDT和IVPI测定
由表1可以看出,这9个H9N2亚型分离株对鸡胚的致病力差异较大,从各项指标来看,CK/SD/827/09在鸡胚中的增殖能力最强,其EID50可达到10-9/0.1mL,而且其对鸡胚的致病力也最强,其MDT值可达到60.5h。
2.2 H9N2分离株对SPF鸡的致病力 为了测定这些H9N2分离株对SPF鸡的致病力,我们对各分离株的IVPI进行了测定。从表1的数据中可以看出,所有的这些H9N2分离株的IVPI值均未达到高致病性禽流感毒株的标准,尽管如此,不同毒株对SPF鸡的致病力还是存在明显的差异。在接种CK/SD/lx1023/07病毒后,所有的SPF鸡均未出现任何临床症状,与对照组相比无明显差异。而在CK/SD/827/09毒株的接种组,在接种后的2~5d,个别鸡表现出精神沉郁,缩头闭眼的情况,另有个别鸡出现下痢,并且整体出现食欲下降,但并没有鸡死亡。IVPI和接种后的临床症状观察表明,这些H9N2病毒分离株对SPF鸡的致病力存在一定的差异,且这种差异与其对鸡胚的致病力存在相关性。
2.3 H9N2分离株在SPF鸡体内的分布和复制能力不同的H9N2分离株对SPF鸡表现出不同的致病性,为了验证这种致病力的差异是否是由于其在鸡体内的复制能力差异引起的,我们测定了病毒在鸡体内的分布和各个组织器官的病毒载量。见表2。
从表2中我们可以观察到,对SPF鸡致病力强的毒株其在鸡体内的分布要比致病力低的毒株更广泛,其中 A/CK/SD/827/09 和 A/CK/LN/103/10是对SPF鸡IVPI指数最高的两个毒株,这两个毒株在测定的肺、气管、脑、肾和十二指肠全部可以分离到,而对SPF鸡IVPI指数最低的 A/CK/SD/lx1023/07,只能在攻毒后3d的气管中分离到病毒。这说明H9N2毒株间的致病性差异与病毒在体内的扩散存在联系,强致病性的毒株比致病力较弱的毒株具有更广泛的组织嗜性。从病毒的复制情况来看,对SPF鸡致病力强的毒株在鸡体内各个组织器官的复制能力要更强,其中 A/CK/SD/827/09和A/CK/LN/103/10这两个毒株几乎在各个组织器官中的复制能力都是最强的,而且对SPF鸡的致病力也是最强的。这说明病毒的复制能力与病毒对SPF鸡的致病性呈正相关性。
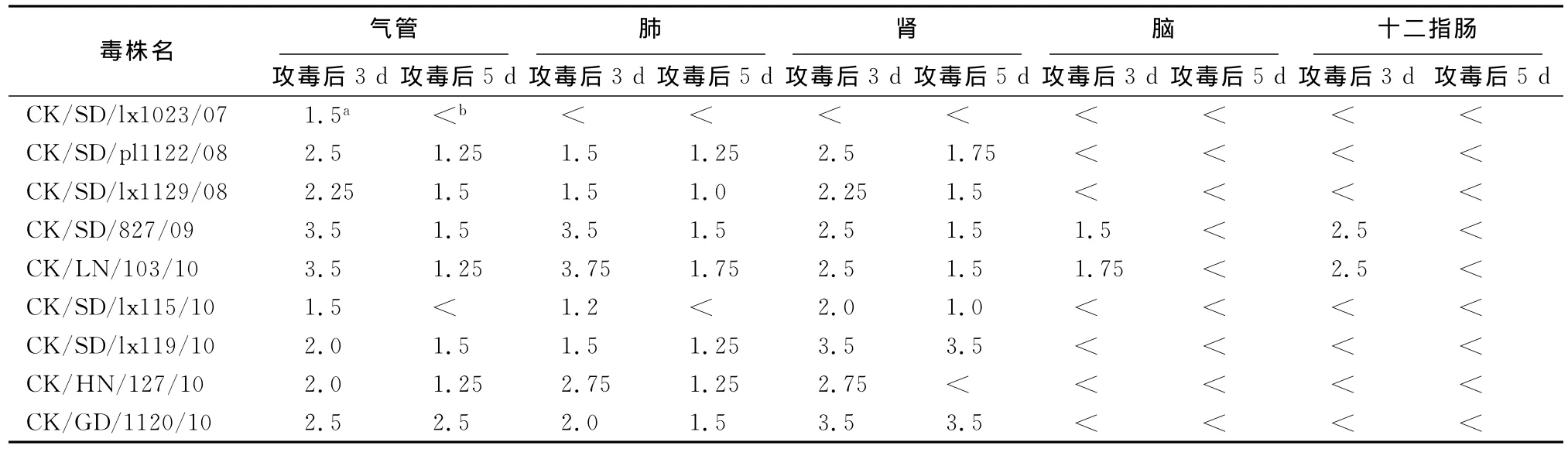
表2 攻毒后H9N2病毒在鸡脏器中的复制
2.4 H9N2分离株在攻毒后的排毒情况 因为H9N2病毒在鸡群中的传播与感染鸡的排毒情况有直接的联系,所以我们测定了感染鸡在口腔和泄殖腔的排毒情况。见表3。

表3 H9N2病毒攻毒鸡排毒情况
表3的数据表明,在感染后的第3天,所有的攻毒组均存在排毒的情况,而对鸡致病力强的毒株可以造成更高比例的感染鸡排毒。而在感染后的第7天,只有对鸡致病力较强的毒株,例如A/CK/SD/827/09和A/CK/LN/103/10等攻毒组,存在感染鸡的排毒,而且排毒鸡的比例也与病毒致病力呈正相关。
3 讨论
虽然H9N2亚型流感病毒并非高致病性流感病毒,但由于其流行范围广,流行时间长,因此给我国的养禽业造成了严重的危害。为了控制和预防H9N2亚型流感病毒,我国的养殖场从1998年左右即开始使用H9N2亚型流感病毒灭活疫苗[6]。虽然疫苗的使用对H9N2病毒的防控起到了一定的效果,但是由于免疫压力的普遍存在,流感病毒的进化和变异比以往更加迅速,新的变异株不断地出现[7],而且在水禽,鹌鹑,鸭和猪等宿主中,H9N2亚型流感病毒与其他亚型流感病毒的混合感染,导致重排病毒不断地出现[6,8-9]。对于新出现的流感病毒的监测,是流感防控工作非常重要的环节,而且具有重要的公共卫生学意义。在前面的研究中,我们及其他学者对于H9N2病毒在我国的进化和变异进行了详细地报道[9-10],而对于流行毒株的致病性却缺乏系统的研究。在本试验中,我们对近期在我国分离到的H9N2毒株对SPF鸡的致病特性进行了研究和比较。
本研究发现2007年~2010年在我国流行的H9N2毒株对SPF鸡的致病性存在一定的差异,部分毒株对SPF鸡呈现较强的致病力,这可能是由于这些毒株在鸡体内的系统性感染,和较高的复制能力。由于病毒的传播与扩散与鸡群在感染后的排毒相关,所以我们测定了这些H9N2毒株在感染后的排毒情况,数据表明,对SPF鸡呈现较高致病力的毒株在口腔和泄殖腔的排毒能力也较强,这表现在感染鸡排毒的比例较高,而且排毒时间较长。H9N2病毒在感染后的排毒能力可能与其在鸡体内的复制能力相关。在以前的研究中,H9N2病毒接种SPF鸡一般不表现出临床症状,毒株对SPF鸡没有明显的致病性[1]。而在本试验中,2008年以后分离的部分的H9N2毒株在接种SPF鸡以后,却表现出一定的致病力,而且这些毒株相比致病力较弱的毒株,感染SPF鸡后排毒能力更强。这些情况说明H9N2病毒在基因组变异和进化的过程中,可能获得了某些对致病性产生影响的突变或重排方式,这需要在以后的研究中加以证明。
H9N2亚型流感病毒在存在广泛免疫压力的条件下,在鸡群中不断地进化,新的抗原变异株或毒力变异株可能会不断地出现,所以我们应该继续对H9N2亚型流感病毒给予充分的关注,不仅仅要关注毒株基因的进化,而且还应该注意其毒力的变异,研究病毒致病力变化的机理,开发针对新变异株的疫苗,为H9N2亚型禽流感的防控奠定坚实的基础。
[1] Bano S,Naeem K,Malik S E.Valuation of pathogenic potential of avian influenza virus serotype H9N2in chickens[J].A-vian diseases,2003,81:817-822.
[2] Kishida N,Sakoda Y,Eto M,etal.Co-infection of Staphylococcus aureus or Haemophilus paragallinarum exacerbates H9N2influenza A virus infection in chickens[J].Archives of Virology,2004,149:2095-2104.
[3] Okamatsu M,Sakoda Y,Kishida N,etal.Antigenic structure of the hemagglutinin of H9N2influenza viruses[J].Archives Of Virology,2008,153:2189-2195.
[4] OIE.Manual of diagnostic tests and vaccines for terrestrial animals[M].Paris,France:Office International des Epizooties,2011.
[5] Reed L J,Muench H.A simple method of estimating fifty per cent endpoints[J].American Journal of Epidemiology,1938,27:493-497.
[6] Li C,Yu K,Tian G,etal.Evolution of H9N2influenza viruses from domestic poultry in Mainland China[J].Virology,2005,340:70-83.
[7] Liu H Q,Liu X F,Liu W B,etal.Genetic mutations of the hemagglutinin gene of the H9N2subtype avian influenza viruses on closed-type chicken farms within a 5-year period[J].Acta Micrbiologica Sinica,2003,28:16-21.
[8] Guan Y,Shortridge K,Krauss S,etal.Molecular characterization of H9N2influenza viruses:Were they the donors of the“internal”genes of H5N1viruses in Hong Kong?[J].Proceedings of the National Academy of Sciences of the United States of America,1999,96:9363-9367.
[9] 甘孟侯.禽流感[M].2版.北京:中国农业出版社,2002.
[10]Zhang Y,Yin Y,Bi Y,etal.Molecular and antigenic characterization of H9N2avian influenza virus isolates from chicken flocks between 1998and 2007in China[J].Veterinary Microbiology,2012,156:285-293.
