LED光照对拟南芥叶绿素含量和根生长发育的影响
2013-09-22周小丽刘木清
刘 颖,林 娟,周小丽,刘木清
(1.复旦大学 电光源研究所,先进照明技术教育部工程研究中心,上海,200433;2.复旦大学 遗传工程国家重点实验室,生命科学学院,上海,200433)
传统农业依靠太阳光来促进植物生长,会受到很多的因素,包括气候、日照、土壤条件、温度等的影响.随着人口的增长,我们需要用有限的土地种植足够多的食物来满足现实的要求.设施农业的出现使植物栽培的集约化、商品化成为可能[1].现今最高水平的设施农业是继温室栽培之后的植物工厂.植物工厂将植物的生长环境与外界隔离,能够有效地降低气候和环境灾害对植物生长的影响,并且提高了土地的利用率.植物工厂作为一种三赢的新型栽培技术,是未来农业发展的主流.LED(Light-Emitting Diode,发光二极管)作为新一代的节能高效新型光源的出现,具有优于传统植物照明光源所不具有的优势,为植物工厂的照明环境的设计提供了更多的可能[2-3].
在光照对植物生长的影响方面,有不少学者做过许多工作.Bula等将莴苣在LED和蓝色荧光灯(波段在400~500nm)的混合光源下培养21d后,与在冷白光荧光灯和白炽灯混合光源下培养情况相比较,发现两者生长情况相当,但用LED和蓝色荧光灯光源能够将能量消耗减少一半[4].Goins等研究了小麦在红光LED照射下与在红光混合10%蓝光照射下的生长情况,发现小麦能够在红光照射下完成其生长周期,而且在红蓝混合光照射下的小麦能够长得更大且孕育更多种子[5].由于蓝光LED出现较晚,早期使用蓝色荧光灯作为蓝光光源.随着蓝光LED的出现,人们逐渐用蓝光LED光源来代替蓝光荧光灯,能够更好地控制蓝光波段的光波长.Matsuda等通过实验发现水稻在660nm红光和470nm蓝光下生长时,其叶片光合速率高于仅用红光进行补光照明的情况[6].徐凯使用不同的薄膜来设置草莓生长的光环境,研究草莓在不同光照条件下的生长情况[7].闻婧等将莴苣幼苗长成二叶一心时定植于不同的红蓝光比例的光照环境下,发现莴苣的叶绿素含量会随着红蓝光比值的下降而下降[8].铁皮石斛组织培养苗在LED照明光环境下培养90d后其叶绿素含量随着红蓝光之比的增加而先升高再降低[9].Nhut等人将草莓放置于红蓝光质比分别为1∶0,9∶1,8∶2,7∶3且光量子通量密度为45μmol·m-2·s-1的光环境下培养30d,并将实验重复3次后发现,在45μmol·m-2·s-1的光照下,叶绿素的含量是随着红蓝光质比增高而下降的[10].以上研究均表明叶绿素的含量会受到不同的光照条件的影响.不同的光波段对植物的生长状况的影响是不同的,植物生长的不同阶段对光照的需求也是不一样的.他们均是在植物长成幼苗以后再进行光照实验,但光照对植物的影响也有可能因为其生长阶段的不同而不同.因此本文将拟南芥从萌发阶段就放置在预先设计好的光环境中进行培养,从红蓝光强度,红蓝光比例角度进行了纵向的比较,并在相同的光量子通量密度下,与荧光灯光照环境下拟南芥的生长进行了横向的比较,研究了光照对拟南芥从萌发后到初步长成6~8片叶子期间的影响.
1 材料及方法
1.1 拟南芥培养基的制备
培养材料:拟南芥Col 0野生型;MS培养基:MS粉(Sigma)4.41g·L-1,蔗糖(上海强顺)30g·L-1,琼脂8g·L-1,milliQ水(Millipore)1L.
拟南芥的培养:取适量新鲜拟南芥种子,依次经75%乙醇处理30s,无菌水清洗2~3次,18%次氯酸钠处理8min,无菌水清洗2~3次,无菌吸水纸吸干,置于预先配置好MS培养基的无菌培养皿上.
1.2 光环境设计
基于叶绿素a、b的吸收谱,我们选择了两种分别位于红蓝光波段的LED光源.蓝光LED光源主波长位于454nm,其色纯度为98.6%;红光LED光源主波长位于638nm,其色纯度为100%.将色温为6 212K的荧光灯作为实验的对照组.为了能更好地调控LED灯具光照强度,开发了一套基于RS485协议的LED照明控制系统.通过这套系统,LED光照的强度可以通过计算机实现0%~100%连续调节,其调光等级与输出功率之间的关系如图1(见第764页)所示.实验设置3个22℃恒温箱,编号为Ⅰ、Ⅱ、Ⅱ.在实验箱Ⅰ、Ⅱ中分别安装两个功率线性可调的LED照明系统,实验箱Ⅲ中均匀安装4个恒定功率为8W的荧光灯.实验箱Ⅲ中荧光灯全功率输出,其平均光量子通量密度(PPFD:Photosynthetic Photon Flux Density,单位为μmol·m-2·s-1)为64μmol·m-2·s-1左右,将LED光照箱Ⅰ的调光等级设置为红光50%、蓝光10%,LED光照箱Ⅱ的调光等级设置为红光10%、蓝光4%.采用KIPP&ZONEN PAR光量子通量密度探头和METEON记录仪对实验环境的光量子通量密度进行测量.3个培养箱采用同一时间控制器,每天的光照时长为16h.一共调配27个培养皿,每个培养箱中放置9个.表1为中数据为培养皿所在位置的光量子通量密度值,其中“总强度”表示在实验环境按照上述设置时,所测的光量子通量密度;B列为只开启蓝光LED光源时的光量子通量密度,R列为只开启红光LED光源时的光量子通量密度.培养皿编号的上标1)、2)、3)表示该编号的培养皿是放置在相应实验箱Ⅰ、Ⅱ、Ⅲ中.
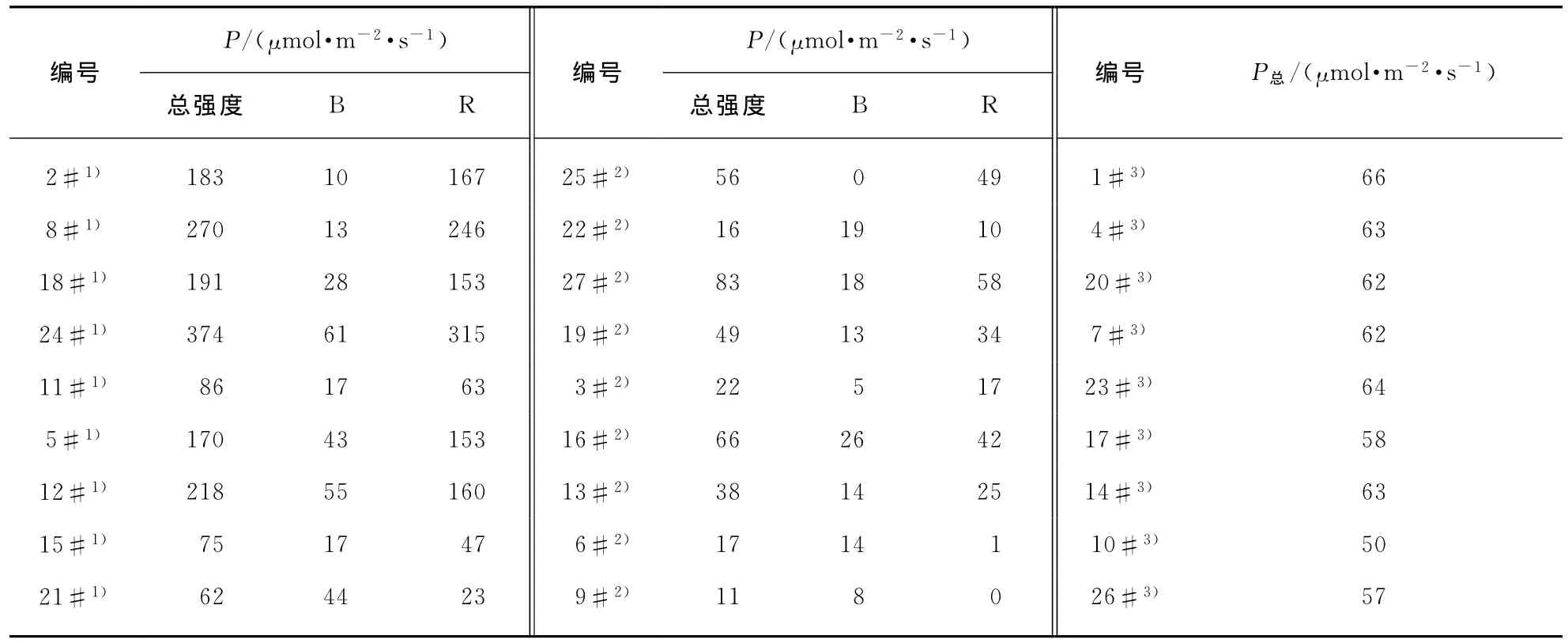
表1 培养皿分组及其相应光环境Tab.1 Petri dish grouping and corresponding light condition
1.3 叶绿素含量测定方法
根据叶绿体色素提取液对可见光谱的吸收特性、郎伯-比尔定律和相应公式可以计算出提取液中各色素的含量.实验中采用丙酮提取法.将拟南芥的叶子取下并记录其鲜重.将叶片浸泡于浓度为80%的丙酮溶液中遮光放置48h.使用SPECTRA MAX M5分别测试不同样品在663nm和645nm光照下的吸光度A663,A645.然后根据以下公式计算出相应溶液中叶绿素浓度 Ca,Cb,Ca+b,单位为 mg·L-1.
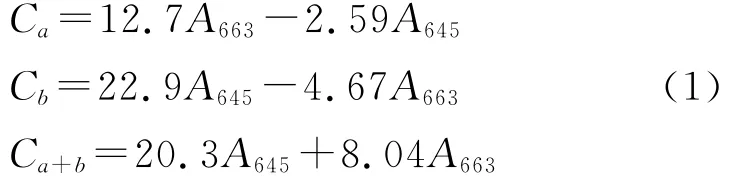
图1 LED灯调光等级与功率之间关系Fig.1 The relationship between dimming level and power consumption of blue and red LED light sources(N 为功率,η调光为调光等级,%.)
相应叶绿素a,b,a+b含量可通过将公式(1)中所计算出的叶绿素浓度带入以下公式(2)求得,单位为 mg·g-1.

其中,ρ为叶绿素含量(mg·g-1);C为丙酮提取液中相应叶绿素的浓度(mg·L-1);V 为溶液体积(mL);A为取样鲜重(g).
2 实验结果与分析
2.1 光照对叶绿素含量的影响
将培养皿按照设计放置在培养箱培养25d后,取其叶片,采用丙酮提取方法测量叶绿素含量.结果表明在PPFD为64μmol·m-2·s-1左右的时候,荧光灯和LED灯下样品的叶绿素a+b平均含量分别为1.45mg·g-1和1.52mg·g-1,两者相差0.07mg·g-1.
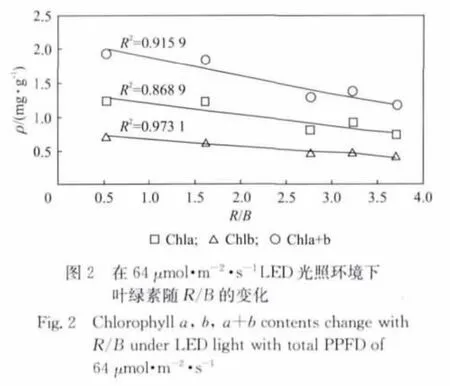
我们将叶绿素含量与红蓝光质比(即红光与蓝光PPFD之比,用R/B表示)、红光PPFD、蓝光PPFD之间的关系用图2~图5表示,其中Chla,Chlb,Chla+b表示与叶绿素a、b、c相对应的曲线.从图2可以看出,当PPFD在64μmol·m-2·s-1左右时,叶绿素的含量随着红蓝光比值的增高而线性降低.即在此光量子通量密度下,454nm的蓝光对叶绿素的形成的促进作用要优于638nm的红光.图3中是当光量子通量密度和红蓝光质比均发生变化的时候,叶绿素含量随着R/B值变化的情况.对图3中数据进行线性拟合,拟合相关系数R2较小.分别与Chla,Chlb,Chla+b对应的相关系数R2为0.170 9,0.289 9和0.235 6.这说明,叶绿素含量是与红蓝光质比以及红蓝光强度三者相关的物理量.它的整体趋势随着R/B的降低而降低的,从图2~图3中可以看出,在454nm和638nm的光环境下,蓝光对实验中样品的叶绿素的影响是高于红光.将叶绿素含量与蓝光PPFD的关系绘制成图4,直接将Chla,Chlb,Chla+b拟合成6次多项式后的曲线与原数据点的相关性可以分别达到0.945 1,0.717 9和0.908 8.使用同样方法将叶绿素含量与635nm的红光的数据点进行拟合,只能得到相关度为0.437 2,0.675 4和0.560 8的曲线,如图5所示.在图4中标记出Chla+b数据点的红光PPFD值(原点旁边的数字即为相应点处的红光PPFD值).将该标记值与蓝光PPFD值结合比较,发现当454nm的蓝光PPFD小于30μmol·m-2·s-1时,叶绿含量会随着红光的增高而降低.这可能因为在低光照条件下,叶绿素对638nm红光的强度更敏感.由于植物体中叶绿素的形成和分解为动态的过程,在弱光照下,相对较强的635nm红光有可能加速了叶绿素的分解或者降低了叶绿素的合成速度.
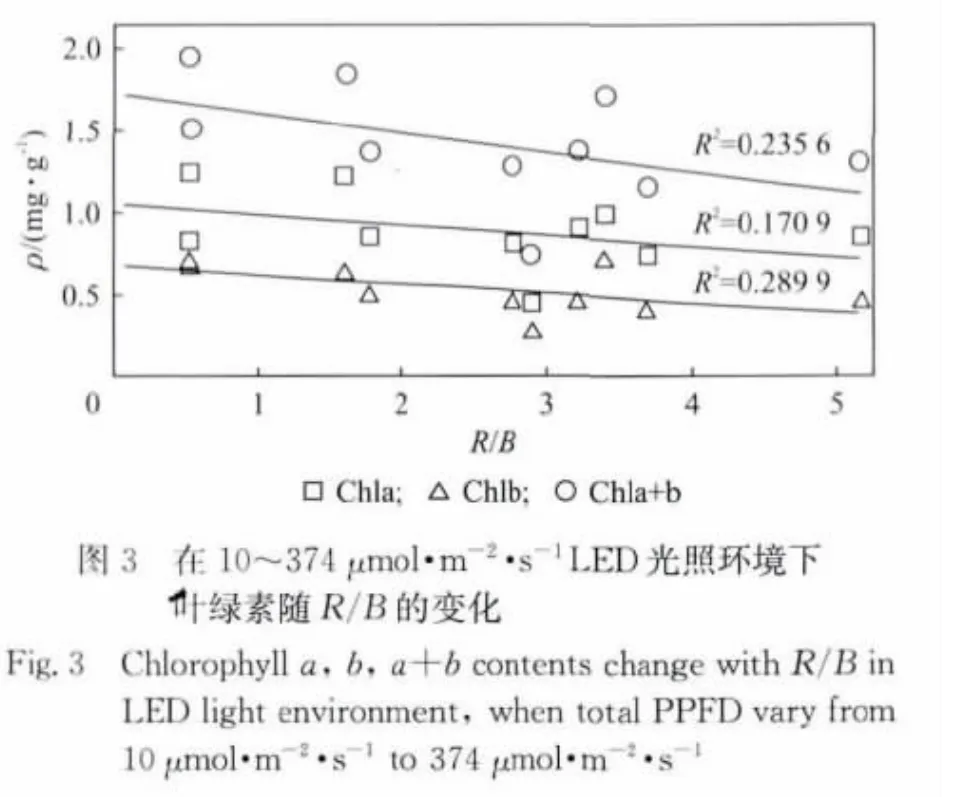
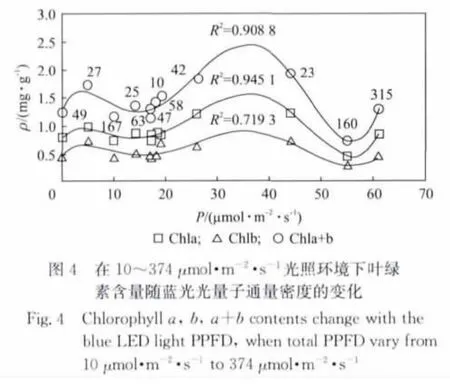
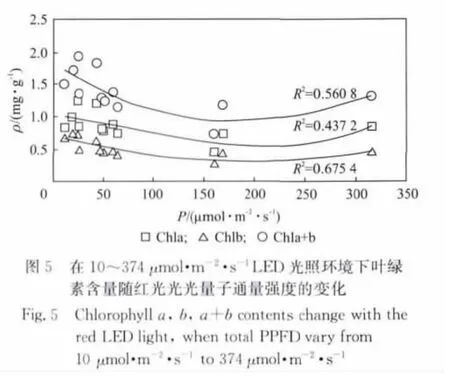
2.2 光照对根系长度的影响
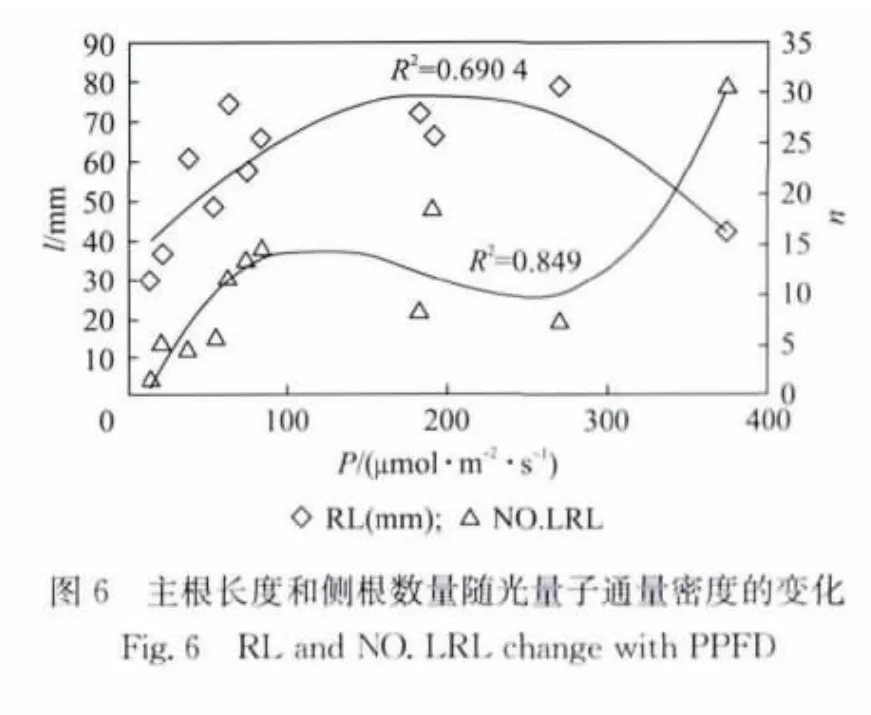
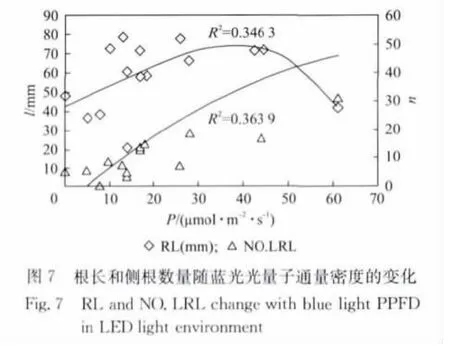
植物根系作为植物的一个重要的营养器官,在植物的生长过程中为其提供必不可少的养分和水分.由于植物的根系主要生长在地下,人们主要关注温度、pH值、水分等对植物根系的影响.而实际上不同的光照条件对根的生长也起着一定的作用[14].本次实验采用方形培养皿(立体放置),可以直观地观察拟南芥在不同光照条件下根系的生长情况.实验结果如图6~图8(见第766页)所示,其中RL表示根系长度(l,mm),NO.LRL(n)表示主根上的侧根数量.拟南芥主根长度先随着PPFD的增加而增加.当PPFD大于200μmol·m-2·s-1时,主根长度又随着PPFD的增加而减短(图6).图7和图8中可以看出红光与蓝光的PPFD增加时,对主根的生长是先促进再抑制.蓝光下主根的饱和点约为40μmol·m-2·s-1,红光约为120μmol·m-2·s-1.与对主根生长的效应相似,红光对主根上的侧根数量也是先促进后抑制.值得注意的是,图8中当红光PPFD为0μmol·m-2·s-1时,蓝光PPFD为8μmol·m-2·s-1(对应样品9#)拟南芥没有侧根出现.而当蓝光PPFD为0μmol·m-2·s-1时,红光PPFD位49μmol·m-2·s-1(对应样品25#),平均出根数为5.73.表明红光有促进侧根萌发的作用.
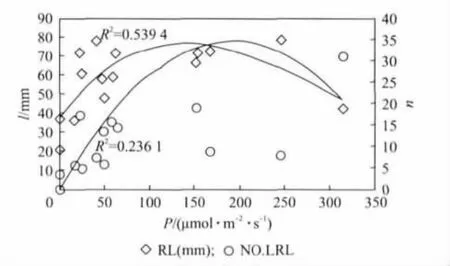
图8 在10~374μmol·m-2·s-1 LED光照环境下根长和侧根数量随红光光量子通量强度的变化Fig.8 RL and NO.LRL change with red light PPFD in LED light environment,when total PPFD vary from 10μmol·m-2·s-1 to 374μmol·m-2·s-1
3 结论与讨论
在光环境设计中,由于荧光灯不能单独控制其红蓝光部分,不能分别测量其红蓝光的PPFD值,因此不考虑荧光灯的红蓝光质比.由于存在测量误差且LED照明是需要一定的稳定时间,所以测得的LED光环境下的总光量子通量密度并不一定等于红蓝光光量子通量密度之和.整体实验设置中,LED实验箱①的光量子通量密度高于实验箱②.这种实验光环境设计主要用于不同LED光照强度下的样品之间的对比.
现有实验数据表明,在对比荧光灯组与LED照明组时,相同的光量子流密度下(64μmol·m-2·s-1),荧光灯和LED灯下样品的叶绿素a+b平均含量分别为1.45mg·g-1和1.52mg·g-1,两者相差0.07mg·g-1.在现有的实验数据上,拟南芥的根系长度随着PPFD的增加先增后降.主根长度的饱和值在红光下约为120μmol·m-2·s-1,蓝光下约为40μmol·m-2·s-1.当红光PPFD值增加时,主根上侧根的数量先增加后减少,顶点出现在约200μmol·m-2·s-1处.实验中没有找到主根上侧根数量相对应蓝光PPFD的饱和点.本实验中的样本数据量较少,在后续的实验中应本实验的基础上适量增加样本数.本实验中只做了一个PPFD强度下的LED与荧光灯的对照组.后续工作中应增加不同PPFD水平下的对照组并增加样本数量,验证在不同PPFD水平下的LED叶绿素和跟长的变化趋势,同时可以增加观测的参数和增加测试周期.
[1]张晓文.设施农业的发展现状与展望[J].农机推广与安全,2006(11):6-8.
[2]魏灵玲.杨其长,刘水丽,LED在植物工厂中的研究现状与应用前景[J].中国农学通报,2007,23(11):408-411.
[3]杨其长,徐志刚,陈弘达,等.LED光源在现代农业的应用原理与技术进展[J].中国农业科技导报,2011,13(5):37-43.
[4]Bula R J,Morrow R C,Tibbitts T W,et al.Light-emitting Diodes as a Radiation Source for Plants[J].HortScience,1991,26(2):203-205.
[5]Goins G D,Yorio N C,Sanwo M M,et al.Photomorphogenesis,photosynthesis,and seed yield of wheat plants grown under red light-emitting diodes(LEDs)with and without supplemental blue lighting[J].Journal of Experimental Botany,1997,48(312):1407-1413.
[6]Matsuda R,Ohashi-Kaneko K,Fujiwara K,et al.Photosynthetic characteristics of rice leaves grown under red light with or without supplemental blue light[J].Plant & Cell Physiol.2004,45(12):1870-1874.
[7]徐 凯,郭延平,张上隆.不同光质对草莓叶片光合作用和叶绿素荧光的影响[J].中国农业科学,2005,38(2):369-375.
[8]闻 婧,鲍顺淑,杨其长,等.LED光源R/B对叶用莴苣生理性状及品质的影响[J].中国农业气象,2009,30(3):413-416.
[9]鲍顺淑,闻 婧,杨雅婷,等.LED在设施园艺中的应用系列(四)LED在药用植物栽培上的应用[J].农业工程技术:温室园艺,2009(8):14-15.
[10]Nhut D T,Takamura1T,Watanabe H,et al.Responses of strawberry plantlets cultured in vitro under superbright red and blue light-emitting diodes(LEDs)[J].Plant Cell,Tissue and Organ Culture,2003,73(1):43-52.
[11]Frigaard N U,Larsen K L,Cox R P.Spectrochromatography of photosynthetic pigments as a fingerprinting technique for microbial phototrophs[J].FEMS Microbiology Ecology,1996,20(2):69-77.
[12]崔 勤,李新丽,翟淑芝.小麦叶片叶绿素含量测定的分光光度计法[J].安徽农业科学,2006,34(10):2063.
[13]Marr I L,Suryana N,Lukulay P,et al.Determination of chlorophyll a and b by simultaneous multicomponent spectrophotometry[J].Fresenius'Journal of Analytical Chemistry,1995,352(5):456-460.
[14]马海元,李海云.光对植物根系的影响研究进展[J].陕西农业科学,2009(1):78-80.
