何首乌饮对Leydig细胞衰老模型β-半乳糖苷酶表达的影响*
2013-09-21宋庆亮赵秀军牛嗣云
宋庆亮,郭 银,周 蕾,赵秀军,牛嗣云△
(1.河北大学基础医学院,河北保定 071000;2.河北医科大学)
随着人类预期寿命的延长,迟发性性腺功能减退症(late-onset hypogonadism,LOH)成为人们关注的热点[1]。LOH也称为中老年男性雄激素部分缺乏综合征(partial androgen deficiency of the aging male,PADAM),是一种随老龄化血浆睾酮水平相对下降出现的一组临床综合征,主要表现是性功能障碍、情绪变化、睡眠欠佳、机体肌肉含量下降、疲乏、骨矿物质减少等[1-2]。机体内睾酮90%由睾丸Leydig细胞分泌。本研究采用H2O2和FeSO4损伤原代SD大鼠Leydig细胞建立Leydig细胞衰老模型,探讨何首乌饮对大鼠Leydig细胞衰老模型β-半乳糖苷酶表达的调节作用。
1 材料与方法
1.1 试剂 DMEM/F12(GIBCO)、胎牛血清,北京四季青生物试剂公司;β-半乳糖苷酶试剂盒,北京鼎国生物技术发展中心;胶原酶Ⅰ,美国Sigma公司。
1.2 何首乌饮含药血清的制备 何首乌饮方剂由何首乌、肉苁蓉、怀牛膝、淫羊霍、丹参、茯苓组成,各组分剪碎按质量比3:2:3:2:5:3比例混合,加8倍量蒸馏水浸泡1h,文火水煎2次,每次30min,合并滤液浓缩至每ml含生药4.8g。选用清洁级SD大鼠10只,雌雄不限(购自河北医科大学实验动物中心,许可证号:1112043),体重300±20g。按0.4ml/100g灌胃给予大鼠何首乌饮,1次/d,连续7d,末次给药1h后,乙醚麻醉大鼠,颈动脉插管放血,分离血清。
1.3 细胞分组处理 出生10-20d幼年雄性SD大鼠,无菌取双侧睾丸,用胶原酶Ⅰ消化至生精小管分散,1500r/min离心15min,加等量的PBS清洗3次,4℃离心(1100r/min,7min),弃上清,用含10%胎牛血清的DMEM/F12培养液稀释细胞至1×106/ml,接种于96孔培养板中,37℃、5% CO2培养箱中培养。培养的Leydig细胞采用3β-HSD特异性染色进行鉴定[3]。正常组:Leydig细胞用DMEM/F12培养基培养128h;Leydig细胞衰老损伤组:Leydig细胞用DMEM/F12培养基原代培养48h后,加入50μmol/L的H2O2和100μmol/L的FeSO4培养8h,移去H2O2和FeSO4后,细胞在含10%胎牛血清的DMEM/F12中继续培养72h;何首乌饮预防组:用10%含药血清DMEM/F12培养基中原代培养Leydig细胞48h后,加入50μmol/L的H2O2和100μmol/L的FeSO4培养8h,移去H2O2和FeSO4后,继续在10%含药血清DMEM/F12培养基中培养72h;何首乌饮治疗组:Leydig细胞用DMEM/F12培养基原代培养48h后,加入50μmol/L的H2O2和100μmol/L的FeSO4培养8h,移去H2O2和FeSO4后,在10%含药血清DMEM/F12培养基中继续培养72h。
1.4 Leydig细胞β-半乳糖苷酶表达的检测 各实验组Leydig细胞原代培养并爬片,进行相应的处理后,用PBS漂洗两次,再用含2%多聚甲醛和0.2 %戊二醛的固定液4℃固定15min,用含1mol/L MgCl2的PBS漂洗两次,加入SA-β-gal染色液[1.2mM MgCl2,150mM NaCl,5mM K3Fe(CN)6,5mM K4Fe(CN)6,1mg/ml X-gal,100mM磷酸钠缓冲液,pH6.0],37℃孵育48h。PBS漂洗终止反应,蓝染细胞为阳性细胞。×200倍显微镜随机选取视野,计数每10个细胞中的阳性细胞百分率,每张切片观察5个视野,每组观察3张切片,取平均值。
1.5 统计分析 采用SPSS 16.0统计软件进行统计分析,多组间资料的比较采用方差分析,两两比较采用S-N-K法。
2 结果
β-半乳糖苷酶定位在细胞质,阳性产物呈蓝色Leydig细胞衰老模型组β-半乳糖苷酶阳性细胞率明显高于正常组(P<0.05);何首乌饮预防组、治疗组Leydig细胞β-半乳糖苷酶阳性细胞率明显低于模型组(P<0.05);何首乌饮治疗组、预防组Leydig细胞β-半乳糖苷酶阳性细胞率比较,差异无统计学意义(P>0.05)(见附表,附图)。
附表 各组Leydig细胞β-半乳糖苷酶阳性细胞率(±s)
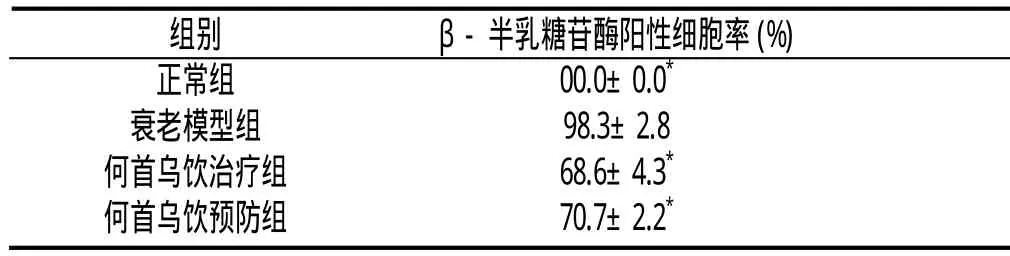
附表 各组Leydig细胞β-半乳糖苷酶阳性细胞率(±s)
与衰老组比较:*P<0.05
组别 β-半乳糖苷酶阳性细胞率(%)正常组 00.0±0.0*衰老模型组 98.3±2.8何首乌饮治疗组 68.6±4.3*何首乌饮预防组 70.7±2.2*
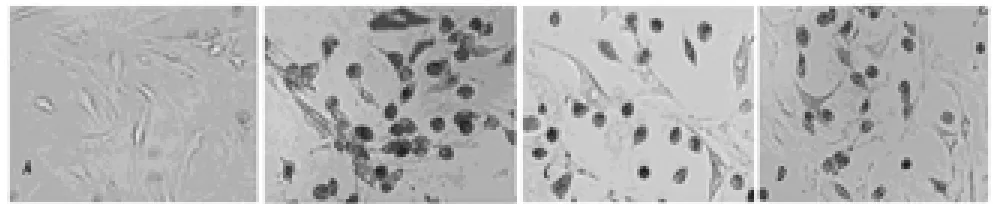
附图 各组Leydig细胞β-半乳糖苷酶的表达(×400)
3 讨论
Dimiri等1995年首次提出一种鉴定细胞衰老的标志酶—衰老相关β-半乳糖苷酶(senescence-associate β-galactosidase,SA-β-Gal),他们的研究发现,衰老成纤维细胞和角质形成细胞均表达此酶,而休眠细胞和终末分化细胞则缺乏。因此,目前将衰老相关β-半乳糖苷酶染色作为细胞衰老的生物学标志[4]。氧化损伤是目前建立细胞衰老模型常用的方法。H2O2属于反应性氧类,是细胞凋亡启动信号转导途径之一,可直接或间接诱导细胞凋亡;FeSO4参与机体氧化应激过程,可增加反应性氧的生成,诱导细胞凋亡。但同时加入H2O2与FeSO4后,细胞凋亡比例不但没有增加,反而明显降低,这是由于铁剂抑制了H2O2诱导细胞凋亡的作用,对细胞有保护作用,因此采用H2O2与FeSO4联合处理细胞,可使细胞处于衰老状态,而减少凋亡的发生[5-6]。
补肾中药何首乌饮由刘河间《宣明论方》何首乌丸加味而成,何首乌丸由何首乌、肉苁蓉、怀牛膝组成,具有补肝肾、益精血、延年益寿之功效,在此基础上加淫羊藿补肾壮阳以强筋骨、丹参活血化淤以通心脉、茯苓健脾利湿以宁心神。前期研究发现,何首乌饮具有抗氧化、调节血脂代谢紊乱和抑制卵巢、睾丸细胞凋亡的作用[7-10]。本研究进一步观察了何首乌饮对原代培养大鼠睾丸Leydig细胞衰老模型的调节作用。本研究发现,50μmol/L的H2O2和100μmol/L的FeSO4联合处理原代培养的Leydig细胞,可使Leydig细胞衰老标志性β-半乳糖苷酶的表达明显升高;何约能源首乌饮用药后可以明显逆转该现象,表明何首乌饮对H2O2和FeSO4引起的大鼠睾丸Leydig细胞衰老有一定的保护作用。
[1]郭凯华,高福禄,牛嗣云,等.何首乌饮对衰老大鼠睾丸生殖功能的影响[J].承德医学院学报,2010,27(2):133-136.
[2]李维仁,韩勃萱,刘涛,等.老年人睾丸间质细胞结构及StAR和P450scc蛋白表达的变化[J].北京大学学报(医学版),2011,43(4):505-508.
[3]应峰,孙佳音,沈洁,等.大鼠睾丸间质细胞原代培养、鉴定与功能监测[J].中国男科学杂志,2008,14(1):7-10.
[4]Dimiri GP, Lee X, Basile G, et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo [J].Proc Natl Acad, 1995, 92(1): 93-106.
[5]顾晓苏,顾永健,姜正林.刺五加皂甙对自由基作用和无血清培养条件下两种神经元衰老模型细胞的保护作用[J].中国临床康复,2005,9(25):123-125.
[6]程志斌,王晓明,唐璐.过氧化氢及硫酸亚铁诱导洋葱表皮细胞凋亡[J].安徽农业科学,2009,37(11):4898-4899.
[7]李亚丽,楚伟,郭文潮,等.何首乌饮对衰老大鼠抗氧化能力及血脂的影响[J].中老年学杂志,2008,28(6):525-526.
[8]王小杰,牛嗣云,张艳青,等.何首乌饮对雄性衰老大鼠生殖功能的保护作用[J].时珍国医国药,2011,22(3):532-535.
[9]郭凯华,高福禄,牛嗣云,等.何首乌饮对衰老大鼠睾丸组织细胞p53/Rb信号转导通路的影响[J].解剖学报,2010,41(3):435-439.
[10]李亚丽,郭文潮,余小平,等.何首乌饮对衰老大鼠卵巢增殖与凋亡的影响[J].中国优生与遗传杂志,2011,19(8):110-112.
