炭疽杆菌双重实时荧光PCR检测方法的建立
2013-09-21谭维国陈文琦陈凤娟王长军张锦海
谭维国,陈文琦,吕 恒,刘 玉,王 平,陈凤娟,王长军,张锦海
(本文编辑:张仲书; 英文编辑:王建东)
炭疽杆菌能引起羊、牛、马等动物及人类的炭疽病,严重威胁公众财产、健康和生命安全,并且可形成气溶胶通过空气飞沫传播,易引发突发公共卫生事件,也常常被视为首选的生物恐怖/生物战病原[1-2]。目前的炭疽杆菌检测方法,主要基于对病原体的培养、染色镜检、血清学(抗原或抗体)检测等,但这些方法均不适合早期快速侦检,难以适应战时疫情控制的需要[3-4]。本研究选择了炭疽杆菌PX01质粒的保护性抗原PA基因、PX02质粒的荚膜合成相关基因capA基因作为检测靶基因,从而建立了一种双重实时荧光定量PCR的方法,能区分强毒株、弱毒株或无毒株,对于应对突发传染病疫情和流行病学调查、突发公共卫生事件应急处置的早期检测、及反生物恐怖袭击预警等具有重要的意义,并已应用在某次重大保障活动中。
1 材料与方法
1.1 材料 ①菌株和质粒:炭疽杆菌强毒株(军事医学科学院五所微检中心);大肠埃希菌XL10-Gold株(美国Stratagene公司);线性化质粒载体pGEM-T easy(美国Promega公司)。②主要试剂:DNA提取液(25 mM NaOH、10 mM Tris-HCl、1%Triton X-100、1%NP-40、0.1mM EDTA、2%Chelex-100)、Pyrobest Taq DNA聚合酶、DNA连接酶、DNAMarker DL2000、DNA纯化及片段回收、抽提质粒试剂盒、RNase H酶TliRNase H II、Taq DNA聚合酶Ex Taq HS等,均为TaKaRa公司(大连)产品;细菌DNA抽提试剂盒(北京天根公司)。③主要设备:ABI 7500 Fast型实时荧光定量 PCR仪(美国 ABI公司,配套软件SDS2.04)。
1.2 方法
1.2.1 引物、探针的设计 通过分别对NCBIGen-Bank中的炭疽杆菌的PA基因和capA基因序列,使用Beacon Designer等多种生物学软件,结合经验判断和人工比对、修正,进行比较分析,选择无二级结构且高度保守的核苷酸区域,各设计一对引物和探针。设计原则为:引物间和引物内无互补序列,而且分别特异性地针对各靶基因,相互间无交叉反应,溶解温度(Tm值)相似,可在同一套反应体系中同时应用于检测和区分炭疽杆菌的PA和capA基因。
1.2.2 引物对及探针序列的合成 委托Takara(大连)公司合成,引物、探针序列和双标记的荧光基团见表1。
1.2.3 目标基因质粒标准品的制备 用细菌DNA抽提试剂盒按照说明书操作,从灭活的炭疽杆菌强毒株中提取基因组DNA。分别按表1的capA引物对序列、PA引物对序列,使用Pyrobest Taq DNA聚合酶对细菌基因组DNA进行PCR扩增,获得对应的capA基因片段、PA基因片段目标基因扩增产物,送交南京金斯瑞生物公司,拼接克隆至PGEM-T easy载体,经测序验证无误,称为 CapA-PA-PGEM质粒。将含CapA-PA-PGEM质粒的XL10-Gold细菌进行增菌,提取质粒DNA,用紫外分光光度计定量,利用阿伏加德罗常数公式(6.02×1023)×(ng/μl×10-9)/(DNA 长度 ×660)= 拷贝/μl计算拷贝数[5],根据需要稀释分装,从而获得同时含有capA基因序列和PA基因序列的质粒标准品,置-20℃备用。
1.2.4 反应体系 反应总体积25μl,采用正交设计L16(45)考察 Mg2+、dNTPs、引物浓度、探针浓度、Ex Taq HS酶五因素,在四个水平上进行优化试验,最终确定的体系由以下组分构成:dNTP混合溶液(各2.5 mM)3 μl,MgCl2溶液(25 mM)5 μl,Tli RNase HⅡ(200 U/μl)0.5 μl,Ex Taq HS(5 U/μl)0.25 μl,10 ×Cycleave PCR Buffer 2.5 μl,PA、capA 引物对工作液(10μM)各1μl,PA探针工作液、capA探针工作液(均为5μM)各1μl,质粒标准品稀释液1μl或样本待测液4μl,最后以双蒸水补足至25μl。
1.2.5 反应参数 第一阶段:初期变性,95℃10 s;第二阶段:PCR反应,为95℃变性5 s,55℃退火10 s,然后72℃ 25 s延伸,并在此步骤监测荧光曲线;重复50个循环以更好地观察双重实时荧光扩增曲线的形状。判断阳性的标准是:循环阈值(Ct值)在38以内且扩增曲线呈S型。
1.2.6 灵敏度实验 将CapA-PA-PGEM质粒标准品作倍比连续稀释,使其拷贝数浓度从5×106拷贝/μl至 5 ×10-1拷贝/μl,然后加入反应体系内进行双重荧光PCR扩增,测定双重实时荧光PCR的灵敏度。
1.2.7 特异性实验 用建立的双重实时荧光PCR检测方法对课题组保存的炭疽杆菌强毒株核酸、鼠疫杆菌核酸、嗜肺军团菌1型、鼠伤寒沙门菌、山夫登堡沙门菌、福氏志贺菌、宋内志贺菌、枯草芽孢杆菌、大肠埃希菌标准株(ATCC 25922)、弗劳地枸橼酸杆菌、铜绿假单胞菌进行检测比较。
1.2.8 实战应用 在某次重大保障任务中,对解放军总后勤部卫生部提供的一次实毒实样(白色粉末)进行涂片革兰染色后发现背景杂乱,并见少许革兰阳性杆菌,随即对粉末样品用DNA抽提液按常规方法提取核酸,以本研究建立的双重实时荧光PCR方法进行检测分析。

表1 引物对及探针序列
2 结果
2.1 炭疽杆菌双重实时荧光定量PCR反应荧光曲线图 用本研究建立的方法,对炭疽杆菌强毒株核酸检测的荧光曲线见图1。
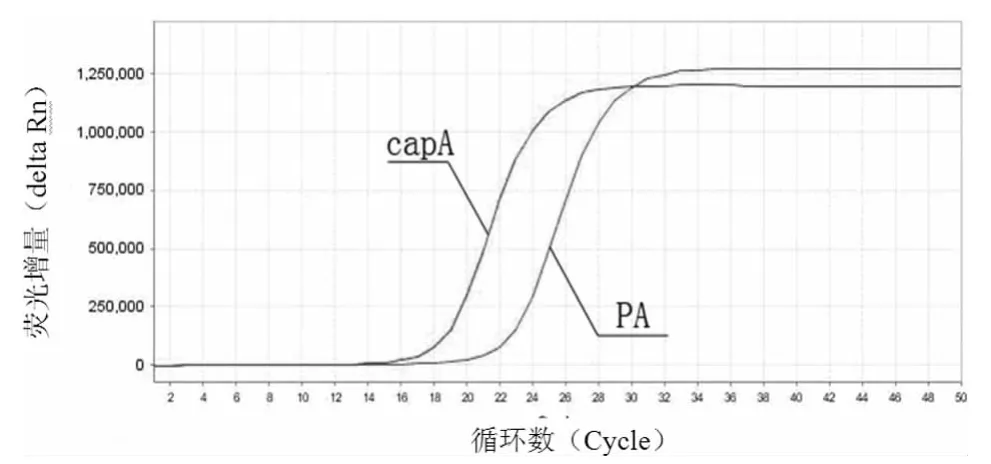
图1 炭疽的CapA基因、PA基因的双重实时荧光定量PCR扩增曲线
可见在单一反应孔中,同时成功检测出capA基因、PA基因,扩增曲线良好,呈典型的S型
2.2 灵敏度 经梯度稀释的CapA-PA-PGEM质粒标准品测试,本方法对capA基因、PA基因单检的灵敏度分别为每反应5和50拷贝,见表2。

表2 炭疽杆菌双重实时荧光定量PCR的检测灵敏度
2.3 特异性 应用本研究的双重实时荧光PCR方法,对保存的炭疽杆菌强毒株或核酸样品的检测结果均为阳性,而鼠疫杆菌、嗜肺军团菌1型、枯草芽孢杆菌、弗劳地枸橼酸杆菌、大肠埃希菌标准株等形态相似杆菌、常见致病菌或条件致病菌的检测结果均为阴性。
2.4 实战应用 对解放军总后勤部卫生部提供的实毒实样,在严格生物安全防护条件下提取核酸后,应用本方法进行实战应用检测,结果阳性对照(质粒标准品)、阴性对照均确立,待测样品孔的荧光曲线图见图2。由图2可见待测样品所含的细菌capA基因检测阴性,PA基因检测阳性。考虑为capA基因缺失或已敲除的炭疽杆菌弱毒株(疫苗株)。经测序及上报检测结果后的反馈信息证实,检测结果完全正确。
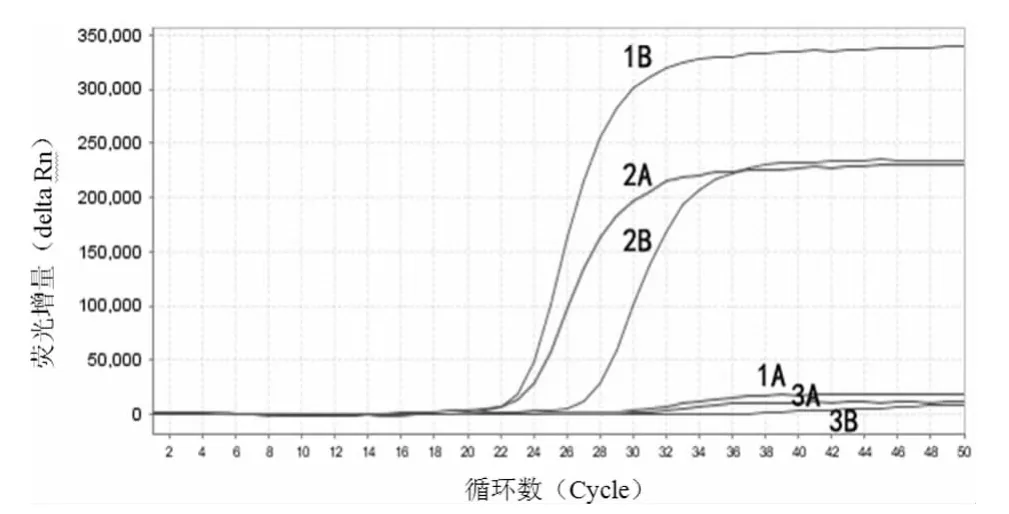
图2 实毒样品的双重实时荧光定量PCR检测曲线
3 讨论
炭疽杆菌致病性与其PX01质粒上的保护性抗原基因(PA)和PX02质粒上的荚膜合成相关基因(capA)相关,如果只有其中一种质粒,即为弱毒株或无毒株[6-7]。在发生疫情和突发公共卫生事件中,因预警、控制及应急反应决策的需要,对于炭疽杆菌更需同时检测PA和capA,以区分是否存在炭疽杆菌并鉴定区分强毒株或弱毒、无毒株[8-9]。因此,建立一种炭疽杆菌的双重检测方法具有显著的针对性和实用性[10-11]。
本研究成功构建了同时含有炭疽杆菌capA基因片段、PA基因片段的重组质粒CapA-PA-PGEM,经测序正确,准确定量后,以此为标准品,建立了双重实时荧光定量PCR方法。由图1的荧光曲线可见,两个体系各自的特异性和工作性能良好,互相间无干扰;当capA基因为每反应5拷贝数、PA基因为每反应50拷贝数时,用本方法仍然能够检出。同时检测时FAM通道(capA)信号明显比JOE通道(PA)信号强,除引物探针性能外,也有可能是报告荧光的差异(目前FAM是使用最广泛和稳定的荧光基团)或基因表达丰度的问题,但并不影响实际应用[12]。对枯草芽孢杆菌、枸橼酸杆菌、鼠疫杆菌核酸、嗜肺军团菌、各型沙门菌、志贺菌、大肠埃希菌、铜绿假单胞菌等进行检测,均为阴性,本法特异性较好。除上述实验室考验外,本研究建立的方法还在实战中得到检验,在某重大保障活动中,对实毒实样(白色粉末)进行检测时准确鉴定出混入的少量炭疽杆菌弱毒株[13]。
本研究建立了能同时检测炭疽杆菌PA基因、capA基因的双重实时荧光 PCR的技术,在具有快速准确、高灵敏度的特点同时,可以实现一管多检,省时省力,极大地提高了检测速度和效率,对于应对突发传染病疫情及突发公共卫生事件应急处置的早期检测,反生物恐怖袭击预警等都具有重要的意义。
[1]吕 恒,张锦海,王长军.上海世博会反生物恐怖袭击医学救援的做法与启示[J].解放军预防医学杂志,2012,30(1):66-67.
[2]王长军,张锦海,顾海涛,等.反生物恐怖医学救援现场处置要点初析[J].西南国防医药,2010,20(4):442-443.
[3]马韶辉,汪春翔,葛 华.两起炭疽突发疫情中炭疽芽孢杆菌的分离鉴定[J].中国人兽共患病学报,2010,26(7):703-706.
[4]王忠灿,王长军,郁兴明.生物恐怖威胁及应急医学救援的思考[J].东南国防医药,2009,11(2):184-186.
[5]林秀蓉,陈巧绘,林 海.TaqMan-MGB探针对 HCV基因的检测及分型研究[J].东南国防医药,2012,14(1):20-22.
[6]Mohamadzadeh M,Durmaz E,Zadeh M,etal.Targeted expression of anthrax protective antigen by lactobacillus gasseri as an anthrax vaccine[J].Future Microbiol,2010,5(8):1289-1296.
[7]Zakowska D,Bartoszcze M,Niemcewicz M,etal.New aspects of the infection mechanisms of Bacillus anthracis[J].Ann Agric Environ Med,2012,19(4):613-618.
[8]Wagar EA,Mitchell MJ,Carroll KC,etal.A review of sentinel laboratory performance:identification and notification of bioterrorism agents[J].Arch PAthol Lab Med,2010,134(10):1490-1503.
[9]张文斗,祖正虎,徐致靖,等.炭疽恐怖袭击直接经济损失评估方法[J].军事医学,2012,36(10):745-748.
[10]Steelfisher GK,Blendon RJ,BruléAS,etal.Public response to an anthrax attack:a multiethnic perspective[J].Biosecur Bioterror,2012,10(4):401-411.
[11]Lee I,Oh WK,Jang J.Screen-printed fluorescent sensors for rapid and sensitive anthrax biomarker detection[J].J Hazard Mater,2013,25(3):186-191.
[12]Singh J,Batish VK,Grover S.Simultaneous detection of Listeria monocytogenes and salmonella spp.in dairy products using real time PCR-melt curve analysis[J].J Food Sci Technol,2012,49(2):234-239.
[13]吴志成.上海世博会安保三防医学救援经验做法[J].东南国防医药,2010,12(6):3-6.
