人羊膜间充质干细胞静脉移植后在心肌梗死大鼠体内的定植及分化
2013-09-21王钰莹陈代雄余丽梅刘祖林
王钰莹 方 宁 陈代雄 余丽梅 刘祖林 万 雪
(遵义医学院附属医院贵州省细胞工程重点实验室,贵州 遵义 563003)
成体干细胞(SSC)具有一定的发育潜能,在适当的条件下可分化成特化的组织细胞,而且来源较广,可体外扩增,不牵涉伦理学问题,因而在再生医学领域具有广阔的应用前景。人羊膜间充质干细胞(hAD-MSCs)也是一类典型的SSC,它具有易于体外扩增,无免疫原性、多分化潜能等优点,可以成为细胞移植治疗缺血性心肌病的一种有前途的新细胞来源〔1~4〕。移植途径是影响细胞移植治疗效果和安全性的重要因素,在动物实验和临床试验中采用的细胞移植途径包括心肌内注射、冠状动脉内注射、冠状静脉窦移植等。而经静脉内移植,由于可以反复、多次、大量进行无创的治疗,是最具有应用前景的治疗方法。本实验旨在观察静脉移植hAD-MSCs到心肌梗死 (MI)大鼠体内后在重要脏器的分布以及对心功能的影响,探讨静脉移植hAD-MSCs治疗MI的可行性和安全性。
1 材料与方法
1.1 材料 雄性SD大鼠,体重(200±20)g,购自第三军医大学大坪医院动物实验中心〔许可证号:SCXK(渝)2007-0005〕。LG-DMEM培养基、胎牛血清(FBS)购自Gibco公司,5-溴脱氧尿嘧啶核苷(Brdu)、鼠抗人Brdu抗体、α-辅肌动蛋白抗体购自Sigma公司,连接蛋白-43(CX-43)抗体、羊抗鼠IgG-FITC、羊抗兔Ig-Texas Red购自Santa Cruz公司,鼠抗人细胞核特异性抗体MAB1281、结蛋白抗体购自Chemcion公司,免疫组化单染试剂盒(EnVisionTMDetection Systems Peroxidase/DAB,兔/鼠)购自Gene Tech公司,用于流式细胞仪检测的全部荧光标记抗体均购自BD公司,彩色多普勒超声心动图仪为德国ACUSON公司产品(型号Sequoia512)。
1.2 hAD-MSCs分离、培养、鉴定及标记 经知情同意后,采自足月剖宫产分娩胎盘,剥离羊膜,D-Hank液反复冲洗,剪碎羊膜,0.02%EDTA-0.05%胰蛋白酶37℃消化20 min,反复3次,弃上清液,去除羊膜上皮细胞。0.75 mg/mlⅡ型胶原酶,0.075 mg/ml DNaseⅠ,37℃,200 r/min 旋转消化 2 h,300 目不锈钢网过滤,收集细胞滤液,1 500 r/min离心10 min,弃上清液,细胞重新悬浮于含10%FBS的 L-DMEM培养基中,于37℃、5%CO2培养箱中孵育。细胞增殖达80%融合时细胞传代,取第3代细胞用流式细胞仪检测细胞表面抗原 CD44、CD73、CD90、CD 105、CD45、CD34、CD11b、CD19 及 HLA-DR 的表达,免疫细胞化学染色检测波形蛋白。取第3代细胞以5×105/cm2细胞密度分别接种,接近50%融合时,加入Brdu(终浓度为10 μg/ml),孵育48 h,收集Brdu标记的细胞供移植时使用。
1.3 大鼠MI模型的建立及hAD-MSCs移植〔5〕10%水合氯醛(0.35 ml/100 g)腹腔麻醉,气管插管,在心电监护下,左胸第2~3肋间隙开胸,于左心耳下方1~2 mm处用6/0号丝线结扎左冠状动脉前降支,心电图示R波振幅升高,ST段(J点)抬高可确定建模成功。术后腹腔注射青霉素20 IU/kg连续7 d。实验设模型组、hAD-MSCs移植组和假手术组各12只。移植组经舌下静脉注入 Brdu标记的 hAD-MSCs悬液0.4 ml(2×106个细胞/只),模型组和假手术组分别经相同途径注射等体积无血清培养基。
1.4 心脏功能检测 分别于制模前,制模后1 w及移植后6 w采用彩色多普勒超声心动图仪(15 MHz探头)检测左室心功能,检测时探头置于大鼠胸前,调整角度取胸骨旁左室长轴和乳头肌水平短轴切面。检测指标包括射血分数(EF)、左室短轴缩短率(FS)、舒张期左室前壁厚度(LVAWd)、收缩期期左室前壁厚度(LVAWs)、左室舒张末期内径(LVDd)、左室收缩末期内径(LVDs)、左室舒张末期容积(EDV)和左室收缩末期容积(ESV)。每项指标连续测定3次,取平均值。
1.5 组织学、免疫组化和免疫荧光检测 心功能测定结束后处死动物,取心、肝、肺和脾脏组织置于4%多聚甲醛中固定,20%蔗糖溶液脱水,石蜡包埋,按5μm厚度连续切片,脱蜡水化,心肌组织行HE染色。免疫组化染色:组织切片经脱蜡至水,阻断内源性过氧化物酶,DNA变性,山羊血清封闭后,加鼠抗人Brdu单抗,4℃孵育过夜,加兔鼠通用二抗。DAB显色,显微镜下观察,细胞核呈棕褐色者为Brdu标记阳性细胞。免疫荧光染色:取心脏剥离左心室,经OCT包埋后连续切成5 μm超薄切片,室温晾干,Triton X-100作用,山羊血清封闭后,加入小鼠抗人细胞核特异性抗体MAB1281与CX-43抗体或α-actinin抗体的混合抗体,4℃孵育过夜,加入FITC标记的羊抗鼠IgG与德克萨斯红(TR)标记的羊抗兔IgG混合的二抗,37℃避光孵育2 h。甘油封片,荧光显微镜观察。
2 结果
2.1 hAD-MSCs形态、表型特征及Brdu标记效果 hAD-MSCs形态为梭形或多角形,细胞排列紧密,胞体拉伸,呈单层放射状或漩涡状生长,增殖迅速。免疫组化染色显示hAD-MSCs表达波形蛋白,增殖期hAD-MSCs的Brdu标记阳性率达90%以上(图1)。FCM分析结果显示,分离的hAD-MSCs高表达CD44、CD90、CD73 和 CD105,几乎不表达 CD45、CD34、CD11b、CD19及 HLA-DR(图2)。

图1 hAD-MSCs生长形态及波形蛋白和Brdu标记细胞的免疫组化染色

图2 hAD-MSCs流式细胞术表型分析结果
2.2 心肌组织病理变化 HE染色结果显示,模型组MI区,可见心肌纤维肿胀,心肌细胞核消失,间质出血,心肌细胞坏死,伴大量急性炎症细胞浸润;hAD-MSCs移植组移植后6 w炎性细胞浸润明显减轻,新生毛细血管增多,形成瘢痕组织(图3)。
2.3 hAD-MSCs经静脉移植后在心、肝、肺和脾脏中的分布细胞移植后6 w的组织切片中可见Brdu标记的阳性细胞,主要分布于MI组织与正常组织的交界区域,细胞形态完整,细胞核呈棕褐色,而正常心肌组织未见阳性细胞。hAD-MSCs除可以分布在梗死心肌组织外,肺和脾脏组织中亦可见部分hADMSCs存活,但肝脏中未见hAD-MSCs。见图4。
2.4 hAD-MSCs在MI大鼠心脏中的定植及分化 移植的hAD-MSCs主要定位于梗死区及边缘区,免疫荧光双染色结果发现人细胞核抗原与CX-43、α-辅肌动蛋白阳性细胞同时表达,提示移植的hAD-MSCs在MI向心肌细胞分化(图5)。
2.5 hAD-MSCs经静脉移植后对心功能的影响 与假手术组比较,模型组大鼠心功能各项指标均发生异常(均P<0.05),表现为明显的收缩和舒张功能障碍。与模型组比较,移植组心功能各项指标明显改善,尤其是反映左心室收缩功能的EF、FS和反映左心室前壁厚度的LVAWd和LVAWs,明显高于模型组(P<0.01)(图6)。

图3 hAD-MSCs移植后MI区病理变化(×200)
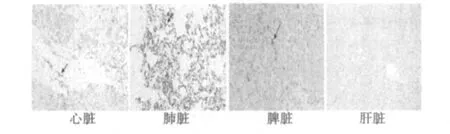
图4 hAD-MSCs静脉移植后6 w在MI区和主要器官中的分布(×200)
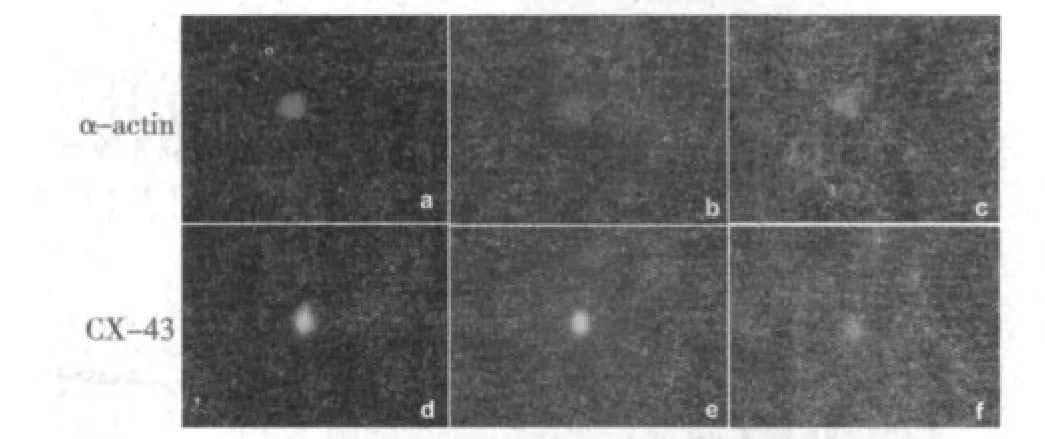
图5 hAD-MSCs移植后6 w在心肌原位表达心肌细胞特异性蛋白
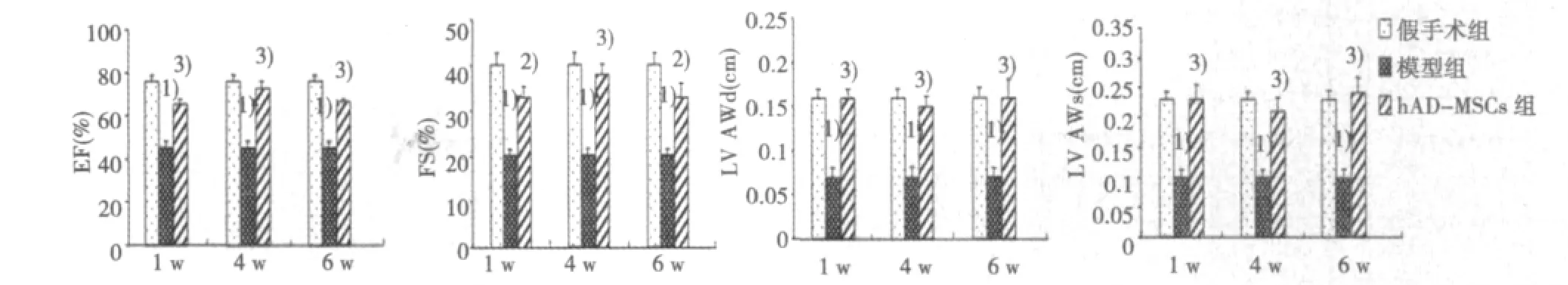
图6 hAD-MSCs移植后对MI大鼠心功能的影响
3 讨论
干细胞移植是近年来心肌损伤修复研究的一个热点问题,很多动物实验和临床研究均证实,干细胞移植对受损心肌组织的修复以及心功能改善有积极的作用。通过何种途径将移植细胞输送到受损心肌组织内也成为众多学者的研究方向。经冠脉内、心内膜和心外膜直视注射移植细胞虽然移植成功率较高,但都因技术要求高及具有创伤性,增加了患者的痛苦,临床应用受到限制。Orlic等〔6〕尝试了经静脉途径移植干细胞保护梗死心脏,结果表明静脉移植方式能有效地改善左心室功能,缩小梗死面积。Nagaya等〔7〕从同源大鼠分离出MSCs,通过静脉注入移植后,发现细胞先到达梗死心肌,且表达心肌特异性标记结蛋白、肌钙蛋白T、连接蛋白43。本实验选择在MI后1 w移植细胞,考虑到MI早期的炎症性反应不利于细胞的存活,而梗死后1 w炎症反应渐于消退,很多细胞因子表达处于高峰期,有利于移植细胞向受损区域迁移〔8〕。
肺脏是移植细胞最先移行的脏器,Gao等〔9〕静脉注射MSCs进行骨组织修复和Fischer等〔10〕静脉注射MSCs修复猪MI的研究显示,由于肺的“首关效应”,移植后大部分细胞被肺血管所“俘获”,使细胞无法通过而导致大量细胞滞留于肺组织中。本研究表明静脉移植的hAD-MSCs可以通过血液循环迁移到MI区的心肌组织内。此外,在脾脏中也可见少量滞留的细胞,这可能是由于移植细胞受到肺循环中丰富血流不断冲刷,细胞得以逃逸到其他组织器官中,这些与其他研究结果一致〔11〕。本研究中肝脏组织未见有细胞存留,这可能与细胞遭受炎症、免疫等因素影响后出现凋亡或死亡,导致细胞数量减少而未检测到。这些结果表明移植细胞能够定植于MI区域及周边区域,并分布在重要器官中,说明供体细胞具有向受损心肌组织迁徙特性,且提示细胞通过简便的静脉移植途径治疗MI是可行的。
hAD-MSCs经静脉注射后不仅有细胞分布到MI区域,而且还能够保护心脏功能,延缓梗死后左心室的重构。本实验研究表明移植hAD-MSCs可在一定程度上抑制MI后心室重构,对防止因心室重构而导致的心力衰竭具有积极意义。本实验说明hAD-MSCs移植后可在大鼠MI区向心肌细胞分化。hAD-MSCs移植可改善MI后心脏功能。即便还没有证据证明hAD-MSCs分化成的心肌样细胞直接参与了心脏的收缩功能,但有一点是可以肯定,即hAD-MSCs抑制MI后心室重构是其提高心功能的重要的病理生理学机制。
关于移植细胞对MI后的心肌修复的作用机制尚不十分清楚,可能与供体细胞分化成心肌细胞,促进新生血管形成,通过旁分泌作用抑制心肌细胞凋亡或促进残留心肌细胞再生等因素有关 。本实验结果所显示的hAD-MSCs对MI的修复作用是否与其分化成心肌细胞有关,分化的心肌细胞是否参与了心脏的收缩功能,抑或通过旁分泌作用介导抑制心肌细胞凋亡或促进心肌细胞增生和血管形成,均有待深入研究。
1 Zhao P,Ise H,Hong M,et al.Human amniotic mesenchymal cells have some characteristics of cardiomyocytes〔J〕.Transplantation,2005;79(5):528-35.
2 In't Anker PS,Schergon SA,Kleijburg-vander keur C,et al.Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta〔J〕.Stem Cells,2004;22(7):1338-45.
3 张 路,方 宁,陈代雄,等.人羊膜间充质细胞有向心肌样细胞分化的特性〔J〕.中国生物工程杂志,2007;27(12):84-9.
4 张 路,方 宁,陈代雄,等.人羊膜上皮细胞有向心肌样细胞分化的特性〔J〕.中国组织工程研究与临床康复,2008;12(3):401-5.
5 Mu Y,Cao G,Zeng Q,et al.Transplantation of induced bone marrow mesenchymal stem cells improves the cardiac function of rabbits with dilated cardiomyopathy via upregulation of vascular endothelial growth factor and its receptors〔J〕.Exp Biol Med(Maywood),2011;236(9):1100-7.
6 Orlic D,Kajstura J,Chimenti S,et al.Mobilized bone marrow cells repair the infarcted heart,improving function and survival〔J〕.Proc Natl Acad Sci U S A,2001;98(18):10344-9.
7 Nagaya N,Fujii T,Iwase T,et al.Intravenous administration of mesenchymal stem cells improves cardiac function in rats with acute myocardial infarction through angiogenesis and myogenesis〔J〕.Am J Physiol Heart Circ Physiol,2004;287(6):2670-6.
8 Lange C,Togel F,Ittrich H,et al.Administered mesenchymal stem cells enhance recovery from ischemia/reperfusion induced acute renal failure in rats〔J〕.Kidney Int,2005;68(4):1613-7.
9 Gao J,Dennis JE,Muzic RF,et al.The dynamic in vivo distribution of bone marrow-derived mesenchymal stem cells after infusion〔J〕.Cells Tissues Organs,2001;169(1):12-20.
10 Fischer UM,Harting MT,Jimenez F,et al.Pulmonary passage is a major obstacle for intravenous stem cell delivery:the pulmonary first-pass effect〔J〕.Stem Cells Dev,2009;18(5):683-92.
11 Freyman T,Polin G,Osman H,et al.A quantitative,randomized study evaluating three methods of mesenchymal stem cell delivery following myocardial infarction〔J〕.Eur Heart J,2006;27(9):1114-22.
12 Moon JH,Lee JR,Jee BC,et al.Successful vitrification of human amnion-derived mesenchymal stem cells〔J〕.Hum Reprod,2008;23(8):1760-70.
13 Kim DH,Kshiti Z,Smith RR,et al.Nanopatterned cardiac cell patches promote stem cell niche formation and myocardial regeneration〔J〕.Integr Biol(Camb),2012;4(9):1019-33.
14 Tang YL,Zhao Q,Qin X,et al.Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction〔J〕.Ann Thorac Surg,2005;80(1):229-36.
