甘油醛-3-磷酸脱氢酶功能的研究进展
2013-09-20付国良黄晓红
付国良, 黄晓红
福建师范大学生命科学学院,福建省发育与神经生物学重点实验室,福州350108
引 言
甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)是糖酵解途径中的一个关键酶,与ATP的合成密切相关。它广泛存在于众多生物体中,并且具有高度种属保守序列[1,2]。GAPDH几乎在所有组织中都高水平表达,且通常在同种组织或细胞中的表达量相对恒定,因此,常被用作研究其他基因和蛋白表达的内参照[3]。但近年来,越来越多的研究发现,在某些作用因素下,尤其是在某些肿瘤及特定因素引发的细胞凋亡过程中,GAPDH的表达量并不恒定,其mRNA水平和蛋白质水平会随着各种刺激而变化[4,5]。此外,最近的研究还表明,GAPDH不是一个纯粹简单的糖酵解酶,它不仅参与能量代谢,还具有许多其他生理功能,是一种参与许多亚细胞水平活动的多功能蛋白质。
GAPDH的结构特点
GAPDH分子一般是由4个相同亚基组成的四聚体,但不同种属的GAPDH亚基所含氨基酸残基数略有差异,从330到350个不等。每个亚基可以分为两个结构域:催化结构域和辅酶结合结构域。两个结构域在结构上有一些共同特点,它们中间都为β折叠层,两侧分布着一些α螺旋。但两者也存在一定的差异,如催化结构域的β折叠为反平行式,而辅酶结合结构域的β折叠主要为平行式,且催化结构域的α螺旋主要分布在β折叠层的一侧,而辅酶结合结构域两侧都有大量的α螺旋分布。在糖酵解过程中,这两个结构域分别对应结合3-磷酸甘油醛和NAD+,从而催化3-磷酸甘油醛转变为1,3-二磷酸甘油酸,同时以NAD+为受氢体生成NADH。
GAPDH活性中心的Cys149处于β折叠与α螺旋的连结区,在已知三维结构的几个种属的GAPDH中,活性中心附近部位的氨基酸序列完全相同,该区域结构稳定,说明不同种属的GAPDH中具有高度保守序列。在GAPDH分子中心与两个亚基的接触面存在S-loop区,该区域是一段二级结构含量较低的自由卷曲,它对整个分子结构的稳定性至关重要[6~9]。
GAPDH的功能
糖酵解酶活性
催化的反应
在糖酵解过程中,GAPDH主要催化3-磷酸甘油醛转变为1,3-二磷酸甘油酸,此过程需要NAD+和无机磷酸 (Pi)的参与。在GAPDH的催化下,3-磷酸甘油醛脱氢氧化,同时磷酸化,产生含1个高能磷酸键的1,3-二磷酸甘油酸,反应中脱下的2个H离子由GAPDH的辅酶NAD+接受,生成NADH+H+。这是一个非常重要的反应,因为在3-磷酸甘油醛的醛基氧化为羧基时,会将氧化过程产生的能量贮存到ATP分子中[10]。
催化机制
GAPDH酶活性中心部位的半胱氨酸含有游离巯基。巯基是一个亲核体,它会向带电正性的原子进攻,而底物3-磷酸甘油醛分子中的羰基碳原子带电正性,因此,巯基会以解离的形式进攻该羰基碳原子。在此过程中,酶分子上与该半胱氨酸邻近的带有孤电子对的组氨酸咪唑环上的N原子先向巯基上的H亲核进攻,使巯基形成-S:形式;然后,-S:向羰基碳原子进攻,从而形成一个与酶相连的半缩硫醛,这时,与原来羰基碳相连的氢原子会以氢负离子 (:H-)的形式离开,并与辅酶NAD+结合,于是形成了还原型的NADH和硫酯,同时有一个H+被释放出来。NADH一旦形成就立即脱离酶分子,同时,酶又结合上另一氧化型的NAD+。随后,无机磷酸分子 (Pi)亲核攻击硫酯,使硫酯键断裂,形成游离的1,3-二磷酸甘油酸,同时,GAPDH恢复原状形成游离的酶 (图1)[10]。
催化微管聚合
微管是一种具有极性的细胞骨架,由微管蛋白聚合而成,它对于维持细胞形态、辅助细胞内运输及细胞运动都至关重要。研究表明,GAPDH能够促进微管蛋白聚合成微管。Launay等[11]从人类结肠癌细胞系中分离出一种结合微管蛋白聚合物的蛋白质,通过聚丙烯酰胺凝胶电泳鉴定它的分子量为35 kDa,再通过微管蛋白制备的亲和柱纯化该蛋白,并通过酶活性和免疫印迹实验,确定该蛋白为GAPDH。在体外微管蛋白聚合实验中,发现纯化的该蛋白能引起明显的浊度增加,电子显微镜观察显示它可加速微管蛋白成束。Kumagai等[12]的研究也有相同的发现,他们从猪脑中分离出一个与微管蛋白结合的35 kDa蛋白,发现它能够催化微管聚合,而Ca2+和秋水仙素能够抑制该蛋白对微管的聚合作用,最终鉴定该蛋白为GAPDH。他们还研究发现,2 mmol/L的ATP能够将GAPDH从微管蛋白制备的层析柱上洗脱下来,表明ATP能够抑制GAPDH与微管蛋白的结合,并抑制GAPDH对微管的聚合,提示不与微管蛋白结合的GAPDH不具有促进微管聚合的作用。
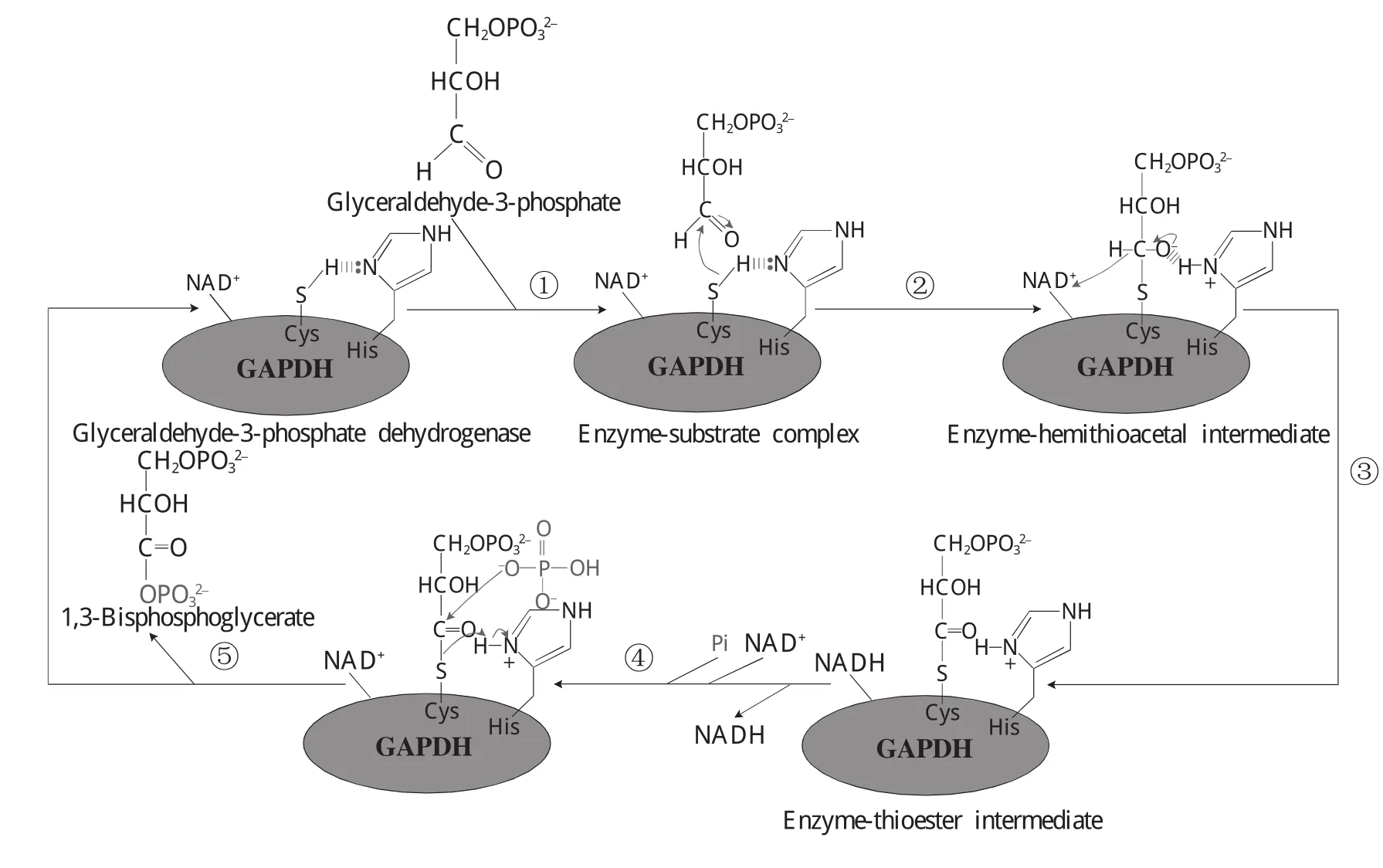
图1 甘油醛-3-磷酸脱氢酶在糖酵解途径中的反应机制 ①酶与底物3-磷酸甘油醛结合形成酶-底物复合物,同时,酶活性部位带有孤电子对的组氨酸咪唑环上的N原子向酶活性中心部位的半胱氨酸游离巯基上的H亲核进攻;②巯基形成-S:形式,然后,-S:向底物羰基碳原子进攻,从而形成一个与酶相连的半缩硫醛;③与原来羰基碳相连的氢原子以氢负离子 (:H-)的形式离开,并与辅酶NAD+结合,于是形成了还原型的NADH和硫酯;④NADH一旦形成就立即脱离酶分子,同时,酶又结合另一氧化型的NAD+;⑤无机磷酸分子 (Pi)亲核攻击硫酯,使硫酯键断裂形成游离的1,3-二磷酸甘油酸,而GAPDH恢复原状形成游离的酶Fig.1 The reaction mechanism of GAPDH in glycolytic pathway ①GAPDH combines with the substrate,glyceraldehyde-3-phosphate,to form enzyme-substrate complex.Meanwhile,equipped with unpaired electron on enzymatic active site,the nitrogen atom on the imidazole ring of histidine residue launches nucleophilic attack to the hydrogen atom of free sulfhydryl on the cysteine residue of enzyme activity center part;②Sulfhydryl sets up the-S:form,which then attacks the substrate,carbonyl carbon atom,to form enzyme-hemithioacetal intermediate;③The hydrogen atom leaves the carbonyl carbon atoms,which it previously connects with,in hydrogen anion(:H-)form,and then combines with the coenzymes NAD+to form the reduced NADH and thioester;④Once NADH forms,it immediately leaves the enzyme molecule.At the meantime,the enzyme combines with another oxidation type of NAD+;⑤Inorganic phosphate molecule(Pi)makes nucleophilic attack to thioester.As a consequence,the thioester bond is fractured to rebuild free 1,3-bisphosphoglycerate,and GAPDH retrieve to its initial form without substrates
Somers等[13]通过测定游离酶在结合物平衡体系中的浓度来分析GAPDH与微管的结合,发现在低离子强度 (0.03 mol/L)时,结合率非常高;而增加离子强度至0.1 mol/L时,结合常数会明显降低。进一步的研究发现,GAPDH主要是通过与微管蛋白C端的结合来加速微管聚合的。此外,研究还发现,小GTP酶Rab2能够刺激蛋白激酶Cι/λ(protein kinase Cι/λ,PKCι/λ) 和 GAPDH募集到膜上,随后,PKCι/λ 磷酸化 GAPDH,磷酸化的 GAPDH高度亲和微管蛋白,能够促进微管蛋白聚合到膜上,进而催化微管聚合[14]。
参与蛋白磷酸化修饰
磷酸化是指在蛋白质或其他类型分子上加入一个磷酸基团的过程,磷酸化作用在生物学上具有非常重要的意义,许多蛋白质需要经过磷酸化修饰后才能发挥其作用。研究表明,GAPDH既能够被其他蛋白激酶磷酸化,又可以磷酸化其他蛋白质。在由Rab2所介导的来自管状小泡丛 (vesicular tubular clusters,VTCs)的逆向运输中,GAPDH是必要的,此过程中,GAPDH的第41位酪氨酸会被Src激酶磷酸化。研究者用苯丙氨酸取代GAPDH的第41位酪氨酸 (GAPDH Y41F),而Src激酶没有能力去磷酸化纯化了的GAPDH Y41F,结果发现,GAPDH Y41F阻碍了从内质网至高尔基体的物质运输,从而表明第41位酪氨酸的磷酸化对于GAPDH在早期分泌途径中的活性是必要的,而这种对于运输的阻碍是因为减少了非典型蛋白激酶Cι/λ结合到GAPDH Y41F上,从而减少了β-外壳蛋白与VTC的结合,以及随后Rab2介导的逆向囊泡的形成。通过此实验可以说明,GAPDH的磷酸化对于其行使生物功能具有非常重要的意义[15]。而在研究GAPDH催化微管聚合的实验中也有相同的发现,即在Rab2促进VTCs形成囊泡的过程中,GAPDH必须被磷酸化后才能促进微管结合到囊泡的膜上,在此过程中,Rab2先刺激PKCι/λ和GAPDH募集到VTCs,随后,PKCι/λ磷酸化GAPDH,最终在早期分泌途径中影响微管蛋白的聚合[14]。同样,Akt2激酶磷酸化GAPDH的Thr237,并且减少它的核转运,这对于GAPDH介导的细胞凋亡也是一个必要的步骤[16]。许多研究表明,GAPDH可以被多种磷酸激酶磷酸化修饰,而这些磷酸化修饰对于GAPDH行使其特定的生物功能都是必要的。
GAPDH还能磷酸化其他蛋白质,从而表现出磷酸激酶活性。研究发现,当用ATP和GAPDH预处理培养的小脑神经细胞黏着分子L1时,L1会被磷酸化,随后导致轴突生长的加强;而当碱性磷酸酶存在时,依赖L1的轴突生长会减弱。再者,在ATP存在时,添加GAPDH抗体到培养的小脑神经细胞中,会抑制依赖L1的轴突生长。从而表明GAPDH磷酸化L1在调节L1介导的轴突生长方面非常重要[17]。研究还发现,GAPDH能够磷酸化p53的第46位丝氨酸,从而激活GAPDH介导的细胞凋亡途径[18]。此外,研究还发现,许多磷酸激酶需要与GAPDH结合才能表现出其激酶活性,如Nm23蛋白本身并没有激酶活性,只有与GAPDH结合成二聚体,才能够转移磷酸基团[19]。另有报道称GAPDH还能被自身磷酸化,但是磷酸化的具体意义尚未明确[20]。
参与膜融合和膜转运
膜融合是细胞执行功能的首要条件,而膜转运对于细胞的存活也至关重要,细胞内的许多物质运输过程都是通过膜转运来进行的,如内质网和高尔基体间的囊泡运输过程等。研究表明GAPDH能够促进膜融合,并参与膜转运过程。Morero等[21]运用5种不同的方法研究了蛋白在膜融合中的作用,结果发现溶菌酶、L-乳酸脱氢酶及GAPDH都能够催化膜的融合。而且在研究的蛋白中,兔肌GAPDH是最有效的催化膜融合的蛋白质,0.1μmol/L的兔肌GAPDH就足以诱导磷脂膜泡的融合。进一步的研究发现,GAPDH催化膜的融合依赖于GTP、Rab、PKC、ATP及微管蛋白等的调节,在这个过程中,微管蛋白起抑制GAPDH催化膜融合的作用。首先,GTP激活Rab募集GAPDH到微管轨道的膜泡上;随后,PKC磷酸化GAPDH,从而改变GAPDH与微管蛋白的相互作用,使得微管蛋白的抑制作用解除;之后,磷酸化的GAPDH催化膜泡融合到靶膜上。膜融合完成后,磷酸化的GAPDH在ATP及分子伴侣的作用下从微管中释放,并在磷酸酶的作用下脱磷酸化为原来的状态 (图 2)[22~24]。

图2 GAPDH催化膜融合的机制 ①GTP激活Rab募集GAPDH到微管轨道的膜泡上,此时,GAPDH催化膜融合的活性受到微管蛋白的抑制;②PKC磷酸化GAPDH,从而改变GAPDH与微管蛋白的相互作用,使得微管蛋白的抑制作用解除;③磷酸化的GAPDH催化膜泡融合到靶膜上;④膜融合完成后,磷酸化的GAPDH在ATP及分子伴侣的作用下从微管中释放;⑤磷酸化的GAPDH在磷酸酶的作用下脱磷酸化为原来的状态Fig.2 The mechanism of GAPDH-catalyzed membrane fusion①The GTP-activated Rab recruits GAPDH to vesicles on microtubule tracks.However,at this phase,the capacity of GAPDH in catalyzing membrane fusion is inhibited by tubulin;②Phosphorylation caused by PKC alters the interactions between tubulin and GAPDH,leading to the removal of tubulin inhibition on GAPDH;③Phosphorylated GAPDH catalyzes vesicles to fuse with the target membrane;④After membrane fusion is completed,GAPDH is released from the microtubules by ATP and chaperone proteins;⑤Dephosphorylated by phosphatase,GAPDH recovers to its initial state
Bryksin等[25]在研究高尔基体到内质网的囊泡运输时,发现GAPDH在此过程中发挥着重要作用。而Tisdale等[26]的研究则表明此过程与GAPDH的糖酵解活性无关,他们将GAPDH活性中心的Cys149替换成Gly149,结果发现,被PKCι/λ磷酸化的突变蛋白GAPDH(C149G)能够直接与Rab2结合,然后参与膜融合和膜转运过程,而该突变蛋白是没有糖酵解活性的,从而说明GAPDH催化膜转运的过程与其糖酵解活性无关。此外,研究还发现,利用抗体阻碍GAPDH的融合活性位点,会导致核膜组装失败,说明GAPDH也能够促进核膜融合。
促进细胞凋亡
细胞凋亡是细胞的一种基本生物学现象,在多细胞生物去除不需要的或异常的细胞中起着必要的作用,它涉及一系列基因的激活、表达及调控。许多研究表明,GAPDH能够促进细胞凋亡。Sunaga等[27]在不换培养基但定期补加葡萄糖的情况下,进行了大鼠小脑颗粒神经元的体外培养,发现神经元不断凋亡,进一步的研究发现细胞凋亡时伴有GAPDH基因的过表达。Ishitani等[28]发现,GAPDH的反义寡聚脱氧核苷酸片段不仅能够抑制老化神经元GAPDH基因的表达,而且能够促进神经元的存活。Guan等[29]的研究也表明,用重组人类红细胞生成素处理大鼠,能够通过抑制细胞核中GAPDH的过表达来降低神经元的凋亡数量。以上结果表明,GAPDH的过表达会促进细胞的凋亡过程,且研究表明,GAPDH促进细胞凋亡伴随着其在细胞中位置的改变,它会从细胞质中转移到细胞核或者线粒体中。NO刺激能明显增加GAPDH的核转位,并通过与E3泛素连接酶Siah1结合,随后激活p53,从而诱导细胞凋亡[30,31]。Tarze等[32]则研究发现,GAPDH与线粒体膜蛋白VDAC-1的结合,能够触发线粒体内细胞色素C和凋亡诱导因子等的释放,从而诱发凋亡。
最新研究又表明,GAPDH发生核转位后,其糖酵解酶活性会降低。Saunders等[33]用阿糖胞苷诱导神经元凋亡,发现GAPDH发生核转位后,细胞核GAPDH糖酵解酶的活性下降了60%,推测细胞通过降低GAPDH的糖酵解酶活性,使能量代谢发生障碍,从而诱导细胞凋亡。Nakazawa等[34]的研究也支持上述结论,他们用高效GAPDH抑制剂康宁吉克酸处理神经元细胞株NG108-15,发现抑制GAPDH糖酵解酶活性可以诱导NG108-15细胞的凋亡,且GAPDH糖酵解活性的下降发生在NG108-15细胞凋亡之前。
调节蛋白质的表达
蛋白质的表达过程十分复杂,几乎涉及细胞内所有种类的RNA和几十种蛋白质因子。研究发现,GAPDH能够通过促进tRNA的出核和调节mRNA的稳定性来调节蛋白质的表达。Singh等[35]将单碱基突变 (G57→U57)的甲硫氨酸tRNA显微注射入蛙卵母细胞中,发现突变的tRNA出核能力减弱,进一步研究表明主要原因是影响了tRNA与一个相对分子质量为37 kDa的蛋白质的结合,后证实该蛋白为GAPDH;通过免疫沉淀实验也确证了GAPDH/tRNA复合物的存在,且5μmol/L的NAD+能够完全抑制GAPDH/tRNA复合物的形成,同时,tRNA出核也受到抑制,说明GAPDH能够促进tRNA的出核,从而调节蛋白质的表达。GAPDH还能够通过与mRNA非编码区中富含AU的序列结合来调节mRNA的稳定性[36],从而对蛋白质的表达进行转录后调控。在正常细胞中,GAPDH是mRNA的减稳蛋白,它会破坏某些蛋白mRNA的结构、促进这些蛋白mRNA的降解,从而减少相关蛋白的生物合成,以维持细胞内蛋白水平的平衡[37];而在一些肿瘤细胞中,GAPDH却能够增加某些蛋白mRNA的稳定性。如GAPDH对于维持卵巢癌细胞中集落刺激因子1(colony-stimulating factor-1,CSF-1)mRNA的稳定及CSF-1的表达是非常重要的,利用RNA干扰技术下调GAPDH的表达,会降低细胞内CSF-1的mRNA稳定性及蛋白水平[38,39]。由此可以看出,GAPDH与不同蛋白的mRNA结合,会导致两种完全不同的结果,而产生这种结果的原因暂时还不明确,可能是因为不同的mRNA具有不同的下游调控因子。
此外,研究还发现组蛋白的表达也受到GAPDH的调节。组蛋白是存在于染色体内与DNA结合的碱性蛋白质,对染色体的结构起着非常重要的作用。早期研究发现,组蛋白2B(histone 2B,H2B)基因S期的转录依赖于组蛋白八聚体转录因子1(octamer-binding transcription factor-1,Oct-1)和 S期 Oct-1助激活剂 (Oct-1 co-activator in S-phase,OCA-S)的调节,进一步研究发现OCA-S主要由GAPDH和LDH组成,而OCA-S中的GAPDH能与Oct-1直接结合,表现出有效的反式激活潜力,复合物会在S期被选择性募集到H2B的启动子上,激活H2B的转录,从而调节H2B的表达。而利用RNAi技术降低GAPDH的表达或是利用免疫沉淀去除GAPDH,会导致H2B基因转录水平的降低或停止[40~42]。
参与DNA损伤修复
DNA存储着生物体赖以生存和繁衍的遗传信息,因此,维护DNA分子的完整性对细胞至关紧要,研究表明GAPDH在DNA损伤修复中具有重要的作用。许多核苷酸类似物都能够干扰DNA复制,从而造成DNA损伤。研究发现,GAPDH具有识别这些核苷酸类似物的能力,GAPDH能够连同其他蛋白一起,与带有硫鸟嘌呤、阿糖胞苷、5-氟尿嘌呤或其它错配碱基的DNA双链结合,形成DNA-蛋白复合物,从而启动DNA修复反应,而GAPDH在此过程中主要起到DNA修复识别传感器的功能[43]。研究还发现GAPDH具有尿嘧啶-DNA糖苷酶 (uracil DNA-glycosylase,UDG)活性,而UDG能够修复胞嘧啶脱氨为尿嘧啶的突变反应。GAPDH还能够通过还原脱嘌呤/嘧啶核酸内切酶1(apurinic/apyrimidinic endonuclease 1,APE1)参与DNA的损伤修复,APE1能够切除DNA链的脱嘌呤和脱嘧啶位点,为DNA损伤修复做准备[44],它在细胞内存在还原型和氧化型两种形式,而氧化型的APE1是不具有催化活性的,氧化型APE1的过多存在会危及到DNA的完整性及基因转录调控,研究发现GAPDH能够与APE1相互作用,使氧化型的APE1转变为还原形式,从而恢复APE1的核酸内切酶活性[45]。
此外,GAPDH还可以维持端粒的长度,从而提高DNA的稳定性。研究发现,GAPDH能够与端粒DNA特异性结合,从而阻止端粒变短。Sundararaj等[46]用神经酰胺处理人类肺癌细胞,结果导致其端粒长度快速变短,同时会抑制端粒与一个蛋白的结合,后确定该蛋白为GAPDH。进一步研究发现,干扰GAPDH的表达会使端粒快速变短,而过表达GAPDH又能够阻止神经酰胺等药物对端粒造成的损伤,从而说明GAPDH具有维持端粒长度的作用。而单碱基替换实验研究则表明,端粒DNA重复序列TTAGGG中的 T1、G5和G6碱基,对于GAPDH与端粒的结合是必要的,且端粒DNA与GAPDH四聚体结合的摩尔比为 2∶1[47]。
作为转铁蛋白受体
铁是生物体内一种非常重要的微量元素,参与许多生理生化过程,细胞主要通过转铁蛋白受体 (transferrin receptor,TfR)来捕获转铁蛋白 (transferrin,Tf)中摄取的铁。研究表明GAPDH能够作为TfR来参与铁代谢过程。Tanaka等[48]在研究布氏锥虫的铁代谢过程时,发现布氏锥虫的某种分子量为40 kDa的蛋白能够结合到牛乳铁蛋白 (Tf家族中的一种)上,且人乳铁蛋白、牛转铁蛋白及卵转铁蛋白都能与布氏锥虫的该种蛋白结合,通过N-末端序列鉴定,确定该蛋白为GAPDH,从而说明GAPDH能够作为TfR参与铁代谢过程。Raje等[49]对巨噬细胞的研究也支持该结论,他们研究发现人和鼠巨噬细胞表面的GAPDH能够与Tf相互作用,并结合形成GAPDH/Tf复合物,该复合物随后会内在化进入胞内体中,参与铁代谢过程。
进一步研究表明,GAPDH/Tf复合物摄取铁是一个低亲和、高容量且可循环的过程,依赖GAPDH作为TfR获取铁的途径有3种,包括网格蛋白介导的内吞作用、脂筏内吞作用及大胞饮作用[50]。而且,GAPDH作为转铁蛋白受体是基于GAPDH在细胞膜表面的定位来实现的,研究发现这种定位依赖于铁离子的浓度,在铁损耗时,随着结合到细胞表面Tf的增加,细胞表面GAPDH的表达量也会增加,然而,其他TfR的表达量则不变,这说明在铁损耗时,细胞更倾向于把GAPDH作为TfR来获取Tf[51]。
问题与展望
近年来,随着对GAPDH功能研究的不断深入,发现GAPDH并不仅仅是一个纯粹简单的糖酵解酶,而是一个参与许多亚细胞水平活动的多功能蛋白。但是,目前对于GAPDH某些生物功能的具体机制尚不完全清楚,如膜转运过程中GAPDH的具体作用、GAPDH怎样保护端粒不受损伤、GAPDH作为转铁蛋白受体怎样参与铁代谢过程、GAPDH与不同蛋白mRNA结合为什么会对mRNA的稳定性造成两种完全不同的结果、GAPDH在多个不同的生理途径中发挥作用到底有没有共同的根本基础等,这些问题都有待进一步的研究来阐明其中的奥秘。
此外,研究还发现GAPDH与许多疾病有关,如在研究GAPDH的磷酸化活性时,发现GAPDH可以磷酸化乙肝病毒,调节其致病性[52];而在研究GAPDH调节蛋白表达时,发现GAPDH可延长一些与肿瘤相关的细胞因子mRNA的半衰期,最终调控肿瘤细胞生长[38,39];而且研究还发现,一些病原虫只能依赖糖酵解途径获得能量,而利用抑制剂抑制GAPDH的活性或利用RNAi技术降低GAPDH的表达水平,对这些病原虫是致死的[53]。这些发现都深刻地说明了GAPDH在参与各种生理活动中的重要性,我们有理由相信,随着研究的不断深入和技术的不断进步,GAPDH的一些新功能还会相继被发现,而它的功能机制也将会不断被阐明。
1.Zhang XH,Rao XL,Shi HT,Li RJ,Lu YT.Overexpression of a cytosolic glyceraldehyde-3-phosphate dehydrogenase gene OsGAPC3 confers salt tolerance in rice.Plant Cell Tiss Organ Cult,2011,107(1):1~11
2. Kubo H. Cloning and expression analysis of putative glyceraldehyde-3-phosphate dehydrogenase genes in Pilobolus crystallinus.Mycoscience,2011,52(2):99~106
3.Wu YH,Wu M,He GW,Zhang X,Li WG,Gao Y,Li ZH,Wang ZY, Zhang CG. Glyceraldehyde-3-phosphate dehydrogenase:A universal internal control for Western blots in prokaryotic and eukaryotic cells.Anal Biochem,2012,423(1):15~22
4.Du ZX,Wang HQ,Zhang HY,Gao DX.Involvement of glyceraldehyde-3-phosphate dehydrogenase in tumor necrosis factor-related apoptosis-inducing ligand-mediated death of thyroid cancer cells.Endocrinology,2007,148(9):4352~4361
5. Ishitani R,Sunaga K,Tanaka M,Aishita H,Chuang DM. Overexpression of glyceraldehyde-3-phosphate dehydrogenase is involved in low K+-induced apoptosis but not necrosis of cultured cerebellar granule cells. Mol Pharmacol,1997,51(4):542~550
6.Mukherjee S,Dutta D,Saha B,Das AK.Crystal structure of glyceraldehyde-3-phosphate dehydrogenase 1 from methicillin-resistant Staphylococcus aureus MRSA252 provides novel insights into substrate binding and catalytic mechanism.J Mol Biol,2010,401(5):949~968
7. Robien MA,Bosch J,Buckner FS,Van Voorhis WCE,Worthey EA,Myler P,Mehlin C,Boni EE,Kalyuzhniy O,Anderson L,Lauricella A,Gulde S,Luft JR,DeTitta G,Caruthers JM,Hodgson KO,Soltis M,Zucker F,Verlinde CLMJ,Merritt EA,Schoenfeld LW,Hol WGJ.Crystal structure of glyceraldehyde-3-phosphate dehydrogenase from Plasmodium falciparum at 2.25Åresolution reveals intriguing extra electron density in the active site.Proteins:Struct,Funct,Bioinform,2006,62(3):570~577
8.Frayne J,Taylor A,Cameron G,Hadfield AT.Structure of insoluble rat sperm glyceraldehyde-3-phosphate dehydrogenase(GAPDH)via heterotetramer formation with Escherichia coli GAPDH reveals target for contraceptive design.J Biol Chem,2009,284(34):22703~22712
9. Kundu S,Roy D.Computational study of glyceraldehyde-3-phosphate dehydrogenase of Entamoeba histolytica:Implications for structure-based drug design. J Biomol Struct Dyn,2007,25(1):25~33
10.Nelson DL,Cox MM.Lehninger principles of biochemistry(4thEd).New York:Worth Publishers,2004
11. Launay JF, Jellali A, Vanier MT. Glyceraldehyde-3-phosphate dehydrogenase is a microtubule binding protein in a human colon tumor cell line.Biochim Biophys Acta,1989,996(1):103~109
12.Kumagai H,Sakai H.A porcine brain protein(35 K protein)which bundles microtubules and its identification as glyceraldehyde-3-phosphate dehydrogenase. J Biochem,1983,93(5):1259~1269
13.Somers M,Engelborghs Y,Baert J.Analysis of the binding of glyceraldehyde-3-phosphate dehydrogenase to microtubules,the mechanism of bundle formation and the linkage effect.Eur J Biochem,1990,193(2):437~444
14.Tisdale EJ.Glyceraldehyde-3-phosphate dehydrogenase is phosphorylated by protein kinase Cι/λ and plays a role in microtubule dynamics in the early secretory pathway.J Biol Chem,2002,277(5):3334~3341
15.Tisdale EJ,Artalejo CR.A GAPDH mutant defective in Src-dependent tyrosine phosphorylation impedes Rab2-mediated events.Traffic,2007,8(6):733~741
16.Huang QJ,Lan FH,Zheng ZY,Xie FL,Han JY,Dong LH,Xie YC, Zheng F. Akt2 kinase suppresses glyceraldehyde-3-phosphate dehydrogenase (GAPDH)-mediated apoptosis in ovarian cancer cells via phosphorylating GAPDH at threonine 237 and decreasing its nuclear translocation.J Biol Chem,2011,286(49):42211~42220
17.Makhina T,Loers G,Schulze C,Ueberle B,Schachner M,Kleene R.Extracellular GAPDH binds to L1 and enhances neurite outgrowth.Mol Cell Neurosci,2009,41(2):206~218
18.Thangima Zannat M,Bhattacharjee RB,Bag J.In the absence of cellular poly(A)binding protein,the glycolytic enzyme GAPDH translocated to the cell nucleus and activated the GAPDH mediated apoptotic pathway by enhancing acetylation and serine 46 phosphorylation of p53. Biochem Biophys Res Commun, 2011, 409(2):171~176
19.Engel M,Seifert M,Theisinger B,Seyfert U,Welter C.Glyceraldehyde-3-phosphate dehydrogenase and Nm23-H1/nucleoside diphosphate kinase A. Two old enzymes combine for the novel Nm23 protein phosphotransferase function.J Biol Chem,1998,273(32):20058~20065
20. Kawamoto RM, Caswell AH. Autophosphorylation of glyceraldehydephosphate dehydrogenase and phosphorylation of protein from skeletal muscle microsomes.Biochemistry,1986,25(3):657~661
21.Morero RD,Vinals AL,Bloj B,Farias RN.Fusion of phospholipid vesicles induced by muscle glyceraldehyde-3-phosphate dehydrogenase in the absence of calcium.Biochemistry,1985,24(8):1904~1909
22. Robbins AR, Ward RD, Oliver C. A mutation in glyceraldehyde-3-phosphate dehydrogenase alters endocytosis in CHO cells.J Cell Biol,1995,130(5):1093~1104
23.Tisdale EJ.Glyceraldehyde-3-phosphate dehydrogenase is required for vesicular transport in the early secretory pathway.J Biol Chem,2001,276(4):2480~2486
24.Glaser PE,Han X,Gross RW.Tubulin is the endogenous inhibitor of the glyceraldehyde-3-phosphate dehydrogenase isoform that catalyzes membrane fusion:Implications for the coordinated regulation of glycolysis and membrane fusion. Proc Natl Acad Sci USA, 2002, 99(22):14104~14109
25. Bryksin AV, Laktionov PP. Role of glyceraldehyde-3-phosphate dehydrogenase in vesicular transport from Golgi apparatus to endoplasmic reticulum.Biochemistry-Moscow,2008,73(6):619~625
26. Tisdale EJ, Kelly C, Artalejo CR. Glyceraldehyde-3-phosphate dehydrogenase interacts with Rab2 and plays an essential role in endoplasmic reticulum to Golgi transport exclusive of its glycolytic activity. J Biol Chem, 2004,279(52):54046~54052
27. Sunaga K, Takahashi H, Chuang DM, Ishitani R.Glyceraldehyde-3-phosphate dehydrogenase is overexpressed during apoptotic death of neuronal cultures and is recognized by a monoclonal antibody against amyloid plaques from Alzheimer's brain. Neurosci Lett, 1995,200(2):133~136
28.Ishitani R,Kimura M,Sunaga K,Katsube N,Tanaka M,Chuang DM. An antisense oligodeoxynucleotide to glyceraldehyde-3-phosphate dehydrogenase blocks ageinduced apoptosis of mature cerebrocortical neurons in culture.J Pharmacol Exp Ther,1996,278(1):447~454
29.关艳中,郭冉,念红,金秀东.重组人红细胞生成素通过抑制GAPDH核内过表达减少脑缺血大鼠神经元凋亡.生理学报,2012,64(3):269~274 Guan YZ,Guo R,Nian H,Jin XD.Involvement of inhibition of nucleus GAPDH over-expression in erythropoietin's reduction of neuronal apoptosis induced by brain ischemia/reperfusion in rats.Acta physiol Sin,2012,64(3):269~274
30.Inadomi C,Murata H,Ihara Y,Goto S,Urata Y,Yodoi J,Kondo T,Sumikawa K.Overexpression of glutaredoxin protects cardiomyocytes against nitric oxide-induced apoptosis with suppressing the S-nitrosylation of proteins and nuclear translocation of GAPDH.Biochem Biophys Res Commun,2012,425(3):656~661
31.Sen N,Hara MR,Kornberg MD,Cascio MB,Bae B,Shahani N,Thomas B,Dawson TM,Dawson VL,Snyder SH,Sawa A.Nitric oxide-induced nuclear GAPDH activates p300/CBP and mediates apoptosis.Nat Cell Biol,2008,10(7):866~873
32.Tarze A,Deniaud A,Le Bras M,Maillier E,Molle D,Larochette N,Zamzami N,Jan G,Kroemer G,Brenner C.GAPDH, a novel regulator of the pro-apoptotic mitochondrial membrane permeabilization.Oncogene,2007,26(18):2606~2620
33.Saunders PA,Chen RW,Chuang DM.Nuclear translocation of glyceraldehyde3-phosphate dehydrogenase isoforms during neuronal apoptosis.J Neurochem,1999,72(3):925~932
34.Nakazawa M,Uehara T,Nomura Y.Koningic acid(a potent glyceraldehyde-3-phosphate dehydrogenase inhibitor)-induced fragmentation and condensation of DNA in NG108-15 cells.J Neurochem,1997,68(6):2493~2499
35.Singh R,Green MR.Sequence-specific binding of transfer RNA by glyceraldehyde-3-phosphate dehydrogenase.Science,1993,259(5093):365~368
36. Nagy E, Rigby WF. Glyceraldehyde-3-phosphate dehydrogenase selectively binds AU-rich RNA in the NAD+-binding region(Rossman fold).J Biol Chem,1995,270(6):2755~2763
37.Rodriguez-Pascual F,Redondo-Horcajo M,Magan-Marchal N,Lagares D,Martinez-Ruiz A,Kleinert H,Lamas S.Glyceraldehyde-3-phosphate dehydrogenase regulates endothelin-1 expression by a novel, redox-sensitive mechanism involving mRNA stability.Mol Cell Biol,2008,28(23):7139~7155
38.BonaféN,Gilmore-Hebert M,Folk NL,Azodi M,Zhou Y,Chambers SK.Glyceraldehyde-3-phosphate dehydrogenase binds to the AU-rich 3' untranslated region of colony-stimulating factor-1 (CSF-1) messenger RNA in human ovarian cancer cells:Possible role of CSF-1 posttranscr iptional regu lation and tumor phenotype.Cancer Res,2005,65:3762~3771
39.Zhou Y,Yi X,Stoffer JB,Bonafe N,Gilmore-Hebert M,Mc Alpine J, Chambers SK. The multifunctional protein glyceraldehyde-3-phosphate dehydrogenase is both regulated and controls colony-stimulating factor-1 messenger RNA stability in ovarian cancer.Mol Cancer Res,2008,6(8):1375~1384
40.Mc Knight S.Gene switching by metabolic enzymes-How did you get on the invitation list? Cell,2003,114(2):150~152
41.Zheng L,Roeder RG,Luo Y.S phase activation of the histone H2B promoter by OCA-S,a coactivator complex that contains GAPDH as a key component.Cell,2003,114(2):255~266
42.Dai RP,Yu FX,Goh SR,Chng HW,Tan YL,Fu JL,Zheng L,Luo Y.Histone 2B(H2B)expression is confined to a proper NAD+/NADH redox status.J Biol Chem,2008,283(40):26894~26901
43.Krynetski EY,Krynetskaia NF,Gallo AE,Gopal Murti K,Evans WE.A novel protein complex distinct from mismatch repair binds thioguanylated DNA.Mol Pharmacol,2001,59(2):367~374
44.Demple B,Harrison L.Repair of oxidative damage to DNA:Enzymology and biology.Annu Rev Biochem,1994,63:915~948
45.Azam S,Jouvet N,Jilani A,Vongsamphanh R,Yang XM,Yang S,Ramotar D.Human glyceraldehyde-3-phosphate dehydrogenase plays a direct role in reactivating oxidized forms of the DNA repair enzyme APE1.J Biol Chem,2008,283(45):30632~30641
46.Sundararaj KP,Wood RE,Ponnusamy S,Salas AM,Szulc Z,Bielawska A,Obeid LM,Hannun YA,Ogretmen B.Rapid shortening of telomere length in response to ceramide involves the inhibition of telomere binding activity of nuclear glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem,2004,279(7):6152~6162
47.Demarse NA,Ponnusamy S,Spicer EK,Apohan E,Baatz JE, Ogretman B, Davies BC. Direct binding of glyceraldehyde-3-phosphate dehydrogenase to telomeric DNA protects telomeres against chemotherapy-induced rapid degradation.J Mol Biol,2009,394(4):789~803
48.Tanaka T,Abe Y,Inoue N,Kim WS,Kumura H,Nagasawa H,Igarashi I,Shimazaki K.The detection of bovine lactoferrin binding protein on Trypanosoma brucei.J Vet Med Sci,2004,66(6):619~625
49.Raje CI,Kumar S,Harle A,Nanda JS,Raje M.The macrophage cell surface glyceraldehyde-3-phosphate dehydrogenase is a novel transferrin receptor. J Biol Chem,2007,282(5):3252~3261
50.Kumar S,Sheokand N,Mhadeshwar MA,Raje CI,Raje M.Characterization of glyceraldehyde-3-phosphate dehydrogenase as a novel transferrin receptor.Int J Biochem Cell Biol,2012,44(1):189~199
51.Rawat P,Kumar S,Sheokand N,Raje CI,Raje M.The multifunctional glycolytic protein glyceraldehyde-3-phosphate dehydrogenase(GAPDH)is a novel macrophage lactoferrin receptor.Biochem Cell Biol,2012,90(3):329~338
52. Duclos-Vallee JC, Capel F, Mabit H, Petit MA.Phosphorylation of the hepatitis B virus core protein by glyceraldehyde-3-phosphate dehydrogenase protein kinase activity.J Gen Virol,1998,79(Pt 7):1665~1670
53.Caceres AJ,Michels PAM,Hannaert V.Genetic validation of aldolase and glyceraldehyde-3-phosphate dehydrogenase as drug targets in Trypanosoma brucei. Mol Biochem Parasitol,2010,169(1):50~54