拟南芥MYB51转录因子对芥子油苷代谢的调控作用
2013-09-20蒿连梅王洪波
李 晶,蒿连梅,王洪波
(东北农业大学农业生物功能基因重点实验室,哈尔滨 150030)
芥子油苷(Glucosinolate)是一类含氮、含硫的植物次生代谢产物,广泛存在于十字花科植物中,由β-D-硫葡萄糖基、硫化肟基团以及来源于氨基酸的侧链R基组成。根据侧链氨基酸来源的不同,芥子油苷分为来源于甲硫氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸的脂肪族芥子油苷,来源于色氨酸的吲哚族芥子油苷、来源于苯丙氨酸和酪氨酸的芳香族芥子油苷。芥子油苷及其水解产物具有多种不同的生物活性,可参与植物对病原菌、昆虫侵害等生物胁迫的防御性反应[1-4]。研究表明某些脂肪族芥子油苷具有抗癌活性,是迄今在植物中发现的最强抗癌活性物质[5-8]。近年来关于芥子油苷代谢调控的研究已成为植物次生代谢领域的研究热点。
拟南芥中MYB51转录因子是一类R2R3-MYB类转录因子,主要参与调控吲哚族芥子油苷的代谢。当拟南芥受到外源病菌侵染时,MYB51转录因子通过增加吲哚族芥子油苷含量参与植物对病原菌的防御反应[9-10]。在拟南芥中过量表达MYB51基因后,吲哚族芥子油苷含量升高,对广食性鳞翅目类昆虫甜菜夜蛾(Spodoptera exigua)与粉文夜蛾(Trichoplusia ni)也表现出一定的防御性[11]。Clay等发现吲哚族芥子油苷的降解产物参与病原菌诱导的细胞壁胼胝脂累积,从而使植物获得广谱抗病性[12]。水杨酸与茉莉酸介导的信号途径与植物抗病性防御反应密切相关[13-14]。研究表明,拟南芥叶片受到病原菌侵染后,芥子油苷种类和含量发生显著变化,且有可能通过参与信号转导启动相应的防御性反应[15]。
为深入了解MYB51对不同结构芥子油苷合成代谢的调控及芥子油苷参与信号转导的可能性,构建过量表达MYB51基因的植物表达载体并将其转入拟南芥,采用RT-PCR方法,系统分析吲哚族芥子油苷合成酶基因、脂肪族芥子油苷合成酶基因以及水杨酸和茉莉酸介导的信号转导途径的标记基因表达变化。研究结果初步揭示了MYB51转录因子在芥子油苷代谢途径中的调控作用,MYB51可以促进吲哚族芥子油苷的合成,但同时抑制脂肪族芥子油苷的合成,对两种不同侧链结构的芥子油苷的相对比例起协调作用,信号转导途径的标记基因变化说明吲哚族芥子油苷可能直接或间接参与茉莉酸和水杨酸介导的信号转导,可为MYB51转录因子在整个芥子油苷代谢网络中的作用提供理论参考。
1 材料与方法
1.1 材料
野生型拟南芥(哥伦比亚生态型)种子4℃春化3 d后播种于由蛭石与黑土比例为1∶1的土中,于培养室中培养。培养条件为:温度23℃,相对湿度70%,光照强度7 000 lx,光照长度16 h·d-1。
大肠杆菌DH5α、农杆菌LBA4404等材料均由东北农业大学植物次生代谢研究室保存。
1.2 方法
1.2.1 MYB51基因在拟南芥中的过量表达
1.2.1.1 MYB51基因的克隆及植物表达载体的构建
取生长三周的拟南芥幼嫩叶片,采用Trizol(Invitrogen)试剂按照产品说明书提取总RNA。以总RNA为模板,采用TaKaRa反转录试剂盒以Oli⁃go dT为引物合成cDNA第一条链,再以cDNA为模板,PCR扩增MYB51基因的编码序列。引物序列为 5'ggcttaaUATGGTGCGGACACCGTGT3'和 5'ggtt⁃taaUTCATCCAAAATAGTTATCAATTTCG 3'。
以pCAMBIA230035Su载体为基础[16],经PacⅠ和Nt.BbvCIB酶切后,将上述克隆获得的MYB51基因片段连入植物表达载体,构建成由组成型启动子CaMV35S驱动的过量表达MYB51基因的植物表达载体。
1.2.1.2 MYB51基因对拟南芥的遗传转化
将上述获得的植物表达载体转入大肠杆菌DH5α中,经测序证明所获得DNA序列准确无误后转入农杆菌。以农杆菌介导的花序侵染法遗传转化拟南芥[17],用含有50 mg·L-1卡那霉素的1/2MS培养基筛选抗性植株。抗性植株移栽四周后分别提取DNA和RNA,进行外源基因整合的PCR鉴定和目的基因表达水平的RT-PCR检测。
1.2.1.3 转基因植株中外源基因整合情况的分子鉴定
取拟南芥T1代抗性植株叶片,用DNA提取试剂盒(Easy pure plant genomic DNA extraction kit)提取基因组DNA。为避免拟南芥内源MYB51基因的干扰,采用MYB51基因特异性引物和植物表达载体特异性引物进行PCR检测。引物序列为:5'TT⁃GCGATAAAGGAAAGGC3'和 5'TCATCCAAAA TAGTTATCAATTTCG 3'。扩增片段长度为1 308 bp。
1.2.1.4 转基因植株中MYB51表达水平的检测
取上述PCR检测为阳性的植株叶片,用RNA prep Plant Kit试剂盒提取样品的总RNA,以TaKa⁃Ra反转录试剂盒以Oligo dT为引物合成cDNA第一条链,以5'TCTGTCTGAGATTATCGGAAGTGG 3'和5'CCAACGAAATTATCGCAGTACATTAG 3'为引物进行PCR扩增,片段长度为270 bp。
内参基因ACTIN2的RT-PCR引物为5'CCATC CTCCGTCTTGACCTT3'和5'ACTTGCCCATCGGGT AATTC 3',扩增片段长度约200 bp。
1.2.2 过量表达MYB51的转基因植株中吲哚族芥子油苷合成酶基因的表达分析
分别取生长六周的转基因植株和野生型植株叶片,提取RNA并制备cDNA,方法如上所述。对几种主要的吲哚族芥子油苷合成酶基因表达水平进行分析,所需引物序列如下。CYP79A2的引物为5'CGATGGGCACGGAGTACTG 3'和5'CAAAGG CGTAAAGATGGGTTAA 3';CYP79B2的引物为5'ACCGTAGAAGATGTAGAGCACATG 3'和5'GCTC CTTAATGGTGGGTTTGATT 3';CYP79B3 的引物为5'GTGGACCGACTTTGGAAGATATC 3'和5'CGGC TTTGATGGGTTGTCT 3';CYP83B1的引物为5'GAAAGGGCAACAAACCATGTC 3'和5'GGTTGTA AGGAATCCGAAATAA 3'。
1.2.3 过量表达MYB51的转基因植株中脂肪族芥子油苷合成酶基因的表达分析
分别取生长六周的转基因植株和野生型植株叶片,提取RNA并制备cDNA,方法如上所述。对几种主要的脂肪族芥子油苷合成酶基因表达水平进行分析,所需引物序列如下。CYP79F1的引物为5'AAGCGGATAATCTCATAGCTTACG 3'和5'CC AATCTTCAACAGCAGCCTTA 3';CYP79F2 的 引 物为5'TGGTTAGGTGGTTGGAATATTGA 3'和5'CCC AAGGGTGGTATCTTGACG 3'。
1.2.4 过量表达MYB51的转基因植株中水杨酸与茉莉酸信号途径标记基因的表达分析
分别取转基因植株和野生型植株叶片,提取RNA并制备cDNA,方法如上所述。分别对水杨酸信号途径标记基因PR1、PR2与茉莉酸信号途径标记基因PDF1.2的表达水平进行分析,所需引物序列如下。PR1的引物为5'TTCACAACCAGGCAC⁃GAGG 3'和 5'TGTTACACCTCACTTTGGCACAT 3';PR2的引物为5'GGCTCTTTACAAACAACAAAA⁃CATC 3'和5'TCTTATACTCATCCCTGAACCTTCC 3';PDF1.2 的引物为 5'ATGGCTAAGTTTGCTTC⁃CATCA 3'和 5'TTAACATGGGACGTAACAGATA⁃CAC 3'。
2 结果与分析
2.1 MYB51基因的克隆及植物表达载体的构建
以拟南芥三周大叶片的cDNA为模板经RTPCR扩增获得长度为1 059 bp的基因片段如图1所示,经测序证明与拟南芥的MYB51基因CDS序列一致。以植物表达载体pCAMBIA230035Su为基础,经PacⅠ和Nt.BbvCIB酶切后,将上述克隆获得的MYB51基因片段连入载体,构建成由组成型启动子CaMV35S驱动的过量表达MYB51基因的植物表达载体(以下称35S∶MYB51)。采用农杆菌介导的花序侵染法将上述构建的植物表达载体转入拟南芥。经筛选获得具有卡那霉素抗性的植株40株。

图1 MYB51基因的RT-PCR扩增结果Fig.1 RT-PCR amplification of MYB51
2.2 MYB51转基因植株的鉴定
2.2.1 转基因植株中外源基因整合情况的PCR鉴定
以植物表达载体序列特异引物和MYB51基因特异引物进行PCR检测,在40株抗性植株中均能扩增到长度约为1 308 bp的预期片段。35S:MYB51转基因植株的部分PCR鉴定结果如图2所示。结果表明MYB51基因已整合至拟南芥的基因组中。
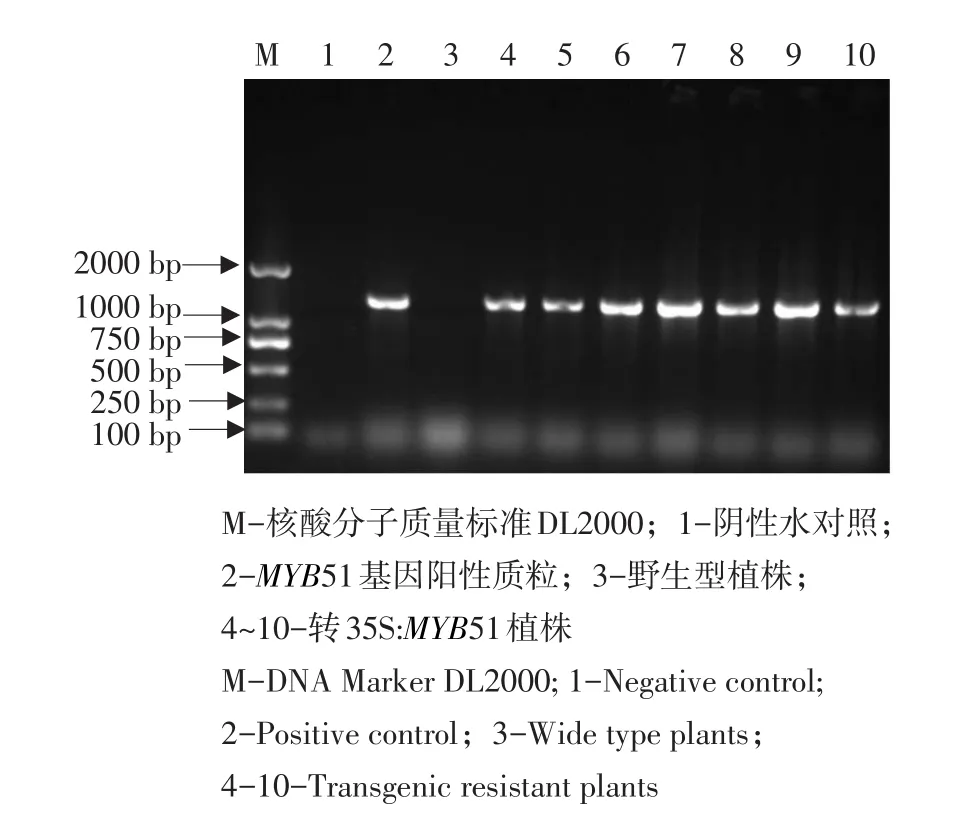
图2 转MYB51 T1代抗性植株的PCR检测Fig.2 PCR confermation of T135S:MYB51 transgenic plants
2.2.2 转基因植株中MYB51表达水平的RT-PCR鉴定
进一步通过半定量RT-PCR方法检测T1代PCR阳性植株中MYB51是否超表达。选择PCR阳性植株10株,获得6个超表达株系#L1、#L2、#L3、#L4、#L5和#L6,MYB51在这6个株系中超量表达(见图3)。
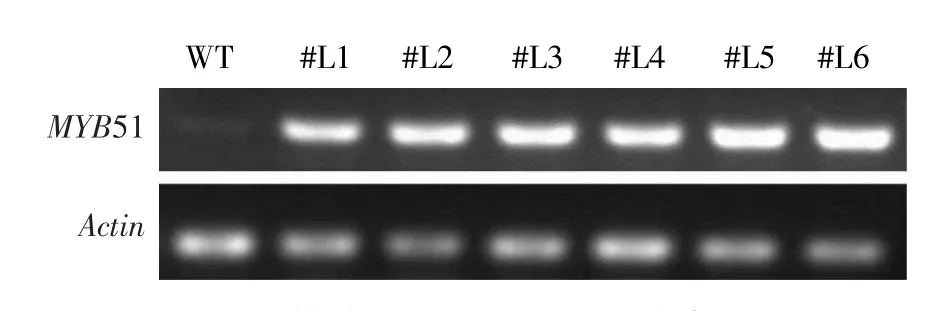
图3 转基因植株中MYB51的表达Fig.3 Expression level of MYB51 in transgenic plants
2.3 过量表达MYB51基因对吲哚族芥子油苷合成酶基因的影响
用半定量RT-PCR方法,分析35S:MYB51转基因植株中吲哚族芥子油苷合成酶基因的表达情况。结果显示,与野生型相比转基因植株中吲哚族芥子油苷合成酶基因的表达发生不同程度改变。
如图4所示,CYP79A2和CYP79B2基因在35S∶MYB51植株中的表达显著高于野生型植株。CYP79B3在35S∶MYB51植株中的表达量稍高于野生型。CYP83B1基因的表达量与野生型相比变化不太明显。以上结果说明在过表达MYB51基因的植株中吲哚族芥子油苷合成酶基因的表达水平普遍上升,MYB51转录因子对吲哚族芥子油苷合成酶基因的表达有促进作用。

图4 35S:MYB51中吲哚族芥子油苷合成酶基因表达水平的变化Fig.4 Expression of indolic glucosinolates biosynthetic genes in 35S:MYB51
2.4 过量表达MYB51基因对脂肪族芥子油苷合成酶基因的影响
CYP79F1与CYP79F2基因是脂肪族芥子油苷合成途径中的关键酶基因,半定量RT-PCR分析表明过表达MYB51基因的植株中,CYP79F1与CYP79F2基因的表达量降低(见图5)。说明MYB51转录因子对脂肪族芥子油苷合成酶基因CYP79F1与CYP79F2的表达有一定抑制作用。

图5 35S:MYB51中脂肪族芥子油苷合成酶基因表达水平的变化Fig.5 Expression of aliphatic glucosinolates biosynthetic genes in 35S:MYB51
2.5 过量表达MYB51基因对水杨酸和茉莉酸信号途径标记基因的影响
PR1、PR2基因是水杨酸信号途径的标记基因,PDF1.2为茉莉酸信号途径的标记基因。在过表达MYB51基因的植株中,PR1与PR2基因的表达量降低。PDF1.2基因的表达量则显著升高,如图6所示。可以说明MYB51转录因子抑制PR1与PR2基因的表达,而强烈诱导PDF1.2基因的表达。

图6 35S:MYB51中水杨酸和茉莉酸信号途径标记基因表达水平的变化Fig.6 Expression of JA-signal marker genes and SA signal marker gene in 35S:MYB51
3 讨论
芥子油苷及其降解产物在植物抗生物胁迫的防御性反应中起重要作用[18]。脂肪族和吲哚族芥子油苷是拟南芥中主要的芥子油苷类型,其中吲哚族芥子油苷合成主要由转录因子MYB51调控[19-20]。近年大量研究表明,吲哚族芥子油苷的代谢途径在植物抗病性防御反应中必不可少[21-23],其重要性和作用机制的复杂性似乎超出预测。吲哚族芥子油苷对病原菌和昆虫的防御作用一直被归结于化学毒性,直至发现吲哚族芥子油苷的水解产物参与细胞壁胼胝脂合成从而引发植物广谱抗菌性。这一新机制的发现使吲哚族芥子油苷的合成、调控及其抗生物胁迫机制的研究受到极大关注[24]。
本研究将MYB51基因转入拟南芥,获得PCR检测为阳性并过量表达MYB51的转基因植株。对转基因植株中芥子油苷合成途径相关基因表达情况进行分析。结果表明,过量表达MYB51基因对吲哚族芥子油苷合成酶基因的表达有促进作用,而对脂肪族芥子油苷合成酶基因的表达有抑制作用,脂肪族芥子油苷的合成与吲哚族芥子油苷的合成之间的关系有两种可能:一种是反馈调节机制,当MYB51基因过量表达时,激活吲哚族芥子油苷合成酶基因,使吲哚族芥子油苷大量积累,促使植物体内的反馈调节机制启动,脂肪族芥子油苷合成酶基因的表达下降,脂肪族芥子油苷的合成减弱。另一种是相互竞争机制。MYB51基因过量表达后,激活吲哚族芥子油苷合成酶基因表达,消耗大量原料与能量使吲哚族芥子油苷积累,合成脂肪族芥子油苷所需的物质能量减少,从而使脂肪族芥子油苷合成酶基因表达量降低。可见,脂肪族芥子油苷和吲哚族芥子油苷之间存在竞争和相互制约关系。
MYB51基因的过量表达不仅促进吲哚族芥子油苷的合成,同时还导致茉莉酸信号途径的增强和水杨酸信号途径的减弱,说明吲哚族芥子油苷或者其降解产物可能是通过参与逆境信号转导启动相应的防御性反应。由生物胁迫所诱导的信号转导途径网络复杂,芥子油苷如何参与这些途径,以及除细胞壁胼胝质合成外是否引发其他的防御性反应,还需进一步研究。
4 结 论
MYB51转录因子在芥子油苷合成过程中起重要调控作用,可促进吲哚族芥子油苷的合成,同时抑制脂肪族芥子油苷的合成。MYB51转录因子介导的吲哚族芥子油苷合成途径可直接或间接地增强茉莉酸信号途径并抑制水杨酸途径,并由此启动相应的防御性反应。
[1]Halkier B A,Gershenzon J.Biology and biochemistry of glucosino⁃lates[J].Annu Rev Plant Biol,2006,57:303-333.
[2]Zhang Z,Ober J A,Kliebenstein D J.The gene controlling the quantitative trait locus Epithiospecifier Modifier1 alters glucosino⁃late hydrolysis and insect resistance in Arabidopsis[J].Plant Cell,2006,18:1524-1536.
[3]Kurt S,Gunes U,Soylu E M.In vito and in vivo antifungal activity of synthetic pure isothiocyanates against Sclerotinia sclerotiorum[J].Pest Manag Sci,2011,67:869-875.
[4]Bednarek P,Pislewska B M,Svatos A,et al.A gulcosinolate ma⁃tabolism pathway in living plant cells mediates broad-spectrum antifungal defense[J].Science,2009,323:101-106.
[5]Rose P,Huang Q,Ong C N,et al.Broccoli and watercress sup⁃press matrix metalloproteinase-9 activity and invasiveness of hu⁃man MDA-MB-231 breast cancer cells[J].Toxicol Appl Pharma⁃col,2005,209:105-113.
[6]Fahey J W,Haristoy X,Dolan P M,et al.Sulforaphane inhibits ex⁃tracellular,intracellular,and antibiotic-resistant strains of Helico⁃bacter pylori and prevents benzo[a]pyrene-induced stomach tu⁃mors[J].Proc Natl Acad Sci USA,2002,99:7610-7615.
[7]Anilakumar K R,Khanum F,Bawa A S.Dietary role of glucosino⁃late derivatives:Review[J].J Food Sci Technol Mysore,2006,43:8-17.
[8]Talalay P,Fahey J W,Healy Z R,et al.Sulforaphane mobilizes cellular defenses that protect skin against damage by UV radiation[J].Proc Natl Acad Sci USA,2007,104:17500-17505.
[9]Schlaeppi K,Abou-Mansour E,Buchala A,et al.Diease resis⁃tance of Arabidopsis to Phytophthora brassicae is established by the sequential action of indole glucosinolates and camalexin[J].Plant Journal,2010,62:840-851.
[10]Agerbirk N,Vos M D,Kim J H,et al.Indole glucosinolate break⁃down and its biological effects[J].Phytochemistry Review,2009(8):101-120.
[11]Gigolashvili T,Berger B,Mock H P,et al.The transcription factor HIG1/MYB51 regulates indolic glucosinolate biosynthesis in Ara⁃bidopsis thaliana[J].Plant Journal,2007,50:886-901.
[12]Clay N K,Adio A M,Denoux C,et al.Glucosinolate metabolites required for an Arabidopsis innate immune response[J].Science,2009,323(5910):95-101.
[13]Guo X M,Stotz H U.Defense against Sclerotinia sclerotiorum in Arabidopsis is dependent on jasmonic acid,salicylic acid,and eth⁃ylene signaling[J].Molecular Plant-Microbe Interactions,2007,20(11):1384-1395.
[14]Kunkel B N,Brooks D M.Cross talk between signaling pathways in pathogen defense[J].Plant Biology,2002,5:325-331.
[15]Brader G,Mikkelsen D M,Halkier B A,et al.Altering glucosino⁃late profiles modulates disease resistance in plants[J].Plant Jour⁃nal,2006,46:758-767.
[16]Hussam H,Eldin N,Hansen B G,et al.Advancing uracil-exci⁃sion based cloning towards an ideal technique for cloning PCR fragments[J].Nucleic Acids Research,2006,34:122.
[17]Steven J,Clough,Bent A F.Floral dip:A simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J].Plant Journal,1998,16(6):735-743.
[18]陈亚州,阎秀峰.芥子油苷在植物-生物环境关系中的作用[J].东北农业大学学报,2007,27(6):2584-2593.
[19]Sønderby I E,Burow M,Heather C,et al.A complex interplay of three R2R3 MYB transcription factors determines the profile of al⁃iphatic glucosinolates in Arabidopsis[J].Plant Physiology,2010,153:348-363.
[20]李梦莎,石璐,国静.两种拟南芥MYB51突变体的鉴定与初步分析[J].东北农业大学学报,2012,43(4):121-125.
[21]Schlaeppi K,Mauch F.Indolic secondary metabolites protect Ara⁃bidopsis from the oomycete pathogen Phytophthora brassicae[J].Plant Signaling&Behavior,2010(5):1099-1101.
[22]Kliebenstein D J,Rowe H C,Denby K J.Secondary metabolites influence Arabidopsis/Botrytis interactions:Variation in host pro⁃duction and pathogen sensitivity[J].Plant J,2005,44:25-36.
[23]Hiruma K,Onozawa-Komori M,Takahashi F,et al.Entry modedependent function of an indole glucosinolate pathway in Arabidopsis for nonhost resistance against anthracnose pathogens[J].Plant Cell,2010,22:2429-2443.
[24]Millet Y A,Danna C H,Clay N K,et al.Innate immune responses activated in Arabidopsis roots by microbe-associated molecular patterns[J].Plant Cell,2010,22:973-990.
