随机限食和重喂食对小鼠体重、能量收支及瘦素的影响
2013-09-20赵志军魏文涛李明振
赵志军 ,魏文涛,李明振,曹 静
1. 温州大学 生命与环境科学学院, 浙江 温州 325035
2. 聊城大学 农学院, 山东 聊城 252059
食物资源变化是影响动物体重和能量代谢的主要因素。限食可降低大、小鼠体重和脂肪含量,而恢复自由取食后其体重将反弹的现象被称为体重的“补偿性增长”(Sohar & Sneh,1973;Szepesi& Epstein,1977;Cleary,1986a,b;Weindruch &Sohal,1997;Alvarenga et al,2005;Speakman &Hambly,2007;Speakman & Mitchell,2011)。自由取食后动物能量摄入和消化效率的显著增加,被认为是导致体重“补偿性增长”的主要原因(Cleary,1986a,b;Archambault et al,1989)。能量支出在能量平衡的生理调节中具有重要地位,体重变化取决于能量摄入和支出的失衡。基础代谢率(basal metabolic rate,BMR)、非颤抖性产热(nonshivering,NST)和活动行为是能量支出的重要组成成分,且均受限食影响(Hambly & Speakman,2005;Speakman & Mitchell,2011)。不同动物对限食驯化的反应并不完全相同,且与动物的限食方案(如限食程度、持续时间等)及种属差异等有关。例如,限食80%的MF1小鼠和限食40%~50%的实验大鼠的BMR和活动行为显著降低(Alvarenga et al,2005;Hambly & Speakman,2005)。随机限食的KM小鼠和黑线仓鼠(Cricetulus barabensis)活动行为增加(Cao et al,2009;Zhao & Cao,2009;Zhao et al,2009a,b)。重喂食后,能量支出将恢复至驯化前水平,表明能量支出的适应性变化也是动物应对食物资源波动的能量学策略之一,然而,该变化在动物体重“补偿性增长”过程中的作用尚不清楚。
瘦素是白色脂肪组织合成和分泌的蛋白类激素,在体重和能量代谢的生理调节中发挥重要作用(Friedman & Halaas,1998;Zhao & Wang,2006)。机体瘦素水平取决于脂肪的贮存情况(Friedman &Halaas,1998;Wisse et al,1999)。限食诱导体重和脂肪含量降低的同时,血清瘦素水平也显著减低(Wisse et al,1999;Gutman et al,2006;Zhang &Wang,2008)。恢复自由取食后体重和脂肪反弹的同时,也伴随着血清瘦素水平的显著上升(Wisse et al,1999;Zhang & Wang,2008)。因此,在限食和重喂食诱导的体重“补偿性增长”过程中,瘦素可能参与能量摄入和支出调节。
KM小鼠在食物短缺时,表现能量支出的生理适应性调节(Cao et al,2009;Zhao & Cao,2009;Zhao et al,2009a,b,c),在食物资源波动时,则表现体重的“补偿性增长”(Zhao et al,2011)。然而,体重“补偿性增长”过程中能量摄入和支出的变化及其生理调节机制尚不明确。本研究将KM小鼠驯化于连续的随机限食和重喂食(SFR-Re)以测定其摄食量、BMR、NST以及褐色脂肪组织(brown adipose tissue,BAT)细胞色素c氧化酶(cytochrome c oxydase,COX)活性和解偶联蛋白1(uncoupling protein 1,UCP1)含量。我们假设,SFR-Re驯化后的小鼠将显著增加其摄食量,并降低BMR、NST和活动行为,表现体重的“补偿性增长”,同时,血清瘦素可能参与该过程中能量收支的生理调节。
1 材料与方法
1.1 实验动物与实验方案
雄性KM小鼠(8~10周龄)购自山东大学实验动物中心(生产许可证号:SCXK(鲁)2003~0004)。单笼饲养,光照 12L:12D(光照 8:00—20:00),温度(23±1)℃,自由取食(北京科澳协力饲料有限公司标准鼠饲料,粗脂肪6.2%、粗蛋白20.8%、中性洗涤纤维 23.1%、酸性洗涤纤维 12.5%、灰分10.0%、能值17.5 kJ/g)。动物随机分为对照组(自由取食)(Con,n=20)及随机限食后重喂食组(SFR-Re,n=23)。第一周随机选取1 d任其自由取食,其余6 d随机饲喂其自由摄食量的0%、20%、40%、60%、80%和100%,第二周恢复自由取食(亦称重喂食),如此称为一次SFR-Re(即随机限食一周+重喂食一周),重复3次(共6周,图1)。

图1 KM小鼠SFR-Re实验方案Figure 1 Timeline showing which days stochastic food restriction occurred in KM mice
1.2 体重与摄食量
每天16:30 — 17:00测定小鼠体重和摄食量,并根据限食计划,为其添加已知量的食物。于驯化前测定其自由取食条件下的摄食量,并据此计算自由摄食量的20%、40%、60%、80%和100%作为限食当日的食物投放量。
1.3 行为观测
在第3次SFR-Re驯化过程中,于18:00—22:00用远红外摄像头(SONY,420 TV line)观测动物行为,数据自动记录于与其相连的计算机,通过回放观察分析。根据Speakman et al(2001)的方法将行为分为4类:(1)一般活动行为,指动物在饲养笼内行走、攀爬和跳跃等;(2)摄食行为,指取食而非饮水;(3)修饰行为,指动物的自我修饰,如舔舐皮毛等;(4)休息行为,指任何非活动行为(Speakman et al,2001;Zhao et al,2009a,b)。记录每一种行为的持续时间(min),并计算此种行为占总观测时间的百分率。
1.4 代谢率及非颤抖性产热
驯化结束后,于 10:00—16:00以封闭式流体压力呼吸计法测定BMR和NST(具体参照Wang et al,2000;Zhao et al,2009a,b)。BMR 测定温度为(30±1)℃(热中性区温度,Zhang et al,2007)。动物饥饿4 h后放入呼吸室适应1 h,待动物稳定后开始记录,每隔5 min记录一次,连续测定60 min,选取两个连续稳定的最低值计算 BMR。NST采用皮下注射与动物体重相应剂量的去甲肾上腺素(NE,上海禾丰制药有限公司,批号:111102)诱导(Heldmaier,1971;Wang & Wang,2006),NE剂量根据公式 NE(mg/kg)=6.6×Mb–0.458(g)(Heldmaier,1971)计算,测定温度为(25±1)℃(Wang & Wang,1990),测定方法同BMR,连续测定60 min,选取两个连续稳定的最高值计算NST。
1.5 消化能(digestive energy intake,DEI)和消化率(digestibility)
在SFR-Re驯化的最后一周,以食物平衡法测定DEI和消化率(Zhao et al,2008)。计算方法参考Grodzinski & Wunder(l975)及 Zhao et al(2008),摄入能(kJ/7d)=干物质摄入(g/7d)×食物能值(kJ/g);DEI(kJ/7d)=GEl(kJ/7d)–粪便重量(g/7d)×粪便能值(kJ/g);消化率(%)=(DEI/GEI)× 100%。
1.6 血清瘦素和身体成分
驯化结束后,断颈处死动物。取血,自然凝集2 h,3 500 r/min离心30 min,吸取血清,并保存于–20 ℃备用。待所有样品收集完毕,用放射性免疫试剂盒(北方生物技术研究所,北京)测定血清瘦素含量。实验程序和步骤按照说明书进行,批内和批间变异系数均<10%。分离心脏、肺、肝、肾和脾脏,剔除附着的结缔组织,称重(精确至l mg)。取出消化道,分离胃、小肠、大肠和盲肠,去除内容物,称重(精确至 l mg)。分离睾丸周脂肪、腹部脂肪和皮下脂肪,合并称重(精确至l mg)。
1.7 BAT COX和UCP1
快速分离肩胛间 BAT,置于液氮,提取 BAT线粒体蛋白(Zhao & Wang,2005),用分光光度计测定线粒体蛋白含量。COX活性采用氧电极法(oxygraph electrode system,Hansatech,UK)测定(Sundin et a1,l978;Zhao & Wang,2005)。UCP1采用Western blotting技术测定,上样量为10 μL。电泳结束后将蛋白转移至硝酸纤维素膜(Hybond-C,PALL,Gelman,USA),加入一抗(Thermo Scientific,USA),室温孵育2 h后,加入辣根过氧化酶标记的二抗(碧云天生物技术研究所),室温孵育l h。采用ECL荧光检测试剂盒(ECL,Amersham Biosciences,England)检测UCP1蛋白的荧光带(Zhao &Wang,2005;Zhao et al,2008)。
1.8 统计分析
数据处理采用SPSS 13.0软件包。SFR-Re驯化过程中体重、摄食量及行为活动的变化以重复测量的方差分析法(repeated one-way ANOVA)统计分析。体重、摄食量、DEI、消化率、血清瘦素、BAT COX活性以及UCP1含量组间差异以独立样本t-检验进行分析。SFR-Re对BMR、NST以及身体成分的影响以单因素协方差分析法(ANCOVA)进行分析,以体重或者胴体重为协变量。数据均以mean±SE表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 体 重
实验前动物体重组间差异不显著(d 0,t21= 0.3,P>0.05,图 2A),驯化期间对照组小鼠体重持续增长(d 1~42,F41,369=113.0,P<0.01),而 SFR-Re组体重显著波动,随机限食期间体重显著降低,最低为(29.4±0.7)g,低于对照组26.6%(d 7,t21=10.2,P<0.01),重喂食后体重显著增加(d 1~42,F41,492=183.0,P<0.01)。驯化结束后对照组和 SFR-Re组体重分别为(46.0±0.7)g和(46.9±0.7)g,组间差异不显著(d 42,t21=0.9,P> 0.05,图2A)。

图2 SFR-Re对KM小鼠体重(A)和摄食量(B)的影响Figure 2 Body mass (A) and food intake (B) changes of KM mice subjected to SFR-Re
2.2 摄食量、DEI和消化率
实验前对照组和 SFR-Re组摄食量分别为(5.8±0.2)g/d 和(5.9±0.2)g/d(d 0,t21=0.4,P>0.05,图2B)。SFR-Re组小鼠在重喂食期间摄食量显著增加,最大摄食量为13.7 g/d,高于对照组123.5%(d 22,t21=11.7,P<0.01),重喂食后期摄食量逐渐回落至对照组水平(d 42,t21=1.0,P>0.05)。SFRRe组DEI高于对照组49.7%(t21=9.6,P<0.01,图3A),且消化率也显著高于对照组(t21=7.6,P<0.01,图3B)。
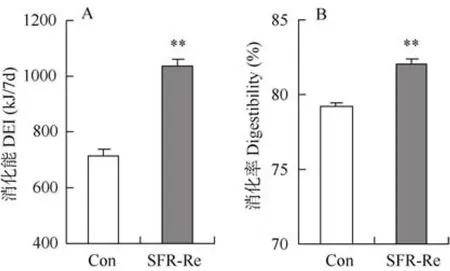
图3 SFR-Re对KM小鼠DEI(A)和消化率(B)的影响Figure 3 DEI (A) and digestibility (B) of KM mice subjected to SFR-Re
2.3 行为
与对照组相比,SFR-Re组小鼠的活动行为、摄食、修饰和休息行为均表现显著变化(活动,F8,81=37.2,P<0.01;摄食,F8,81=58.2,P<0.01;修饰,F8,81=6.3,P<0.01;休息,F8,81=6.2,P<0.01)(图4)。20%、40%和60%限食使活动行为显著增加,休息行为显著降低(Post hoc,P<0.05);80%和100%限食不影响活动行为和休息行为(Post hoc,P>0.05)。重喂食后动物的活动行为也显著高于对照组(Post hoc,P<0.05)。

图4 SFR-Re对KM小鼠活动(A)、摄食(B)、修饰(C)和休息行为(D)的影响Figure 4 General activities (A), feeding (B), grooming (C)and resting behaviors (D) of KM mice subjected to SFR-Re
2.4 BMR、NST和BAT COX活性以及UCP1含量
驯化结束后,SFR-Re组的BMR显著高于对照组(F1,17=28.9,P<0.01,图 5)。NSTmax的组间差异不显著(F1,17=28.9,P=0.2),但 SFR-Re 组的NST 高于对照组31.9%(F1,17=12.1,P<0.01,图 5)。限食和重喂食对 BAT线粒体蛋白含量的影响不显著((t18=0.4,P>0.05,图6A)。SFR-Re组COX活性低于对照组,但组间差异不显著(t18=1.9,P=0.07,图 6B)。SFR-Re组的 UCP1含量显著低于对照组(t18=3.1,P<0.05,图 6C,D)。

图5 SFR-Re对KM小鼠BMR、NSTmax和NST的影响Figure 5 BMR, NSTmax and NST in KM mice subjected to cycles of SFR-Re
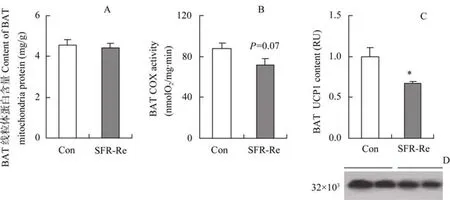
图6 SFR-Re对KM小鼠BAT线粒体蛋白含量(A)、COX活性(B)和UCP1含量(C,D)的影响Figure 6 BAT mitochondrial protein content (A), COX activity (B) and UCP1 content (C, D) of KM mice subjected to SFR-Re
2.5 身体成分和血清瘦素
SFR-Re组的脂肪重量高于对照组46.7%,肝脏重量显著高于对照组,胃、小肠和盲肠分别高于对照组29.7、63.0和33.7%,而血清瘦素的组间差异不显著(表1)。

表1 SFR-Re对KM小鼠身体成分和血清瘦素水平的影响Table 1 Body compositions and serum leptin levels of KM mice subjected to SFR-Re
3 讨论
体重调节受食物可利用性变化的影响,限食使许多动物的体重和脂肪含量显著降低(Sohar &Sneh,1973;Weindruch & Sohal,1997;Yang et al,2013)。本文也发现随机限食使KM小鼠体重显著降低。此外,限食50%和75%的大鼠体重也显著降低(Hill et al,1985;Sucajtys-Szulc et al,2008)。然而,限食80%的MF1小鼠体重未降低(Hambly &Speakman,2005)。可见限食对不同物种的体重影响并不完全一致(Hill et al,1985;Sucajtys-Szulc et al,2008),动物对限食的反应可能存在种间差异,也可能与限食程度有关,一般情况下,严厉限食驯化使动物体重降低幅度更大(Cao et al,2009)。重喂食后KM小鼠体重反弹,随后恢复至对照组水平,表现体重的“补偿性增长”。与我们的研究结果相似,SFR-Re大鼠体重亦出现“补偿性增长”,迅速恢复至对照组水平(Cleary,1986a,b;Szepesi &Epstein,1977;)。身体成分分析发现,3次SFR-Re驯化后的KM小鼠的脂肪重量、肝脏和消化道重量均显著高于对照组,暗示经历食物短缺后,在食物资源丰富时,动物将增加身体脂肪的能量贮存。消化道形态的适应性调节以及消化功能相关器官重量的显著增加,暗示消化吸收功能增强,消化效率提高,是动物体重“补偿性增长”的可能原因之一。
能量代谢的适应性调节是小型哺乳动物应对环境变化的主要生存策略(Hambly & Speakman,2005;Zhang & Wang,2008)。我们发现,KM小鼠在恢复自由取食后摄食量显著增加,最大摄食量增加至对照组的2.2倍。与本文研究结果相似,禁食后重喂食的KM小鼠也显著增加摄食量(Cao et al,2009;Zhao & Cao,2009;Zhao et al,2009a,b)。间断限食和重喂食也使实验大鼠摄食量显著增加(Cleary,1986b)。限食50%的金色刺毛鼠在恢复自由取食后摄食量也显著增加(Gutman et al,2006)。这些结果提示,在食物资源丰富的条件下,动物通过增加摄食量弥补限食导致的能量摄入不足,以尽快恢复能量收支平衡(Gutman et al,2006;Zhao et al,2009a,b)。SFR-Re后的KM小鼠DEI显著高于对照组,消化率显著增加(Zhao et al,2009a),同样,SFR-Re驯化后的大鼠消化率也显著增加(Archambault et al,1989)。即食物资源丰富时,动物通过增加摄食量,提高食物利用效率而加大能量摄入,这可能也是导致体重和脂肪“补偿性增长”的重要因素之一。
BMR、NST和活动行为的能量支出在能量代谢和体重调节中发挥重要作用(Hambly & Speakman,2005;Zhao et al,2008)。本研究中,SFR-Re驯化的KM小鼠降低了NST、BAT COX活性和UCP1含量,表明SFR-Re导致用于产热的能量支出显著降低。然而,我们发现SFR-Re导致KM小鼠的BMR显著增加,肝脏、胃、小肠和盲肠重量均显著高于对照组。研究表明,这些器官的能量代谢率水平较高,属于“代谢活性器官”,与BMR具有显著的正相关关系(Song & Wang,2006)。由此可见,增加的BMR可能主要用于维持代谢活性器官的功能。
SFR-Re显著影响KM小鼠的活动行为,低程度的限食使活动行为降低,而严厉的限食使活动行为显著增加。与本文研究结果相似,食物限制使大鼠(Boakes & Dwyer,1997)、KM小鼠(Cao et al,2009;Zhao et al,2009a,b)和黑线仓鼠(Zhao & Cao,2009)的活动行为显著增加。然而,Hambly &Speakman(2005)发现80%限食使MF1小鼠的活动行为显著减低。这些结果表明,动物的活动行为对限食的反应不尽相同,可能与物种的差异性和限食程度有关,在低程度限食条件下,动物可能通过降低自身维持的能量支出(基础代谢率)和行为活动,补偿能量摄入的不足(Hambly & Speakman,2005)。而当动物面临较严厉的随机限食甚至禁食时,则可能试图增加搜索食物的活动行为或者迁移行为,以增加获得丰富食物资源的机会(Boakes & Dwyer,1997;Hambly et al,2007;Speakman & Mitchell,2011)。自由取食后,KM小鼠的活动行为仍高于对照组,这或许表明经历随机限食的个体在食物资源丰富时仍增加搜索食物的活动行为。恢复自由取食后摄食量的显著增加不仅用于体重的“补偿性增长”,也用于维持较高水平的BMR和活动行为。
瘦素在摄食和脂肪代谢调节过程中发挥重要作用(Friedman & Halaas,1998)。研究表明,限食使血清瘦素水平显著降低,重喂食后显著回升(Zhang & Wang,2008)。然而,本研究发现SFR-Re驯化的KM小鼠血清瘦素水平未出现显著变化,与其他研究报道的结果不尽一致,这可能与不同研究所采用的限食处理方式不同有关。在先前的研究中,动物多采取固定比例的限食方法或者饥饿处理,然后恢复自由取食(Wisse et al,1999;Gutman et al,2006;Zhang & Wang,2008)。而在本研究中,KM小鼠以SFR-Re方式驯化,动物不能预测食物资源的变化规律。当食物资源丰富时,经历不规则限食的动物显著增加摄食量,增加身体脂肪贮存,以提高应对可能再次发生的食物短缺时期(Zhao &Cao,2009)。多次SFR-Re驯化使KM小鼠显著增加脂肪贮存,与自由取食的对照组动物相比增加了46.5%(P<0.01)。而SFR-Re动物的血清瘦素仅增加8.7%(P>0.05),表明重喂食后动物较迅速的增加脂肪组织重量,但并未按比例增加瘦素的合成和分泌。瘦素具有抑制摄食和促进能量支出的作用(Friedman & Halaas,1998)。重喂食后瘦素未显著增加,暗示其减弱了对摄食量的控制作用,从而准许动物在食物资源丰富时增加摄食量。
SFR-Re对KM小鼠的体重、摄食量和能量支出影响显著。随机限食使体重显著降低,重喂食后体重增加,表现体重的“补偿性增长”。重喂食后摄食量和消化率显著增加,脂肪组织重量、肝脏和胃肠道重量显著高于对照组。即经历随机限食的动物在食物资源丰富时增加脂肪组织的能量贮存,体重和脂肪组织“补偿性增长”。消化率的增加有利于体重的“补偿性增长”。随机限食和重喂食显著降低了 NST、BAT COX活性和 UCP1蛋白水平,表明产热能量支出显著降低,这也是动物体重“补偿性增长”的能量学对策之一。血清瘦素水平未显著增加,减弱了对摄食量的控制,从而准许动物增加摄食量,最终导致体重的“补偿性增长”。
Alvarenga TAF, Andersen ML, Papale LA, Antunes IB, Tufik S. 2005.Influence of long-term food restriction on sleep pattern in male rats. Brain Research, 1057 (1-2): 49-56.
Archambault CM, Czyzewski D, Cordua Y, Cruz GD, Foreyt JP, Mariotto MJ. 1989. Effects of weight cycling in female rats. Physiology and Behavior,46 (3): 417-421.
Boakes RA, Dwyer DM. 1997. Weight loss in rats produced by running:Effects of prior experience and individual housing. Journal of Experimental Psychology, 50 (2): B129-B148.
Cao J, Zhang LN, Zhao ZJ. 2009. Trade-off between energy budget,thermogenesis and behavior in Swiss mice under stochastic food deprivation.Journal of Thermal Biology, 34 (6): 290-298.
Cleary MP. 1986a. Consequences of restricted feeding/refeeding cycles in lean and obese female Zucker rats. Journal of Nutrition, 116:290-303.
Cleary MP. 1986b. Response of adult lean and obese female Zucker rats to intermittent food restriction/refeeding. Journal of Nutrition, 116 (8):1489-1499.
Friedman JM, Halaas JL. 1998. Leptin and the regulation of body weight in mammals. Nature, 395 (6074): 763-770.
Grodzinski W, Wunder BA. 1975. Ecological energetics of small mammals //Small Mammls: Their Productivity and Population Dynamics.Cambridge:Cambridge University Press, 173-204.
Gutman R, Choshniak I, Kronfeld-Schor N. 2006. Defending body mass during food restriction in Acomys russatus: a desert rodent that does not store food. American Journal of Physiology, 290 (4): R881-R891.
Hambly C, Mercer JG, Speakman JR. 2007. Hunger does not diminish over time in mice under protracted caloric restriction. Rejuvenation Research, 10(4): 533-542.
Hambly C, Speakman JR. 2005. Contribution of different mechanisms to compensation for energy restriction in the mouse. Obesity Research, 13 (9):1548-1557.
Heldmaier G. 1971. Nonshivering thermogenesis and body size in mammals.Journal of Comparative Physiology, 73 (2): 222-247.
Hill JO, Latiff A, DiGirolamo M. 1985. Effects of variable caloric restriction on utilization of ingested energy in rats. American Journal of Physiology,248 (5): R549-R559.
Sohar E, Sneh E. 1973. Follow-up of obese patients 14 years after a successful reducing diet. American Journal of Clinical Nutrition, 26 (8):845-848.
Song ZG, Wang DH. 2006. Basal metabolic rate and organ size in Brandt's voles (Lasiopodomys brandtii): Effects of photoperiod, temperature and diet quality. Physiology and Behavior, 89 (5): 704-710.
Speakman JR, Hambly C. 2007. Starving for life:What animal studies can and cannot tell us about the use of caloric restriction to prolong human lifespan. Journal of Nutrition, 137:1078-1086.
Speakman JR, Mitchell SE. 2011. Caloric restriction. Molecular Aspects of Medicine, 32 (3): 159-221.
Speakman JR, Gidney A, Bett J, Mitchell IP, Johnson MS. 2001. Limits to sustained energy intake IV. Effect of variation in food quality on lactating mice Mus Musculus. Journal of Experimental Biology, 204 (11): 1957-1965.Sucajtys-Szulc E, Goyke E, Korczynska J, Stelmanska E, Rutkowski B,Swierczynski J. 2008. Chronic food restriction differentially affects NPY mRNA level in neurons of the hypothalamus and in neurons that innervate liver. Neuroscience Letters, 433 (3): 174-177.
Sundin U, Moore G, Nedergaard J, Cannon B. 1978. Thermogenin amount and activity in hamster brown fat mitochondria:effect of cold acclimation.American Journal of Physiology, 252 (5): 822-832.
Szepesi B, Epstein MG. 1977. Effect of repeated food restriction-refeeding on growth rate and weight. The American Journal of Clinical Nutrition, 30(10): 1692-1702.
Wang DH, Wang ZW. 1990. Strategies for survival of small mammals in a cold alping environment II. Seasonal changes in the capacity of nonshivering thermogenesis in Ochotona curzoniae and Microtus oeconomus. Acta Theriologica Sinica, 10 (1): 40-53. [王德华, 王祖望.1990. 小哺乳动物在高寒环境中的生存对策. Ⅱ高原鼠兔和根田鼠非颤抖性产热 (NST) 的季节性变化. 兽类学报, 10 (1): 40-53.]
Wang DH, Wang YS, Wang ZW. 2000. Metabolism and thermoregulation in the Mongolian gerbil (Meriones unguiculatus). Acta Theriologica,45:183-192.
Wang JM, Wang DH. 2006. Comparison of nonshivering thermogenesis induced by dosages of norepinephrine from 3 allometric equations in Brandt’s voles (Lasiopodomys brandtii). Acta Theriologica Sinica, 26 (1):84-88. [王建梅, 王德华. 2006. 不同去甲肾上腺素剂量下布氏田鼠非颤抖性产热比较. 兽类学报, 26 (1): 84-88.]
Weindruch R, Sohal RS. 1997. Caloric intake and aging. New England Journal of Medicine, 337 (14): 986-994.
Wisse BE, Campfield LA, Marliss EB, Morais JA, Tenenbaum R, Gougeon R. 1999. Effect of prolonged moderate and severe energy restriction and refeeding on plasma leptin concentrations in obese women. American Journal of Clinical Nutrition, 70 (3): 321-330.
Yang CS, Zhu WL, Huang CM, Yu TT, Gao WR, Wang ZK. 2013. Effects of food restriction on energy metabolism in male Eothenomys miletus. Acta Theriologica Sinica, 33 (1): 55-62. [杨盛昌, 朱万龙, 黄春梅, 余婷婷, 高文荣, 王政昆. 2013. 食物限制对雄性大绒鼠能量代谢特征的影响. 兽类学报, 33 (1): 55-62.]
Zhang LN, Wang DH. 2008. Effects of food restriction and refeeding on energy balance regulation in Mongolian gerbils (Meriones unguiculatus) .BFDG Appetite, 51 (3): 751-764.
Zhang ZH, Cheng FH, Yu HC. 2007. Effect of different temperatures on the energy metabolism of mice. Journal of Agricultural Sciences, 28 (3): 18-20.[张振汉, 程富华, 于洪川. 2007. 不同温度对小鼠能量代谢的影响. 农业科学研究, 28 (3): 18-20.]
Zhao ZJ, Wang DH. 2005. Short photoperiod enhances thermogenic capacity in Brandt's voles. Physiology and Behavior, 85 (2): 143-149.
Zhao ZJ, Wang DH. 2006. Short photoperiod influences energy intake and serum leptin level in Brandt's voles (Microtus brandtii) . Hormones and Behavior, 49 (4): 463-469.
Zhao ZJ, Cao J. 2009. Plasticity in energy budget and behavior in Swiss mice and striped hamsters under stochastic food deprivation and refeeding.Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 154 (1): A84-A91.
Zhao ZJ, Cheng JF, Wang DH. 2008. Effects of photoperiod and high fat diet on energy intake and thermogenesis in Brandt’s voles Lasiopodomysbrandtii. Acta Zoologica Sinica, 54 (4): 576-589. [赵志军,陈竞峰, 王德华. 2008. 光周期和高脂食物对布氏田鼠能量代谢和产热的影响. 动物学报, 54 (4): 576-589.]
Zhao ZJ, Wang RR, Cao J, Pei LY. 2009c. Effect of random food deprivation and refeeding on energy budget and development in mice. Zoological Research, 30 (5): 534-538. [赵志军, 王瑞瑞, 曹静, 裴兰英. 2009c. 随机限食和重喂食小鼠能量收支和生长发育的可塑性. 动物学研究, 30 (5):534-538.]
Zhao ZJ, Cao J, Tian Y, Wang RR, Wang GY. 2009a. Effects of stochastic food deprivation on energy budget, body mass and activity in Swiss mice.Current Zoology, 55 (4): 249-257.
Zhao ZJ, Cao J, Wang GY, Ma F, Meng XL. 2009b. Effect of random food deprivation and re-feeding on energy metabolism and behavior in mice.Acta Theriologica Sinica, 29 (3): 277-285. [赵志军, 曹静, 王桂英, 马飞,孟喜龙. 2009a. 随机饥饿和重喂食对小鼠能量代谢和行为的影响. 兽类学报, 29 (3): 277-285.]
Zhao ZJ, Liu JJ, Zhang H, Yu R, Zhao YL. 2011. Body mass and behavior in Swiss mice subjected to continuous or discontinuous food restriction and refeeding. Acta Theriologica, 56 (2): 129-139.
